小眼畸形相关转录因子(MITF)的研究进展
蔡永强,李 园,刘文艳,张利环,李慧锋,李 宏,朱芷葳
(山西农业大学生命科学学院,山西 太谷 030801)
小眼畸形相关转录因子(MITF)的研究进展
蔡永强,李 园,刘文艳,张利环,李慧锋,李 宏,朱芷葳
(山西农业大学生命科学学院,山西 太谷 030801)
小眼畸形相关转录因子(MITF)是一种具有典型螺旋—环—螺旋—亮氨酸拉链结构的转录因子,目前已经发现其存在于许多物种中,参与生物体生长、发育、分化和功能调节等各个方面。对MITF的研究进展进行了综述,以期为今后相关研究的开展提供有益参考。
MITF;转录因子;色素细胞;表达调控
小眼畸形相关转录因子(microphthalmiaassociated transcription factor,MITF) 具有典型的螺旋—环—螺旋—亮氨酸拉链结构(basic helix-loophelix leucine zipper,bHLHZip), 属于 MiT 转录因子超家族,其中还包括EB(transcription factor EB,TFEB)、EC(transcription factor EC,TFEC) 和 E3(transcription factor E3,TFE3)。 1942 年,Hertwig 等人利用放射性诱导突变的方法处理小鼠,发现其后代中出现小眼畸形、早发性耳聋、皮毛和虹膜色素减退等性状;经研究发现该类小鼠都是同一个等位基因发生突变,他们将这些小鼠命名为microphthalmia(小眼畸形)(mi/mi)小鼠,并将突变位点称为 mi[1]。 1990 年,Hara 等人在研究血管加压素启动子的调控机制时获得一种转基因小鼠VGA-9,该类小鼠表现出小眼畸形和白色皮毛等性状;他们发现VGA-9小鼠表型与mi小鼠类似,等位基因研究证实VGA-9小鼠转基因插入突变恰好发生在 mi位点[2]。 1993 和 1994 年,Hodgkinson 和Tachibana等人分别利用VGA-9小鼠成功克隆出microphthalmia基因[3]。经过科学家多年的不断研究,到目前为止,已分离出的与mi相关的等位基因有 20 余种[4]。
研究发现,MITF主要在色素细胞中表达,包括成黑色素细胞(melanoblast)和视网膜色素上皮细胞(retinal pigment epithelium,RPE)。 同时也会在其他细胞中表达,如肥大细胞和破骨细胞等[5]。mitf基因的突变会导致许多物种出现一系列的表型变化,尤其是在色素细胞中,部分突变可影响RPE,导致眼的色素缺失、减退及小眼畸形。人类mitf基因表达缺失会引起Waardenburg综合征Ⅱ型[6]。该类型的患者表现为先天性白内障和神经性耳聋。还有少数的mitf等位基因可通过影响破骨细胞导致骨硬化等[7]。
1 mitf的定位及蛋白异构体
人类mitf基因位于3号染色体3p12.3-3p14.1,全长 228 900 bp,包含 23个外显子,共有18个转录本,编码蛋白长度为71~526个氨基酸;小鼠mitf基因位于6号染色体,由9个外显子构成[8];果蝇 mitf基因定位于 4号染色体上,全长25 616 bp,编码730~4 032个氨基酸。目前,在NCBI数据库中已经确定mitf基因所在染色体位置的还有黑猩猩、猕猴、仓鼠、斑马鱼、兔、狗、家猫、奶牛、山羊、绵羊、猪、马、鸡等物种。
小鼠mitf基因编码的蛋白称为MITF蛋白,由419个氨基酸残基构成,其中的bHLHZip结构为蛋白质功能区。bHLH转录因子包括2个保守区域:一个碱性区域,分布于肽链的N端,与DNA结合有关;另一个是HLH区域,分布于C端,主要是一些疏水性氨基酸,有利于互作形成二聚体。bHLHZip与自身或具有类似结构的转录因子 (又称MiT家族)形成同源或异源二聚体行使功能,与启动子区域的 5′-CACGTG-3′或 5′-TCATGTG-3′结构 (E-box或M-box)特异性结合。不同启动子调控mitf,导致编码多个蛋白异构体,包括MITF-A、B、C、D、E、H、J、Mc、CM 和 M 等。 其中,MITF-M 最为丰富,特异性表达于成黑色素细胞中;MITF-A主要在RPE中表达,在胚胎期的RPE中富集,最终存在于眼球中;MITF-H主要存在于心脏组织,在多种类型的细胞中都有表达;MITF-C在黑色素细胞中不表达;MITF-D在RPE、巨噬细胞和破骨细胞中表达;MITF-E和MITF-Mc优先表达于肥大细胞[9-11]。
2 MITF的进化
MITF属于24个bHLH转录因子超家族中的一员,其中有6个家族含有亮氨酸拉链结构域,包括 MYC、MAd、SREBP、AP-4、USF 和 TFE 家族。研究发现,这些家族都是多源性的[12]。MITF与TFEC、TFE3和TFEB的亲缘关系最近,因此也可以认为MITF属于MiT家族中的一员[13-14]。对亲缘关系远近不同的多种生物的mitf基因作系统进化树分析,结果显示,mitf的bHLHZip结构域、N端、C端活性结构域和微管相关蛋白激酶靶基因序列是高度保守的。除斑马鱼外,其他物种的糖原合酶和丝氨酸/苏氨酸激酶靶基因序列也是相对保守的[15]。
3 MITF的表达
3.1 MITF在小鼠色素细胞中的表达过程 小鼠胚胎的原位杂交研究表明,MITF在神经嵴细胞的发育早期表达,首先在头部,最后出现在尾部[16]。在胚胎期9.5 d,视神经上皮层最早观察到MITF阳性细胞。在胚胎期10.5 d,MITF表达受限于RPE。直到胚胎期16.5 d,在RPE中仍然可以观察到MITF阳性细胞,之后在由神经嵴细胞分化而来的视杯细胞中也出现,后者可能分化成脉络膜和虹膜色素细胞。胚胎期10 d时,可在神经嵴头侧和迷走神经嵴首次观察到MITF阳性细胞。随着胚胎的发育,MITF阳性细胞的数目开始增加,在背—侧和腹—中线神经嵴迁移通路中都可以观察到这些细胞。例如,MITF阳性细胞会出现在27~28体节期的听囊和后脑的神经上皮,在胚胎期10.5 d时位于耳囊和后脑的神经上皮之间,数量逐渐增加,并与视泡在随后的几天紧密相关,最后在胚胎期16.5 d时,在既定的纹脉管处累积。在胚胎期12.5 d,MITF阳性细胞沿神经嵴背—侧通路出现在皮肤的上皮细胞层,在胚胎期16.5 d时的真皮和表皮中仍可以观察到。一般情况下,MITF阳性细胞在胚胎期数量先增加,达到最大值后开始减少,出生时消失,但毛囊除外[17]。
3.2 MITF在皮肤、耳和眼睛的表达 皮肤黑色素细胞来源于神经嵴,MITF深入参与其分化[18]。原位杂交试验结果表明,毛囊是成年小鼠唯一表达MITF的组织,表明MITF在毛囊黑色素细胞的发育过程中也是作为转录因子发挥其功能。而在人类的表皮也分布有大量的成黑色素细胞,这些表皮色素细胞具有分裂功能和杀菌作用,能够抵抗紫外线和其他外界刺激,MITF也可能参与其中。
在内耳,黑色素细胞起源于神经嵴,最后迁移到耳蜗和前庭器官。虽然黑色素细胞在前庭器官的功能还有待发现,但是它们在耳蜗中却扮演了重要的角色[19]。黑色素细胞以中间细胞的形式存在于耳蜗血管纹,并和其中的钾离子通道构成膜内电位的主要来源。血管纹产生耳蜗电位向耳蜗内淋巴分泌钾离子[20]。人类和小鼠突变MITF/Mitf往往与听力障碍相关,会引起失聪,但是MITF突变不会对鹌鹑造成听力缺陷[21]。
眼睛含有2种类型的色素细胞:神经嵴发育而来的成黑色素细胞和源于神经上皮的RPE。它们的前体细胞的分化分别受到MITF-M和MITF-A的调控。Mochii等人对白来航鸡和日本鹌鹑进行了研究,发现MITF-A参与调控眼睛的发育[22]。通过标记色素细胞特有基因,如Mmp115(编码1个115 ku的黑色素瘤基质金属蛋白酶)基因,发现MITF-A主要在鸡胚胎RPE表达。在体外培养的RPE中过表达MITF-A会抑制由bFGF诱导的脱分化和去分化形成水晶体和神经细胞。因此,下调MITF-A表达也被认为对RPE的去分化是至关重要的。
4 MITF对黑色素相关基因表达的调控
研究表明,MITF参与色素沉着过程,它会直接作用于基因的转录调节(见图1)。MITF通过激活黑色素细胞的特定基因,如酪氨酸酶(tyrosinase,TYR)、酪氨酸酶相关蛋白 1(tyrosinase related protein 1,TYRP1)、酪氨酸酶相关蛋白 2(tyrosinase related protein 2,TYRP2)、MART1/MLANA、SILV/PMEL17、AIM1和TRPM1。这些基因连同它们的激活过程,表现出谱系特异性表达模式,因此,MITF有潜力作为细胞系标记的重要基因而被广泛应用[23]。
黎钊等[24]对人工培养的原代正常人黑色素细胞,利用miRNA干扰技术(慢病毒感染)进行mitf基因沉默,运用实时荧光定量PCR和免疫印迹的方法,分别检测mitf基因沉默前后,MITF、TYR、TYRP1和TYRP2/DCT的mRNA与蛋白表达水平。结果表明,MITF转录调控人类黑色素细胞的TRPs蛋白酶家族,但TYRP2可能不完全依赖于MITF的转录调控。将MITF cDNA转染至成纤维NIH3T细胞,可使成纤维细胞转化成树突状细胞并表达TYR和TYRP-1等黑色素细胞特异性标志物[25]。此外,MITF还调控众多与黑素体成熟及转运密切相关的基因[26]。
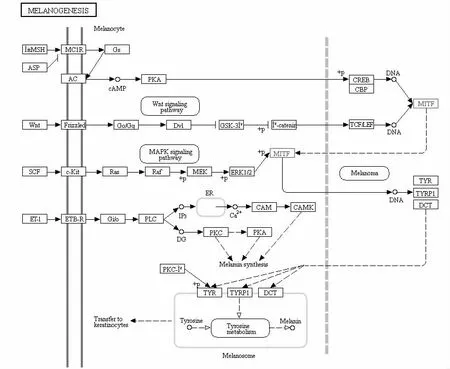
图1 MITF参与黑素相关基因表达调控的信号通路
5 MITF对其他基因表达的调控
MITF还与细胞周期、分化、衰老、凋亡、增殖和迁移等生物学行为相关,此外还与cAMP水平、新陈代谢、miRNA 加工 (DICER)[27]、DNA 修复等有关。第一个被发现具有促增殖特性的MITF靶基因是T-box转录因子2(T-box transcription factor 2,TBX2),MITF过表达于黑色素瘤细胞系,通过上调TBX2基因发挥促增殖和抗衰老的作用[28]。此外,MITF还可通过调控细胞周期依赖性蛋白激酶2(cyclin-dependent kinase 2,CDK2)、 细胞周期蛋白依赖性激酶抑制因子1A/B(cyclin-dependent kinase inhibitor 1A/B,CDKN1A/B)和 CDKN2A 等[29-31],从而抑制细胞周期。MITF通过上调B细胞淋巴瘤因子-2(B cell lymphoma-2,Bcl-2)和 C-MET 等抗凋亡蛋白促进肿瘤发展[32]。 缺氧诱导因子-1ɑ(hypoxia inducible factor-1ɑ,HIF-1ɑ) 在黑色素瘤中不仅具有抗凋亡作用,还可刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)的生成。 Cheli等[33]研究发现 MITF 可转录激活 HIF-1ɑ,从而促进肿瘤血管生成。蛋白透光形成素(diaphanous related formin 1,Dia1)、miR-211 和 β-catenin 等与黑色素瘤浸润密切相关的蛋白编码基因也受到MITF调控[34-35]。
6 小结
MITF是重要的转录因子,它在生物体生命活动过程中扮演着不可或缺的角色,影响着生物体的生长、发育、分化和衰亡的各个时期,特别是对动物毛发形成具有重要的生物学意义。目前,对MITF的研究越来越多,尤其是在黑色素细胞及色素生成调控方面的研究日益完善。MITF的生理作用只在少数几个物种中被人们关注,而在其他相关物种中,关于MITF参与机体生理功能调控作用的机制方面的研究还相对较少,因此,有必要进一步开展这方面的研究。
[1]TACHIBANA M.MITF:a stream flowing for pigment cells[J].Pigment Cell Res,2000,13(4):230-240.
[2]TACHIBANA M,HARA Y,VYAS D,et al.Cochlear disorder associated with melanocyte anomaly in mice with a transgenic insertional mutation [J].Mol Cell Neurosci,1992,3(5):433-445.
[3]TACHIBANA M,PEREZ-JURADO L A,NAKAYAMA A,et al.Cloning of MITF,the human homolog of the mouse microphthalmia gene and assignment to chromosome 3p14.1-p12.3 [J].Hum Mol Genet,1994,3(4):553-557.
[4]HSIAO J J,FISHER D E.The roles of microphthalmiaassociated transcription factorand pigmentation in melanoma[J].Arch Biochem Biophys,2014,563:28-34.
[5]CARREIRA S,GOODALLJ,DENATL,etal.Mitf regulation of Dia1 controls melanoma proliferation and invasiveness[J].Genes Dev,2006,20(24):3426-3439.
[6]刘铮铮.Waardenburg综合征Ⅱ型一家系的临床分析和MITF基因的突变检测[D].长沙:中南大学,2007.
[7]金小冬,卢丽,李青南.MITF在破骨细胞中的作用研究进展[J].中国骨质疏松杂志,2014,20(5):547-550.
[8]白瑞,张美萍,乔德瑞,等.MITF基因与动物毛色的研究进展[J].上海畜牧兽医通讯,2006(4):2-3.
[9]HODGKINSON C A,MOORE K J,NAKAYAMA A,et al.Mutationsatthe mouse microphthalmialocusare associated with defects in a gene encoding a novel basichelix-loop-helix-zipper protein [J].Cell,1993,74(2):395-404.
[10]AMAE S,FUSE N,YASUMOTO K,et al.Identification of a novel isoform of microphthalmia -associated transcription factor that is enriched in retinal pigment epithelium[J].Biochem Biophys Res Commun,1998,247(3):710-715.
[11]MOCHII M,MAZAKI Y,MIZUNO N,et al.Role of Mitf in differentiation of chicken pigmented epithelial cell[J].Develop Biol,1998,193(1):47-62.
[12]ATCHLEY W R,FITCH W.A natural classification of the basic helix-loop-helix class of transcription factors[J].Proc Natl Acad Sci USA,1997,94(10):5172-5176.
[13]REHLI M,Den ELZEN N,CASSADY A I,et al.Cloning and characterization of murine genes for bHLH-Zip transcription factors TFEC and TFEB revealed a common gene organization for all MiT subfamily members [J].Genomics,1999,56(1):111-120.
[14]HEMESATH T J,STEINGRIMSSON E,McGILL G,et al.Microphthalmia,a critical factor in melanocyte development defines a discrete transcription factor family[J].Gene Dev,1994,8(22):2770-2780.
[15]FUSE N,YASURNOTO K,TAKEDA K,et al.Molecular cloning of cDNA encoding a novel microphthalmiaassociated transcription factor isoform with a distinct amino-terminus [J].J Biochem,1999,126 (6):1043-1051.
[16]田腾飞,李祥龙.不同物种Mitf基因编码区生物信息学分析[C]//第十二次全国畜禽遗传标记研讨会论文集.北京:中国畜牧兽医学会畜禽遗传标记分会,2010.
[17]NAKAYAMA A,NGUYEN M T,CHEN C C,et al.Mutations in microphthalmia,the mouse homolog of the human deafness gene MITF,affect neuroepithelial and neural crest-derived melanocytes differently [J].Mech Dev,1998,70(1/2):155-166.
[18]SLOMINSKI A. Neuroendocrine activity of the melanocyte[J].Experimental Dermatology,2009,18(9):760-763.
[19]周泓燕.MITF基因对动物毛色中黑色素细胞的作用[J].中国畜牧兽医文摘,2015,31(3):46.
[20]KELSH R N,HARRIS M L,COLANESI S,et al.Stripes and belly-spots-a review of pigment cell morphogenesis in vertebrates[J].Semin Cell Dev Biol,2009,20(1):90-104.
[21]MOCHII M,ONO T,MATSUBARA Y,et al.Spontaneous transdifferentiation of quail pigmented epithelial cell is accompanied by a mutation in the Mitf gene [J].Dev Biol,1998,196(2):145-159.
[22]LEVY C,FISHER D E.Dual roles of lineage restricted transcription factors:the case of MITF in melanocytes[J].Transcription,2011,2(1):19-22.
[23]赵鹤凌.刺参 Apostichopus japonicus(Selenka)白化特征发生机理的基础研究[D].青岛:中国科学院研究生院,2011.
[24]黎钊,王平,洪为松,等.正常人黑素细胞MITF对酪氨酸酶相关蛋白的转录调控研究 [J].医学研究杂志,2013,42(3):58-62.
[25]TACHIBANA M,TAKEDA K,NOBUKUNI Y,et al.Ectopic expression of MITF,a gene for Waardenburg syndrome type 2,converts fibroblasts to cells with melanocyte characteristics [J].Nat Genet,1996,14(1):50-54.
[26]马家芳,孔燕,郭军.MITF在黑素瘤中的研究现状及进展[J].肿瘤,2013,33(12):1130-1134.
[27]LEVY C,KHALED M,ROBINSON K C,et al.Lineagespecific transcriptional regulation of DICER by MITF in melanocytes[J].Cell,2010,141(6):994-1005.
[28]VANCE K W,CARREIRA S,BROSCH G,et al.Tbx2 is overexpressed and plays an important role in maintaining proliferation and suppression of senescence in melanomas[J].Cancer Res,2005,65(6):2260-2268.
[29]CARREIRA S,GOODALL J,AKSAN I,et al.MITFcooperates with Rb1 and activates p21Cip1 expression to regulate cell cycle progression [J].Nature,2005,433(7027):764-769.
[30]DU J,WIDLUND H R,HORSTMANN M A,et al.Critical role of CDK2 for melanoma growth linked to its melanocyte-specific transcriptional regulation by MITF[J].Cancer Cell,2004, 6(6):565-576.
[31]CARREIRA S,GOODALLJ,DENATL,etal.Mitf regulation of Dia1 controls melanoma proliferation and invasiveness[J].Genes Dev,2006,20(24):3426-3439.
[32]MASCARENHAS J B,LITTLEJOHN E L,WOLSKY R J,et al.PAX3 and SOX10 activate MET receptor expression in melanoma [J].Pigment Cell Melanoma Res,2010,23(2):225-237.
[33]CHELI Y,GIULIANO S,FENOUILLE N,et al.Hypoxia and MITF control metastatic behaviour in mouse and human melanoma cells [J].Oncogene,2012,31 (19):2461-2470.
[34]BOYLE G M,WOODS S L,BONAZZI V F,et al.Melanoma cell invasiveness is regulated by miR-211 suppression of the BRN2 transcription factor[J].Pigment Cell Melanoma Res,2011,24(3):525-537.
[35]AROZARENA I,BISCHOF H,GILBY D,etal.In melanoma,beta-catenin is a suppressor of invasion [J].Oncogene,2011,30(45):4531-4543.
Research Progress on Microphthalmia Associated Transcription Factor(MITF)
CAI Yong-qiang,LI Yuan,LIU Wen-yan,ZHANG Li-huan,LI Hui-feng,LI Hong,ZHU Zhi-wei
(College of Life Science,Shanxi Agricultural University,Taigu 030801,China)
Microphthalmia associated transcription factor(MITF) which has a typical helix-loop-helix-leucine zipper structure is found to exist in many species.MITF is involved in the growth,development,differentiation and function regulation of the organisms.The research progress on MITF was reviewed in this paper,so as to provide useful references for the further study on MITF.
MITF;transcription factor;pigment cell;expression regulation
Q75;S813.1
A文章顺序编号:1672-5190(2016)10-0016-04
2016-09-05
项目来源:国家自然科学基金项目(31402156);山西省基础研究项目(2014021028-2);山西省科技重点研发项目(2015-TN-10);山西农业大学青年拔尖创新人才支持计划(TYIT201403);山西省科技攻关项目基金(20140311021-4)。
蔡永强(1990—),男,硕士研究生,主要研究方向为动物生物化学与分子生物学。
朱芷葳(1981—),女,副教授,博士,硕士生导师,主要研究方向为哺乳动物毛色基因调控。
(责任编辑:赵俊利)

