结合型胆汁酸对胆管癌的诊断价值
王文娟,郑 丹,刘 彬
(1.成都市妇女儿童中心医院 检验科,四川 成都 610014;2.广汉市人民医院 检验科,四川 广汉 618300;3.广汉市人民医院 肝胆科,四川 广汉 618300)
临床经验交流
结合型胆汁酸对胆管癌的诊断价值
王文娟1,郑丹2,刘彬3
(1.成都市妇女儿童中心医院 检验科,四川 成都610014;2.广汉市人民医院 检验科,四川 广汉618300;3.广汉市人民医院 肝胆科,四川 广汉618300)
目的 探讨胆汁酸代谢的改变对胆管癌的诊断价值。方法 采用反向高效液相色谱紫外检测法(RP-HPLC-UV)分别测定15例胆管癌患者、38例胆结石患者以及21例无胆道疾病的腹部外伤患者胆汁中9种结合型胆汁酸浓度。结果 胆管癌组胆汁中甘氨胆酸(GCA)和甘氨鹅脱氧胆酸(GDCA)明显高于胆结石组和对照组(P<0.05);胆结石组胆汁中牛磺胆酸(TCA)、牛磺脱氧胆酸(TDCA)高于胆管癌组和对照组(PP<0.05)。结论 胆汁中结合型胆汁酸谱可作为潜在的生物学指标来早期诊断胆管癌。
胆管癌;胆汁;胆汁酸;色谱法
胆管癌是一种恶性程度很高,难于早期诊断和治疗的恶性肿瘤。有研究发现无论是肝内胆管癌还是肝外胆管癌均源自于胆道系统的导管上皮细胞[1]。已知的危险因素包括Caroli 病、慢性病毒性肝炎、化学性致癌因素、肝内胆管结石、寄生虫病,原发性硬化性胆管炎(PSC)[2]等。大多数胆管癌患者在确诊时肿块已经无法切除,在过去30年,包括手术切除的全部胆管癌患者的5年生存率仅为5%[3],因此胆管癌的早期诊断和鉴别诊断十分重要。胆管癌患者早期,B超、CT和MRI等影像学检查很少能发现病灶,肿瘤标志物检查亦缺乏特异性,待发现时已属晚期,预后较差。胆结石是胆管癌已知的危险因素,为了帮助提高早期诊断率和与胆结石的鉴别诊断,本研究对胆管癌、胆结石患者以及对照组胆汁中结合型胆汁酸谱的分析以期找到更合适的诊断胆管癌的方法。
1 对象与方法
1.1研究对象广汉市人民医院肝胆科2014年3月至2015年5月收治胆结石患者38例(男14例,女24例),年龄(50.50±18.74)岁,为B超和/或腹部CT检查确诊并排除其他消化道疾病患者;胆管癌15例(男6例,女9例),年龄(55.00±10.42)岁,为病理学确诊并排除其他消化道肿瘤患者;对照组21例(男12例,女9例),年龄(46.30±10.52)岁,为无肝胆疾病的腹部外伤患者。
1.2方法胆汁样本通过外科手术或ERCP获得,采集后立即-80℃冻存。胆汁测定方法采用预先建立起来的固相萃取-高效液相色谱-紫外检测法[4],用此法测定胆汁中牛磺熊脱氧胆酸(TUDCA)、牛磺胆酸(TCA)、甘氨胆酸(GCA)、甘氨石胆酸(GLCA)、牛磺鹅脱氧胆酸(TCDCA)、牛磺脱氧胆酸(TDCA)、甘氨鹅脱氧胆酸(GCDCA)、甘氨脱氧胆酸(GDCA)和牛磺石胆酸(TLCA)9种结合型胆汁酸。
1.2.1色谱条件色谱仪为Shimadzu 2010高效液相色谱仪(日本Shimadzu公司),色谱柱为Waters Nova C18柱(3.9 mm×150 mm,5 μm),流动相为甲醇-60 mmol/L磷酸盐缓冲液(66∶34,v/v),pH 3.3,等度洗脱,柱温25℃,流速0.8 mL/min;检测波长197 nm,进样量为10 μL。
1.2.2样品预处理方法取胆汁20 μL,加入5 mL/L甲酸溶液1 mL,旋涡震荡混匀后加至已活化的固相萃取C18小柱上(预先用甲醇1 mL和5 mL/L甲酸溶液1 mL依次活化C18小柱),用5 mL/L甲酸2 mL和450 mL/L甲醇溶液1 mL依次淋洗小柱,最后用3 mL甲醇洗脱胆汁酸。洗脱液在60 ℃氮气下吹干后溶于200 μL流动相,超声30 s,10 μL进样。

2 结果
2.1人口学基本特征分析对3个组的年龄进行分析,差异无统计学意义(F=1.42,P=0.25),对3个组性别构成进行比较,差异无统计学意义(χ2=2.35,P=0.31),3个组在人口学基本特征上均衡可比。
2.2胆汁酸色谱图分析通过分析胆汁酸色谱图可以发现,胆管癌患者、胆结石患者及对照组的色谱图差异较大(见图1),GCA和GCDCA在胆管癌患者的色谱图中升高较为明显,而胆结石患者中各结合胆汁酸含量较正常组都有升高。
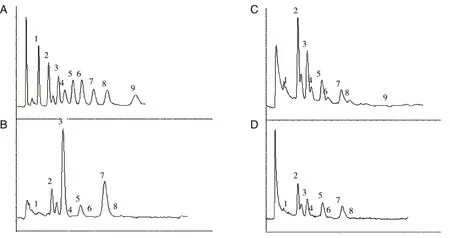
A: 胆汁酸标准品的色谱图;B:胆管癌患者的色谱图;C:胆结石患者的色谱图;D :对照组患者的色谱图 ;1:TUDCA;2:TCA;3:GCA;4:GLCA;5:TCDCA;6:TDCA;7:GCDCA;8:GDCA;9:TLCA。图1 各组胆汁酸色谱图比较
2.39种结合型胆汁酸构成比在3个组间的比较由于影响胆汁中结合型胆汁酸含量(绝对值)的因素较多,其结果可能受分析方法、地区人群、饮食结构等影响,所以仅比较各组结合型胆汁酸的含量,结果并不可靠。本研究也发现各组病人胆汁酸组分浓度变异较大,所以采用胆汁酸构成比来比较各组胆汁酸谱的差异。比较3组间9种结合型胆汁酸构成比的差异,发现胆管癌组胆汁中GCA和GCDCA明显高于胆结石组和对照组,而胆结石组中TCA、TDCA高于胆管癌组和对照组(见表1)。
表19种结合型胆汁酸比值在胆结石、胆管癌与对照组中的结果比较

胆汁酸构成比(%)对照组(n=21)胆结石组(n=38)胆管癌组(n=15)F/χ2PTUDCA5.0±7.82.7±5.93.7±4.11.92*0.433TCA25.5±16.3A30.6±4.5B16.8±10.0C9.980.0002GCA25.8±9.8B22.8±5.4B36.4±8.7A19.34<0.0001GLCA1.2±0.51.3±0.50.9±0.82.640.0787TCDCA20.8±3.417.7±15.212.5±7.32.260.1123TDCA1.0±2.7A6.8±1.1B3.1±1.5C31.45<0.0001GCDCA18.9±6.1A14.8±5.9B23.9±9.0C10.380.0001GDCA0.9±2.32.7±1.11.8±1.345.63<0.0001TLCA0.9±0.60.6±0.60.9±0.72.160.1232
*:采用Kruskal-Wallis检验, A、B、C:采用SNK-q检验两两比较后,字母不同的组别,差异具有统计学意义。TUDCA:牛磺熊脱氧胆酸;TCA:牛磺胆酸;GCA:甘氨胆酸;GLCA:甘氨石胆酸;TCDCA:牛磺鹅脱氧胆酸;TDCA:牛磺脱氧胆酸;GCDCA:甘氨鹅脱氧胆酸;GDCA:甘氨脱氧胆酸;TLCA:牛磺石胆酸。
3 讨论
胆管癌是一种常见于肝胆管内外的病死率极高的恶性肿瘤,它一般与慢性胆汁淤积、胆汁酸明显升高以及胆管阻塞等相联系。胆管阻塞可能会引起胆管癌患者胆汁中胆汁酸浓度和成分的变化,并且胆汁酸转运的改变可能造成胆汁酸排泄减少从而增加致癌胆汁酸在胆管上皮的累积[5]。有证据显示胆汁淤积和异常的胆汁酸代谢轮廓与胆管癌的发生发展关系更为密切[6]。然而哪些胆汁酸会促进胆管癌的发生和能引起胆道肿瘤侵袭性生长的机制还尚未明确。最新的研究[7]显示,结合型胆汁酸而非游离胆汁酸可刺激胆管癌细胞的生长,并且游离和结合胆汁酸比值的平衡在其对胆管癌的致癌性中扮演了重要角色。动物模型[8]显示结合型胆汁酸通过1-磷酸鞘氨醇受体2(S1PR2)介导刺激细胞外信号调节蛋白激酶1/2 (ERK1/2)和蛋白激酶B(AKT)信号通路。有体外研究进一步显示[9]结合型胆汁酸激活了ERK1/2和AKT信号通路,并明显刺激了胆管癌细胞侵袭性生长。还有研究[10]显示胆汁酸的致癌机制可能与胆管细胞的氧化应激机制有关,该研究发现GCDCA在大鼠胆管细胞中可诱导活性氧(ROS)的产生和谷胱甘肽(GSH)的消耗从而引起细胞脱氧核糖核酸(DNA)氧化损伤,而其他胆汁酸未引起明显的改变,还发现GCDCA对细胞长期的DNA氧化损伤导致胆管细胞癌变。
本研究显示GCA、GCDCA在胆管癌患者胆汁中明显增加,TCA则减少,TDCA比胆结石组减少比对照组增加;而TCA、TDCA在胆结石患者胆汁中明显升高,GCDCA和GCA则明显减少。本研究发现胆管癌患者胆汁中甘氨结合型胆汁酸相对增高,牛磺结合型胆汁酸相对减少;胆结石患者则是牛磺结合型胆汁酸相对升高,甘氨结合型相对减少。有报道[11]显示牛磺结合型胆汁酸的钙结合力明显低于甘氨结合型,本研究中胆结石组牛磺结合型胆汁酸升高可能引起胆汁酸与Ca2+总结合力下降,胆汁中游离Ca2+增加,而Ca2+在多个环节参与了结石的形成[12]。Sharif[13]等报道胆管癌患者与其他良性胆道疾病相比较初级胆汁酸和它们的甘氨结合型明显增加,这与本研究甘氨结合型胆汁酸在胆管癌中升高的结果一致。胆汁酸在胆管细胞中转运平衡对维持胆管细胞正常生理功能和免受胆汁酸毒性作用具有重要意义[14]。因此本研究认为胆汁中胆汁酸的亚组分改变可能对胆管癌的发生发展具有一定的作用,增加的致癌胆汁酸打破了胆汁酸水平的平衡再加上胆汁酸的细胞毒性引起胆管上皮细胞DNA氧化损伤和突变从而引起癌变的发生。胆管癌和其他良性的胆道疾病可能具有其特异的胆汁酸代谢谱,胆汁中结合型胆汁酸代谢轮廓分析可能有助于胆管癌的早期诊断。
[1] Olnes M J, Erlich R. A review and update on cholangiocarcinoma[J].Oncology, 2004, 66(3): 167-179.
[2] 杨兴无,杨春明. 胆管癌的诊治进展[J]. 中华肝胆外科杂志, 2007,13(11): 787-790.[3] Shsib Y,El-Serag H B. The epidemiology of cholangiocarcinoma [J].Semin Liver Dis,2004,24(2):115-125.
[4] 王文娟,邓文平,王猛,等.高效液相色谱法同时测定胆汁中9种结合型胆汁酸[J].重庆医科大学学报,2009,34(1):59-62.
[5] Trauner M, Wanger M,Fickert P, et al. Molecular regulation of hepatobiliary transport systems:clinical implications for understanding and treating cholestasis[J].Clin Gastroenterol,2005,39(4):111-124.
[6] Jusakul A, Khuntikeo N, Haigh W G, et al. Identification of biliary bile acids in patients with benign biliary diseases, hepatocellular carcinoma and cholangiocarcinoma[J]. Asia Pac J Cancer Prev, 2012,13:77-82.
[7] Hashim Abdalla M S, Taylor-Robinson S D, Sharif A W, et al. Differences in phosphatidylcholine andbile acids in bile from Egyptian and UK patients with and without cholangiocarcinoma[J]. HPB (Oxford),2011,13(6):385-390.
[8] Studer E, Zhou X, Zhao R, et al. Conjugated bile acids activate the sphingosine-1-phosphate receptor 2 in primary rodent hepatocytes[J]. Hepatology, 2012,55(1):267-276.
[9] Liu R P, Zhao R P, Zhou X Q,et al. Conjugated bile acids Promote Cholangiocarcinoma cell invasive growth through activation of Sphingosine 1-phosphate receptor 2[J]. Hepatology ,2014,60(3):908-918.
[10] Komichi D, Tazuma S, Nishioka T,et al.Glycochenodeoxychalate play a carcinogenic role in immortalized mouse cholangiocytes via oxidative DNA damage[J]. Free Radic Biol Med,2005,39(11):1418-1427.
[11] Gleeson D,Murphy G M,Dowling R H.Calcium binding by bile acids: in vitro studies using a calcium ion electrode[J ]. Lipid Res,1990,31(5):781-791.
[12] Yu J K,Pan H,Huang S M,et al. Calcium content of different compositions of gallstones and pathogenesis of calcium carbonate gallstones[J].Asian J Surg,2013,36(1):26-35.
[13] Sharif A W, Williams H R, Lampejo T, et al: Metabolic profiling of bile in cholangiocarcinoma using in vitro magnetic resonance spectroscopy[J]. HPB (Oxford),2010,12(6): 396-402.
[14]程龙,骆助林,向珂,等.正常大鼠胆管细胞胆汁酸转运蛋白表达的异质性[J] .遵义医学院学报,2014,37(3):271-275.
[收稿2016-04-26;修回2016-05-28]
(编辑:王福军)
The value of analysis on conjugated bile acids in biliary tract cancer
WangWenjuan1,ZhengDan2,LiuBin3
(1.Clinical Laboratory of Chengdu Women and Children’s Central Hospital, Chengdu Sichuan 610014,China;2.Clinical Laboratory of Guanghan People's Hospital,Guanghan Sichuan 618300,China;3.Hepatology of Guanghan People's Hospital,Guanghan Sichuan 618300,China)
Objective To explore the possibel value of change on metabolism of bile acid in diagnosis of biliary tract cancer.Methods 15 biliary tract cancer patients, 38 gallstone patients and 21 normal controls were randomly enrolled. The concentrations of nine conjugated bile acids in bile were determined by RP-HPLC-UV.Results The proportion of GCA and GCDCA were increased in biliary tract cancer group than that in biliary tract stone group (P<0.05). The proportion of TCA and TDCA were increased in biliary tract stone group than that in both biliary tract cancer and control groups (P<0.05).Conclusion Conjugated bile acids might be the potential biomarkers for the early diagnosis of biliary tract cancer.
biliary tract cancer ;bile;bile acids;chromatography
R735.8
B
1000-2715(2016)04-0403-03

