异氟醚对老年大鼠脑皮层和海马神经元凋亡的影响*
刘富兵,尹 力,徐 珊,张 超,朱昭琼
(1.遵义医学院 研究生院,贵州 遵义 563099;2.贵州省麻醉与器官保护重点实验室,贵州 遵义 563099)
基础医学研究
异氟醚对老年大鼠脑皮层和海马神经元凋亡的影响*
刘富兵1,尹力2,徐珊2,张超2,朱昭琼2
(1.遵义医学院 研究生院,贵州 遵义563099;2.贵州省麻醉与器官保护重点实验室,贵州 遵义563099)
目的 检测老年大鼠吸入异氟醚后多个时间点海马不同脑区神经元凋亡的程度,分析异氟醚的致神经元凋亡作用是否随脑区变化。方法 36只健康SD大鼠,雄性,体重300~400 g,随机分为空白对照组、氧气组、苏醒后2 h组、苏醒后1 d组、苏醒后3 d组、苏醒后7 d组,每组6只。除空白对照组和氧气组外,余各组大鼠吸入2%异氟醚30 min。利用Morris水迷宫记录分析系统检测各组大鼠不同时间点的行为改变, TUNEL技术观察海马内皮层、CA1和CA3区神经细胞凋亡水平。结果 苏醒后2 h组大鼠的学习记忆能力出现明显下降(P<0.05),而同组大鼠海马的皮层、 CA1和CA3区神经细胞凋亡水平均无明显差异。与其它组相比,氧气组大鼠海马的 CA1和CA3区细胞凋亡水平略微升高,但无统计学意义。结论 异氟醚导致的海马不同脑区神经元凋亡与其诱发的老年大鼠学习记忆能力下降无明显相关性。
异氟醚;神经元凋亡;海马;认知功能障碍;老年大鼠
临床常用吸入麻醉药异氟醚可能诱发老年人术后出现认知功能障碍。(Postoperative Cognitive Dysfunction,POCD)[1-3]。有研究显示,异氟醚可诱导海马神经元凋亡[4-6],并推测这一神经毒性作用与老年病人异氟醚麻醉后的POCD相关。然而,目前罕有研究关注异氟醚麻醉对老年期大脑各脑区神经元凋亡的敏感性差异,故本研究检测异氟醚麻醉后不同时间点老年大鼠皮层和海马各区神经元凋亡的情况,从而分析异氟醚的致神经元凋亡作用与各脑区的关系。
1 材料与方法
1.1一般资料动物为SPF级健康雄性SD大鼠,鼠龄15月,体重300~400 g。饲养于遵义医学院生物实验中心(许可证号:scxk渝2007-0005)。
1.2试剂与仪器异氟醚(山东鲁南制药集团,批号100401),TUNEL试剂盒(上海罗氏制药有限公司);DAB显色试剂盒(武汉BOSTER公司);PBS(武汉BOSTER公司)。
Morris水迷宫系统(成都泰盟科技有限公司,型号MT-200);麻醉机(上海德尔格医疗设备有限公司,Drager Julian)和气体监测仪(上海德尔格医疗设备有限公司);细胞图像分析系统(德国Leica公司,DMLB2HC);切片机(德国Leica公司,RM2230)。
1.3实验方法
1.3.1分组及给药方法空白对照组(Control,n=6):空气环境中自由活动30 min;氧气组(O2,n = 6):密封麻醉盒内吸纯氧30 min;苏醒后2 h组(T1,n=6)、苏醒后1 d组(T2,n=6)、苏醒后3 d组(T3,n=6)和苏醒后7 d组(T4,n=6)均于密封麻醉盒吸入2%异氟醚30 min。
1.3.2Morris水迷宫模型建立大鼠Morris水迷宫为一直径120 cm,高60 cm的圆形水池,将水池分为4个象限,在任一象限放入平台,平台直径15 cm,高30 cm,加水并使水面高过平台2~3 cm,放入奶粉500 g并搅匀使水面呈乳白色,以遮蔽平台,消除大鼠视觉提示。实验过程中保持安静,减少声音及光源刺激。
定位航行训练(Place Navigation Test,PNT )[7]每日10∶00训练,每天4次,共5 d。将大鼠头朝池壁从东、南、西、北4个入水点分次放入水池中,记录大鼠自入水至四肢爬上平台所需的时间以及游泳的总路程,即逃避潜伏期(s)和总路程(cm)。实验要求:大鼠爬上平台停留5 s算合格,否则当作未爬上平台处理;入水后120 s内仍未找到平台,系统采集时间记录潜伏期为120 s,人为将未找到平台的大鼠引导至平台上休息30 s后继续进行实验。游泳总路程:选择不同位置将大鼠放入水池,记录大鼠入水后至成功爬上平台期的游泳距离。评判标准:大鼠在平台停留5 s视为登陆成功;大鼠入水120 s后仍未找到平台则终止实验,该鼠逃避潜伏期记120 s。
1.3.3TUNEL法检测各脑区神经元凋亡大鼠水迷宫实验记录结束后腹腔给予7%水合氯醛麻醉,开胸后,剪开右心耳,左心室插管,灌注500 mL生理盐水+4%多聚甲醛后取脑,置于10%多聚甲醛中固定36 h。固定好的脑组织常规制作33 μm石蜡切片。石蜡切片经新鲜配制0.01 mol/L PBS冲洗、Proteinase K 50 μL (Tris·HCl pH7.8稀释) 37 ℃消化13 min、恢复室温后加入65 μl双氧水10 min、滴加50 μL TUNEL混合剂,37 ℃孵育80 min;滴加50 μL COUNTER- POD,37 ℃孵育30 min、DBA显色剂60 μL显色30 s、最后苏木素复染1 min,脱水,封片。细胞计数过程:低倍镜(10×10)下定位海马皮层、CA1和CA3区,高倍镜(40×10)下选取6个非重叠视野,每个视野下使用Image-ProplusJ软件拍摄照片并计数区域内凋亡细胞个数,以6个视野计数的平均值作为每只大鼠所选脑区的细胞凋亡水平。
2 结果
2.1Morris水迷宫定位航行总路程Morris水迷宫实验结果显示在各时间组中,只有麻醉苏醒后2 h的大鼠组的定位航行实验总路程出现了明显增多(P<0.05,见图1),提示吸入2%异氟醚30 min可使老年大鼠在短期内出现学习记忆能力下降,但会恢复。
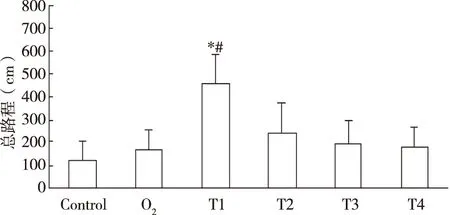
与Control组比较, *P<0.05;与O2、T3、T4组比较,#P<0.05。 图1 吸入异氟醚后不同时间点各组大鼠水迷宫定位航行实验总路程
2.2各组大鼠海马CA1、CA3及皮层区的细胞凋亡水平如图2所示,凋亡的神经元表现为体积缩小、细胞核固化并呈棕黄色,细胞膜下游染色质块聚集,某些凋亡细胞出现凋亡小体,胞质分割成块状(凋亡小体),无完整细胞骨架。
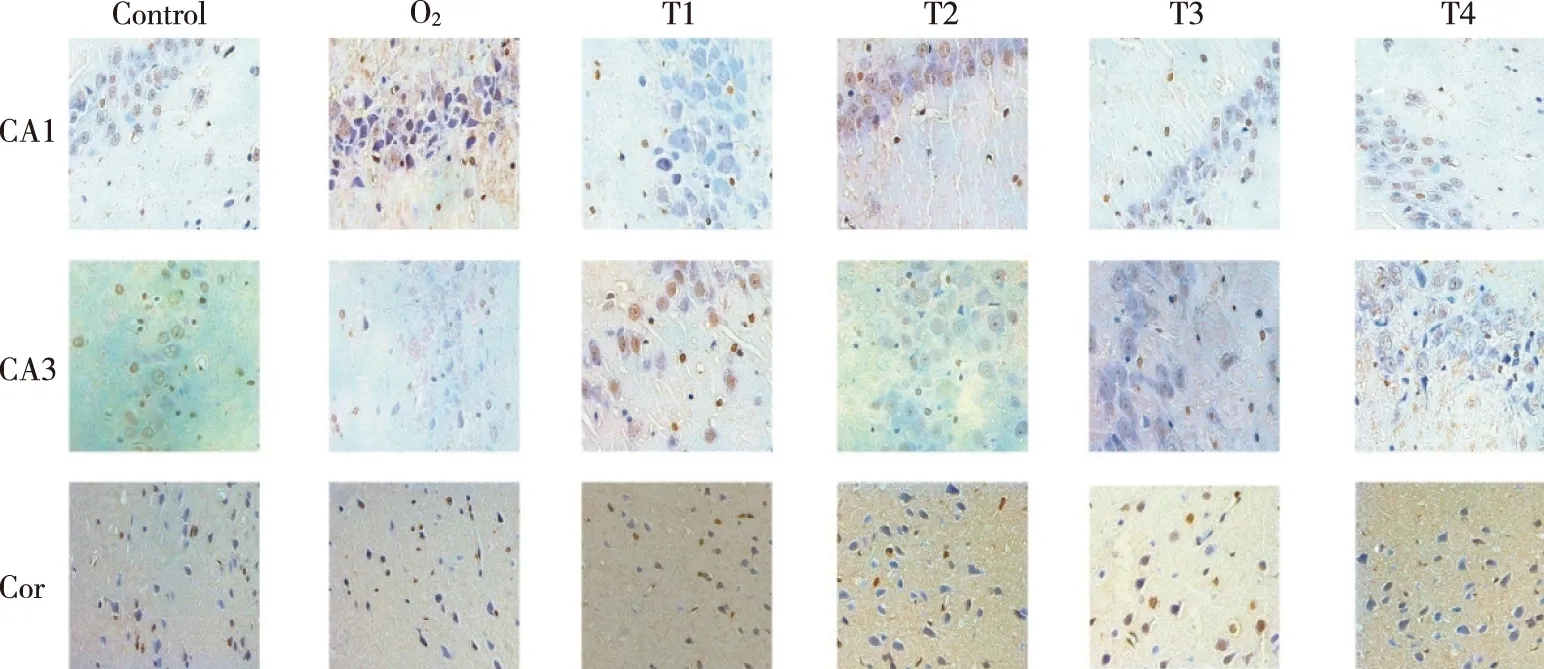
图2 吸入异氟醚后不同时间点各组大鼠海马不同脑区的神经元凋亡情况 (×400)
单因素方差分析,T1-T4组大鼠海马CA1、CA3及皮层区的神经元凋亡水平无明显差异(P>0.05),与对照组和T1-T4组相比,氧气组大鼠海马的 CA1和CA3区细胞凋亡水平升高,但无统计学意义(见表1)。
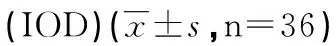

分区ControlO2T1T2T3T4CA16.92±2.937.17±2.666.58±1.515.75±2.016.33±1.926.08±2.71CA37.67±2.878.42±2.117.00±2.136.25±3.057.75±2.495.83±2.79Cor 9.42±2.718.58±2.889.08±3.157.92±3.508.08±3.427.75±3.17
3 讨论
本实验首次将老年大鼠海马和皮层两个不同脑区的神经元凋亡作为观察指标,开展探索异氟醚导致老年个体学习记忆功能下降的机制。
海马是大脑边缘系统的重要组成部分,现已证明海马主要负责学习、记忆、情绪等重要的中枢神经功能[8-9]。研究发现,损伤动物海马会导致短时记忆储存能力丧失,而不影响已经形成的记忆,即长时记忆。这说明海马主要负责记忆的获取和暂时储存[10-11]。从解剖上来看,海马可被分为CA1-4个区域,各区域间的神经元发育和纤维排列存在明显的区别。在4个区域中,CA1和CA3区是面积最大的区域,并且研究已证实这两个区域是海马内神经传导回路形成的主要区域[12]。此外,皮层区是哺乳动物的最高级神经系统,其内神经元主要是发育完善的锥形神经元,主要参与意识形成、思维整合等高级神经活动,其在学习记忆行为中主要负责编码和存储长时陈述性记忆[13]。我们的前期研究曾发现新生期大鼠重复吸入亚麻醉浓度的七氟醚会损害大鼠成年期学习记忆能力,而对短时记忆能力无影响[14]。鉴于以上原因,本实验将大鼠中枢神经系统内与学习记忆关系最为密切的两个脑区纳入研究范围,以期证明吸入异氟醚在这两个脑区引起的神经元凋亡是否与一过性学习记忆能力下降有关。
从水迷宫实验的结果来看,老年大鼠吸入2%异氟醚30 min只是在苏醒后2 h出现学习记忆功能损害,至苏醒后1 d及以后就基本恢复正常。而之后的神经元凋亡检测却显示,学习记忆能力受损的T2组大鼠脑皮层和海马CA1、CA3区域神经元凋亡情况与其他时间组大鼠相比并无明显差异。提示异氟醚在大鼠的脑皮层和海马CA1、CA3区域引起的神经元凋亡并不是老年大鼠出现一过性学习记忆能力下降的原因。
综上所述,本实验发现老年大鼠在吸入2%异氟醚30 min后2 h内会出现一过性的学习记忆能力下降。此外,吸入异氟醚诱导的大鼠脑皮层和海马CA1、CA3区域的神经元凋亡与学习记忆能力下降无明显相关。
[1] 陈莺, 赵志斌. 异氟醚与七氟醚对老年人麻醉后苏醒和认知的影响 [J]. 中国当代医药, 2010, 17(25): 75-78.
[2] Ballard C, Jones E, Gauge N, et al. Optimised anaesthesia to reduce post operative cognitive decline (POCD) in older patients undergoing elective surgery, a randomised controlled trial [J]. Plos One, 2012, 7(6): e37410.
[3] Youngblom E, DePalma G, Sands L, et al. The temporal relationship between early postoperative delirium and postoperative cognitive dysfunction in older patients: a prospective cohort study [J]. Canadian Journal of Anaesthesia, 2014, 61(12): 1084-1092.
[4] Creeley C E, Dikranian K T, Dissen G A, et al. Isoflurane-induced apoptosis of neurons and oligodendrocytes in the fetal rhesus macaque brain [J]. Anesthesiology, 2014, 120(3): 626-638.
[5] Liu H, Dai T, Guo W. Isoflurane-induced neuronal apoptosis in developing hippocampal neurons [J]. Neural Regeneration Research, 2013, 8(9): 825-832.
[6] Cheng Y, He L, Prasad V, et al. Anesthesia-lnduced neuronal apoptosis in the developing retina:a window of opportunity [J]. Anesthesia and Analgesia, 2015, 121(5): 1325-1335.
[7] Julian J, Ryan J, Hamilton R, et al. The Occipital Place Area is causally involved in representing environmental boundaries during navigation [J]. Journal of Vision, 2015, 15(12): 512.
[8] 张明辉,李菲,张玮,等.金钗石斛总生物碱对Aβ25-35所致大鼠海马组织Aβ含量的影响[J].遵义医学院学报,2016,39(1):18-21.
[9] Kelemen E, Fenton A A. Coordinating different representations in the hippocampus [J]. Neurobiology of Learning and Memory, 2016, 129: 50-59.
[10] 罗灿兰,田虹,秦伟,等.绞股蓝总苷对血管性痴呆小鼠海马组织神经元损伤及pCREB表达的影响[J].遵义医学院学报,2014,37(3):320-323.
[11] 蔡锐,李菲,董红心,等.淫羊藿苷对Tg2576小鼠学习记忆功能及海马神经细胞再生的影响[J].遵义医学院学报,2015,38(4):350-354.
[12] Ohta H, Sakai S, Ito S, et al. Paired stimulation between CA3 and CA1 alters excitability of CA3 in the rat hippocampus [J]. Neuroscience Letters, 2013, 534(3): 182-187.
[13] Javadi A H, Walsh V. Transcranial direct current stimulation (tDCS) of the left dorsolateral prefrontal cortex modulates declarative memory [J]. Brain Stimulation, 2012, 5(3): 231-241.
[14] 郑淑文, 朱昭琼, 张超, 等. 新生大鼠重复吸入亚麻醉浓度七氟醚对成年期学习记忆能力的影响 [J]. 郑州大学学报:医学版,2014, 49(5): 651-653.
[收稿2016-06-23;修回2016-07-21]
(编辑:王静)
The effects of isoflurane on neuron apoptosis of cerebral cortex and hippocampus in old rats
LiuFubing1,YinLi2,XuShang2,ZhangChao2,ZhuZhaoqiong2
(1.Graduate School of Zunyi Medical University, Zunyi Guizhou 563099, China; 2. Guizhou Key Laboratory of Anesthesia and Organ Protection, Zunyi Medical University, Zunyi Guizhou 563099 China)
Objective To observe the neuron apoptosis in the hippocampus and cerebral cortex of old rats at different time points after inhalation of isoflurane, and explore the apoptosis effect of isoflurane on different brain area.Methods Healthy old male Sprague Dawley rats (n=36) were randomly divided into control group, oxygen group, 2 hours after recovery group, 1 day after recovery group, 3 days after recovery group and 7 days after recovery group respectively. Morris water maze were used to explore the ethological effects of 30 min inhalation of isoflurane, while TUNEL were used to detect the expression of apoptosis in the hippocampus (CA1, CA3)and cerebral cortex.Results The inhalation of isoflurane inhibited the learning and memory ability of rats at 2 hours after recovery. But there is no difference on apoptosis expression in CA1, CA3 and cerebral cortex at corresponding time points. The variations of apoptosis in all groups were not regularly, the apoptosis in oxygen group is higher then other groups in area CA1, CA3, but the difference has no significance.Conclusion The neuron apoptosis in the hippocampus and cerebral cortex caused by inhalation of 2% isoflurane for 30 min has not obviously impact on the learning and memory ability of old rats.
isoflurane; neuron apoptosis; hippocampus; postoperative cognition;old rats
国家自然科学基金资助项目(NO:81360180);贵州省科技厅联合资金资助项目(NO:黔科合J字LKZ[2012]04)。
朱昭琼,女,博士,硕士生导师,研究方向:吸入麻醉,E-mail:ganzhuzhaoqiong@sina.com。
R338
A
1000-2715(2016)04-0375-03

