不同磷酸盐条件和PEG模拟干旱胁迫下桉树根际解无机磷细菌的溶磷能力1)
林凤莲 俞新玲 林勇明
(福建省高校森林生态系统经营与过程重点实验室(福建农林大学),福州,350002)
吴承祯 陈灿 李键 谢安强 范海兰
(武夷学院) (福建省高校森林生态系统经营与过程重点实验室(福建农林大学))
不同磷酸盐条件和PEG模拟干旱胁迫下桉树根际解无机磷细菌的溶磷能力1)
林凤莲 俞新玲 林勇明
(福建省高校森林生态系统经营与过程重点实验室(福建农林大学),福州,350002)
吴承祯 陈灿 李键 谢安强 范海兰
(武夷学院) (福建省高校森林生态系统经营与过程重点实验室(福建农林大学))
利用液体培养法研究模拟干旱胁迫环境(轻度胁迫、中度胁迫、重度胁迫)及不同难溶性磷酸盐对5株解无机磷细菌(P6、P7、P8、P19、P25)溶磷能力的影响。结果表明:菌株P6和P7对4种磷酸盐的溶解能力较佳,P6对磷酸铝、磷酸铁、磷酸氢钙及磷酸钙的溶磷量分别较CK(对照)显著提高143.7%、134.5%、1 318.3%、1 396.6%;P7对磷酸铁、磷酸氢钙及磷酸钙的溶磷量分别较CK显著提高348.0%、996.5%、1 810.4%。解无机磷细菌对磷酸钙的溶磷量与培养液pH值呈显著负相关(r=-0.920),与培养液有机酸质量浓度呈显著正相关(r=0.947);在3个梯度干旱胁迫下,P6、P7、P25解磷能力均显著低于CK,且随着胁迫程度的加深解磷能力呈现明显下降趋势;P8在轻度胁迫和中度胁迫下解磷能力均高于CK;P19在3个梯度干旱胁迫下解磷能力均高于CK。研究表明,5株解无机磷细菌对磷酸钙和磷酸氢钙的溶解效果较佳,对磷酸铁和磷酸铝的溶解效果较差;菌株P8、P19耐干旱能力较强,具有应用于干旱地区解磷的潜力。
桉树根;解无机磷细菌;磷源;有效磷;干旱胁迫
The experiment was conducted to study the effects of drought stress (mild stress, moderate stress, severe stress) and different insoluble phosphates on phosphate-solubilizing capacity of phosphate-solubilizing bacteria (P6, P7, P8, P19, P25) in liquid media. P6 and P7 had the higher solubilizing capacity of different insoluble phosphates, phosphate-solubilizing capacity of P6 in AlPO4, FePO4·4H2O, CaHPO4·2H2O and Ca3(PO4)2were 143.7%, 134.5%, 1318.3% and 1396.6%, significantly higher than those of CK, respectively. The phosphate-solubilizing capacity of P7 in FePO4·4H2O, CaHPO4·2H2O and Ca3(PO4)2were 348.0%, 996.5% and 1810.4%, significantly higher than those of CK, respectively. The content of available phosphorous of Ca3(PO4)2had a significantly negative correlation with pH, and had a significantly positive correlation with total content of organic acids. Under three drought stress conditions, the phosphate-solubilizing capacity of P6, P7 and P25 were significantly lower than that of CK, and tended to decline with the increasing stress intensity. The phosphate-solubilizing capacity of P8 was higher than that of CK under mild and moderate stress conditions. The phosphate-solubilizing capacity of P19 was higher than that of CK under three stress conditions. Five phosphate-solubilizing bacteria had the higher solubilizing capacity of Ca3(PO4)2and CaHPO4·2H2O than AlPO4and FePO4·4H2O. P8 and P19 had stronger drought resistant ability with the most promising bacteria for phosphate-solubilizing in arid area.
磷是土壤养分的重要组成成分,也是植物生长发育必不可少的营养元素之一。然而,中国缺磷土壤占总耕地面积的74%[1],土壤中所含磷素95%以上与Fe3+、Ca2+和Al3+等结合形成难溶性磷酸盐[2],主要包括钙、铝和铁磷酸盐,能被植物吸收利用的有效磷质量浓度很低。为满足植物生长过程中磷的需求量,在农林业中主要通过施用大量磷肥来增加土壤磷质量浓度,但磷肥容易被吸附和沉淀,滥施磷肥不仅浪费资源,还会破坏土壤结构和质量、污染环境等[3-4]。解磷菌(PSMs)可将土壤中难溶性化合态磷转化为植物可吸收利用的可溶性磷,其中能够转化难溶性无机磷酸盐的微生物,称之为解无机磷菌[5]。解磷微生物因其解磷效果好,且具有成本低、无环境污染、有效改良土壤质量和养分循环等优点[6-7],成为学界的研究热点,研究内容主要包括溶磷菌对磷源物质的选择性[8-11]、解磷菌的溶磷机制与pH值、有机酸质量浓度变化规律的关系等[10,12],但很少开展环境胁迫适应性强的溶磷菌筛选工作。
解磷微生物溶解难溶性磷酸盐的能力主要取决于菌株自身的遗传特性,同时也与培养条件有关,大多数解磷微生物只有在适宜的湿度、温度、光照、酸碱度等条件下,才能发挥其解磷作用,进而提高土壤有效磷质量浓度[13]。然而,自然界中逆境常见,筛选出对逆境耐受性较强的解磷微生物是保障环境胁迫严重区域作物正常磷素供应的举措之一。目前,已有学者对耐高温、耐盐碱的解磷微生物进行筛选和驯化,李鸣晓等[14]、杨天学等[15]筛选出具有解无机磷功能的耐高温菌株,张巍等[16]从盐碱地中分离、筛选出2株具有较强解磷能力的耐盐碱解磷菌C111和C141,但对干旱胁迫适应性强的溶磷菌筛选工作罕见报道。
随着全球气候变化,中国干旱灾害事件的发生频率和持续时间呈现不断增加的趋势,干旱面积也不断增加[17]。此外,桉树(Eucalyptus)等树种对土壤水分需求量大,连栽易造成土壤严重缺水,影响大多数解磷微生物解磷功效的发挥,从而严重制约植物自身的生长发育。鉴于此,筛选出适应于干旱胁迫且对特定磷源具强大溶解能力的解磷菌,进而制成菌剂施用于桉树林地,能显著提高林地磷肥自供应效率,有效解决桉树连栽林缺水和磷肥利用率低的问题。因此,本研究拟通过液体培养法研究聚乙二醇6000[18]模拟干旱胁迫环境及不同难溶性磷酸盐对分别从柳桉(Eucalyptussaligna)、巨桉(Eucalyptusgrandis)、邓恩桉(Eucalyptusdunnii)根际土壤中提取的5株根际解无机磷细菌溶磷能力的影响,以期筛选出干旱条件下具特定溶磷功能的解磷菌,并进一步探讨菌株溶磷量与pH值、有机酸质量浓度之间的关系,从而丰富解磷微生物对难溶性磷酸盐的溶解能力和机制研究,对优化森林施肥措施、改善桉树人工林土壤养分循环、提高干旱地区桉树对难溶性磷酸盐的利用率、促进桉树生长发育以及在干旱地区推广种植桉树等具有重要意义。
1 材料与方法
供试菌株:本试验所用菌种为福建省高校森林生态系统经营与过程重点实验室(福建农林大学)从柳桉(Eucalyptussaligna)、巨桉(Eucalyptusgrandis)、邓恩桉(Eucalyptusdunnii)根际土壤中提取、并通过定性和定量分析筛选获得的解磷效果较好的5株解无机磷细菌(经16SrDNA序列测定)P6、P7、P8、P19与P25[19],其中,P6、P7是从柳桉根际土壤中提取的,P8、P19是从巨桉根际土壤中提取的,P25是从邓恩桉根际土壤中提取的。
供试培养基:牛肉膏蛋白胨培养基[20],即牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH值7.2~7.4,用于菌株保存、活化;无机磷液体培养基[20],参照蒙金娜基础培养基,但不加琼脂和含磷化合物,即葡萄糖10.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,酵母提取物0.5 g,蒸馏水1 000 mL,pH值7.0~7.5。
解无机磷细菌对不同磷酸盐的解磷能力测定:向培养基中分别添加磷酸铝(AlPO4)7.875 g、磷酸铁(FePO4·4H2O)14.389 g、磷酸氢钙(CaHPO4·2H2O)11.113 g、磷酸钙(Ca3(PO4)2)10.000 g(不同磷源添加量按每升液体培养基中加入相同质量浓度的磷(2 g)折算),取30 mL装于150 mL三角瓶,121 ℃灭菌20 min,冷却后加入1 mL 109菌落·mL-1菌液,每株菌设3个重复,同时以加入1 mL无菌水的培养基作为空白对照,置于28 ℃,160 r·min-1条件下摇瓶培养5 d。培养结束后,菌株培养液离心20 min(4 ℃,10 000 r·min-1),取上清液用钼锑抗比色法[21]测定有效磷质量浓度。
培养液有机酸质量浓度测定:将上述所得培养液(以磷酸钙为唯一磷源)稀释10倍,吸取10 mL于100 mL三角瓶,加入2滴酚酞指示剂,用标定好的氢氧化钠滴定液(浓度为0.081 967 mol·L-1)滴定。根据所用氢氧化钠滴定液的体积计算培养液中的总酸质量浓度,总酸质量浓度以草酸计。每1 mL氢氧化钠滴定液相当于3.688 525 mg草酸。同时用pH值计测定培养液的pH值。
干旱胁迫对解无机磷细菌解磷效果的影响:参考薛立等[18]的试验步骤,向培养基中加入聚乙二醇6000(Polyethyleneglycol或PEG)配制成3个梯度的质量分数,即轻度胁迫10%(100 g·L-1PEG)、中度胁迫20%(200 g·L-1PEG)和重度胁迫30%(300 g·L-1PEG),往培养基中加入Ca3(PO4)210 g,取30 mL装于150 mL三角瓶,121 ℃灭菌20 min,冷却后加入1 mL 109菌落·mL-1菌液,每株菌设3个重复,并以不加入聚乙二醇6000的培养基作为空白对照,置于28 ℃,160 r·min-1条件下摇瓶培养5 d。培养结束后,菌株培养液离心20 min(4 ℃,10 000 r·min-1),取上清液用钼锑抗比色法[21]测定有效磷质量浓度。
数据处理:采用EXCEL2013和SPSS19.0软件进行数据处理、分析和图形绘制。使用单因素方差分析法(One-Way ANOVA)进行方差分析,并采用最小显著差异法(LSD法)进行显著性检验和多重比较,差异水平为0.05。菌株溶磷能力与pH值、有机酸质量浓度之间的相关性采用Pearson相关分析。
2 结果与分析
2.1 解无机磷细菌对不同难溶性磷酸盐的溶解能力
不同菌株对磷酸铝的溶解效果差异较大(表1),各处理溶磷能力由大到小表现为P6、P8、P25、P19、CK、P7,P6、P8处理下有效磷质量浓度分别为16.499、12.779 mg·L-1,分别较CK提高143.7%、88.8%,表明P6、P8对磷酸铝有较强的溶解能力,这两株菌在以磷酸铝为主的土壤中施用效果可能更佳。与对照相比,P6、P8显著优于CK,P19、P25与CK间没有显著差异,P7略低于CK。
解无机磷细菌对磷酸铁的溶解能力较差(表1),不同菌株溶磷能力由大到小表现为P7、P6、P19、CK、P8、P25,P7、P6处理下有效磷质量浓度分别为68.152、35.672 mg·L-1,分别较CK提高348.0%、134.5%,表明P7、P6对磷酸铁有较强的溶解能力,磷酸铁是菌株P7的优势磷源。与对照相比,P7、P6、P19显著优于CK,P8与CK间没有显著差异,P8略低于CK。
不同菌株均表现出显著溶解磷酸氢钙的能力(表1),不同菌株溶磷能力由大到小表现为P6、P7、P19、P25、P8、CK,各菌株处理下有效磷质量浓度均显著高于空白对照CK。P6、P7、P19处理下有效磷质量浓度分别为410.550、317.403、281.489 mg·L-1,分别较CK提高1318.3%、996.5%、872.4%,表明各个菌株处理对磷酸氢钙都有很强的溶解能力,磷酸氢钙是菌株P6的优势磷源。
不同菌株均表现出显著溶解磷酸钙的能力(表1),不同菌株溶磷能力由大到小表现为P7、P6、P25、P8、P19、CK,各菌株处理下有效磷质量浓度均显著高于空白对照CK。P7、P6、P25处理下有效磷质量浓度分别为471.074、369.056、263.297 mg·L-1,分别较CK提高1 810.4%、1 396.6%、967.8%,表明各个菌株处理对磷酸氢钙都有很强的溶解能力,磷酸氢钙是菌株P7的优势磷源。
综合比较而言,P6、P7对4种常见难溶性磷酸盐有较显著的溶解能力。菌株对磷酸钙的溶解效果最佳,所以选择磷酸钙作为研究解无机磷细菌溶磷能力与培养液pH值、有机酸质量浓度相关关系及干旱胁迫对菌株解磷能力影响的唯一磷源。
注:表中数值为平均值±标准差;同列中不同的小写字母表示不同处理间在0.05水平下差异显著。
2.2 解无机磷细菌培养液pH值和有机酸质量浓度
以磷酸钙为磷源,与供试的解无机磷细菌培养5 d后,其各菌株培养液pH值为4.65~5.61,均比空白对照CK(pH值=6.78)显著降低(p<0.05),P7、P6、P25、P19、P8分别较CK下降2.20、2.13、1.69、1.52、1.17个单位,其中P6与P7、P19与P25间没有显著差异,其他处理间差异显著(p<0.05)。对各处理的有效磷质量浓度和pH值进行相关性分析,结果表明,各处理的有效磷质量浓度(y)和pH值(x)间存在显著负相关(R2=0.847 2,p=0.027),相关系数r=-0.920(图1)。
供试的解无机磷细菌培养5 d后,各菌株培养液有机酸质量浓度为5.986~18.807 mg·L-1,各处理间差异显著(p<0.05)。其中,P7分泌的有机酸质量浓度最大(达18.807 mg·L-1),这与P7对磷酸钙溶解效果最佳相对应。相关分析表明,各处理的有效磷质量浓度(y)与有机酸质量浓度(x)间存在显著正相关(R2=0.896 7,p=0.015),相关系数r=0.947(图2)。但各处理的有机酸质量浓度(y)和pH值(x)间不存在显著相关性(相关系数r=-0.757,p=0.139)。
2.3 干旱胁迫对解无机磷细菌解磷能力的影响
不同菌株在轻度干旱胁迫(10%,100 g·L-1PEG)条件下解磷能力差异显著,各处理溶磷能力由大到小表现为P7、P8、P19、P25、P6(表2),且各处理间差异显著(p<0.05)。与对照相比,P6、P7、P25处理下有效磷质量浓度显著低于CK,P8、P19溶磷能力较CK显著提高,说明P8、P19对轻度干旱的耐受力较强。
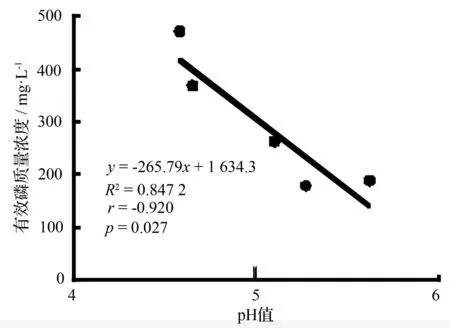
图1 解无机磷细菌的溶磷量与pH值的关系
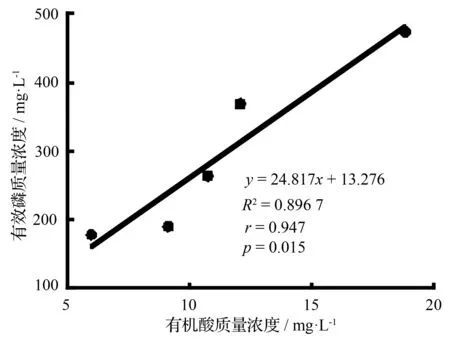
图2 解无机磷细菌的溶磷量与有机酸质量浓度的关系
不同菌株在中度干旱胁迫(20%,200 g·L-1PEG)条件下解磷能力差异较大,各处理溶磷能力由大到小表现为P7、P19、P25、P8、P6,P8与P25间差异不显著,其他处理间差异显著(p<0.05)(表2)。P6、P7、P25处理下有效磷质量浓度较CK显著下降,P19溶磷能力较CK显著提高。除P19溶磷能力较轻度胁迫略有上升外,其他菌处理较轻度胁迫均呈现下降趋势,其中P8下降幅度最大,下降25.2%,说明这株菌在中度胁迫下解磷能力明显下降。
不同菌株在重度干旱胁迫(30%,300 g·L-1PEG)条件下解磷能力差异较大,各处理溶磷能力由大到小表现为P8、P19、P25、P6、P7,P8与P19间差异不显著,其他处理间差异显著(p<0.05)(表2)。P7、P6、P25处理下有效磷质量浓度较CK显著下降,P19溶磷能力较CK略有上升。重度干旱胁迫下各处理有效磷质量浓度较中度胁迫均呈现下降趋势,其中P7下降幅度最大,下降73.7%,说明这株菌在重度胁迫下解磷能力明显下降。
总而言之,在3个梯度胁迫下,P6、P7、P25的解磷能力均显著低于CK,且随着胁迫程度的加深有效磷质量浓度呈现明显下降趋势,P7下降最为明显,P6次之。P8在轻度胁迫下有效磷质量浓度显著高于CK,在中度干旱胁迫下稍高于CK,而P19在3个梯度胁迫下有效磷质量浓度均高于CK。
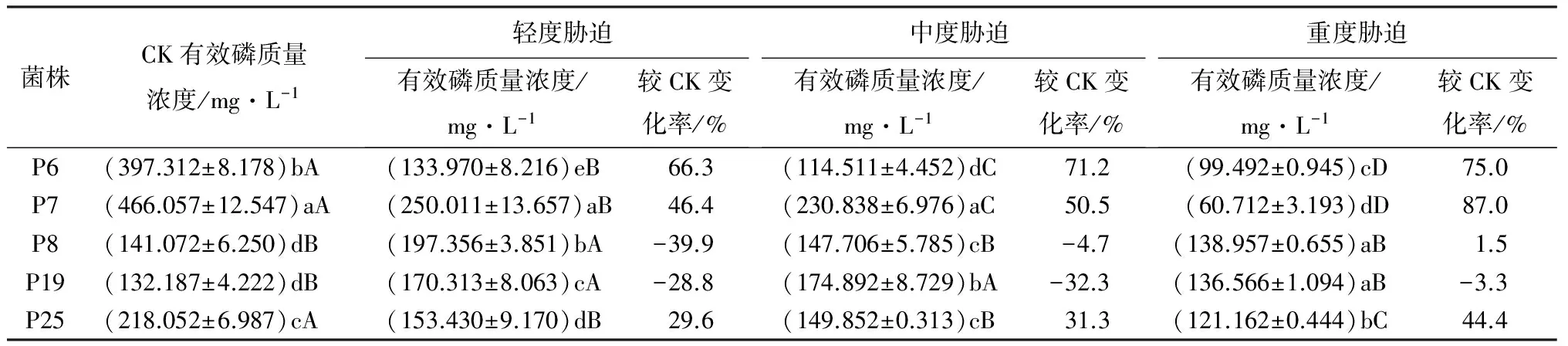
表2 干旱胁迫条件下解无机磷菌溶磷能力的比较
注:表中数值为平均值±标准差;同列中不同小写字母表示同一干旱胁迫条件不同处理间在0.05水平下差异显著;同行中不同大写字母表示同一菌株不同干旱胁迫处理间在0.05水平下差异显著。
3 结论与讨论
前人研究表明,解磷菌对磷源物质的种类有一定选择性,不同解磷菌对不同磷源的溶解能力差异较大,且同一菌株对不同磷源的溶解能力也存在差异[8-12]。Whitelaw et al.[8]、张毅民等[9]、赵小蓉等[10]、Banik et al.[22]研究发现解磷微生物对钙磷酸盐的溶解效果最佳,磷酸铝次之,磷酸铁效果最差,与本文研究结果相似。不同解磷菌对不同难溶性磷酸盐的溶解效果差异较大,体现菌株对磷源的选择性,这主要是受菌株自身遗传特性的影响,同时也与菌株复杂的溶磷机制、磷酸盐复杂的化学成分和结构等因素有关[23-24],一方面是由于大多数溶磷菌溶解难溶性磷酸盐主要通过分泌质子和有机酸络合作用,钙磷酸盐在质子和有机酸络合双重作用下较易溶解,而磷酸铝和磷酸铁只通过络合和螯合作用,故较难溶解[10]。二是菌株分泌的有机酸种类和质量浓度不同,不同种类有机酸对不同金属离子的螯合程度不一致,可能这5株解无机磷菌分泌的有机酸较易螯合Ca2+,从而促进钙磷酸盐的溶解。三是磷酸铝、磷酸铁溶解时,铁和铝进入酸溶液造成溶液黏度增大,影响培养液水分和养分流动,可能会抑制菌株的生长繁殖,从而影响其解磷能力。乔欢等[25]研究发现,嗜松青霉JP-NJ4对不同磷酸盐的解磷能力由大到小的顺序为磷酸铝、磷酸氢钙、磷酸铁,与本研究结果存在差异,这可能是因为乔欢等的供试菌种嗜松青霉JP-NJ4是真菌,而本试验的5株解无机磷菌均为细菌,真菌的溶解机制和溶磷能力与细菌存在较大差异,对不同磷酸盐的溶解效果也不一致。
解磷微生物溶解磷酸盐过程中,也会固持一部分分解出来的磷供其自身生长繁殖,当细胞基质组成发生变化或细胞死亡时,被固持的磷又被释放出来[3]。陈阳等[26]研究发现,解磷芽孢杆菌可将培养液中吸收的磷贮存于细胞内。Turner et al.[27]研究也证实解磷微生物具有固持作用,当其细胞裂解后所释放的磷是有效磷的重要来源。有机磷和无机磷之间的转化是一个动态平衡过程,有效磷质量浓度关键取决于有机磷的矿化作用和微生物的固持作用这两个同时进行、方向相反过程的相对速率,当培养液中可降解磷质量浓度达到一定程度时,固持速率大于矿化速率,反之,矿化速率大于固持速率[2]。本试验中部分菌株对磷酸铁的溶磷量低于CK,可能是解磷菌对磷的固持作用大于磷的矿化作用,导致培养液中有效磷质量浓度较低。

干旱胁迫是田间条件下存在最广泛的一种逆境,会影响微生物生长繁殖和功能发挥。叶德练等[33]、Hueso et al.[34]研究发现,干旱胁迫会影响微生物呼吸、微生物量和微生物活性。本试验结果表明,除P8、P19外,大部分菌株溶磷量均随着干旱胁迫程度加深呈显著下降趋势,这与周鑫斌等[35]的研究结果相似。这主要是因为干旱胁迫通过调节微生物的细胞代谢和渗透势,进而影响微生物的生长繁殖、结构和生理功能[36],胁迫程度越深,解磷微生物数量下降越明显,解磷功能抑制越严重,从而导致溶磷量呈显著下降趋势。此外,水分降低不仅会使得培养液黏度增大,影响有机碳、氮等养分元素的周转与转化,进而影响解磷微生物生长繁殖和新陈代谢,降低其解磷能力,还使得难溶性磷酸盐更易于沉积和凝聚,不利于磷酸盐流动和溶解,从而降低解磷效率。P8在轻度胁迫下有效磷质量浓度显著高于CK,P19在轻度、中度胁迫下有效磷质量浓度均显著高于CK,说明P8、P19对干旱的耐受能力较强,这可能是菌株因其自身生长特性对水分的需求量不一致,适宜菌株发挥解磷功能的水分条件也不同。P8、P19在干旱胁迫条件下解磷效果优于其他菌株,在干旱胁迫较严重的地区选用P8、P19,可更好地发挥菌株解磷潜力,提高干旱地区桉树对难溶性磷的吸收率,促进桉树生长发育。此外,可进一步研究P8、P19是否适用于干旱地区的其他作物。
综合以上分析,本研究发现磷酸铝是菌株P6的优势磷源,磷酸铁是菌株P7的优势磷源,P6和P7配制成解磷菌剂施用于酸性红壤,可更好地溶解土壤中难溶性磷酸盐,促进我国南方红壤农林地可持续经营与发展。P8、P19对干旱的耐受能力较强,具有应用于干旱地区解磷的潜力。本试验仅初步探讨溶磷量与pH值、有机酸质量浓度的相关关系,为阐明解磷微生物对不同难溶性磷酸盐的溶解机理,应针对有机酸种类鉴定与解磷能力关系开展进一步研究。
[1] 赵小蓉,林启美.微生物解磷的研究进展[J].土壤肥料,2001,(3):7-11.
[2] 盛荣,肖和艾,谭周进,等.土壤解磷微生物及其磷素有效性转化机理研究进展[J].土壤通报,2010,41(6):1505-1510.
[3] AHEMAD M, KIBRET M. Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective[J]. Journal of King Saud University-Science,2014,26(1):1-20.
[4] 郝晶,洪坚平,刘冰,等.石灰性土壤中高效解磷细菌菌株的分离,筛选及组合[J].应用与环境生物学报,2006,12(3):404-408.
[5] 王光华,赵英,周德瑞,等.解磷菌的研究现状与展望[J].生态环境学报,2003,12(1):96-101.
[6] NEFF J C, TOWNSEND A R, GLEIXNER G, et al. Variable effects of nitrogen additions on the stability and turnover of soil carbon[J]. Nature,2002,419:915-917.
[7] 谢安强,洪伟,吴承祯.内生真菌对尾巨桉幼苗磷元素吸收的影响[J].浙江农林大学学报,2013,30(6):863-870.
[8] WHITELAW M A, HARDEN T J, HELYAR K R. Phosphate solubilisationin solution culture by the soil fungusPenicilliumradicum[J]. Soil Biology and Biochemistry,1999,31(5):655-665.
[9] 张毅民,孙亚凯,吕学斌,等.高效溶磷菌株Bmp5筛选及活力和培养条件的研究[J].华南农业大学学报,2006,27(3):61-65.
[10] 赵小蓉,林启美,李保国.溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J].微生物学报,2002,42(2):236-241.
[11] 黄伟.红壤中溶磷菌的筛选及溶磷特性的研究[D].南京:南京农业大学,2006.
[12] 刘辉,吴小芹,陈丹.4种外生菌根真菌对难溶性磷酸盐的溶解能力[J].西北植物学报,2010,30(1):143-149.
[13] 赵小蓉,林启美,李保国.C、N源及C/N比对微生物溶磷的影响[J].植物营养与肥料学报,2002,8(2):197-204.
[14] 李鸣晓,席北斗,魏自民,等.耐高温解磷菌的筛选及解磷能力研究[J].环境科学研究,2008,21(3):165-169.
[15] 杨天学,唐忠涛,席北斗,等.耐高温解无机磷菌的筛选及初步鉴定[J].农业环境科学学报,2009,28(2):393-397.
[16] 张巍,冯玉杰,胡纯国,等.耐盐碱解磷菌的分离鉴定及解磷能力研究[J].土壤通报,2009,40(3):572-575.
[17] 邹旭恺,任国玉,张强.基于综合气象干旱指数的中国干旱变化趋势研究[J].气候与环境研究,2010,15(4):371-378.
[18] 薛立,薛晔,任向荣,等.PEG模拟干旱条件下尾叶桉和枫香苗木的生理响应[J].生态环境学报,2009,18(2):614-620.
[19] 俞新玲.桉树土壤高效解磷菌的筛选及其对桉树生长的影响[D].福州:福建农林大学,2011.
[20] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:96-105.
[21] 赵小蓉,林启美,李保国,等.微生物溶解磷矿粉能力与pH值及分泌有机酸的关系[J].微生物学杂志,2003,23(3):5-7.
[22] BANIK S, DEY B K. Available phosphate content of an alluvial soil as influenced by inoculation of some isolated phosphate-solubilizing microorganisms[J]. Plant and Soil,1982,69(3):353-364.
[23] ILLMER P, SCHINNER F. Solubilization of inorganic calcium phosphates-solubilization mechanisms[J]. Soil Biology and Biochemistry,1995,27(3):257-263.
[24] 钟传青,黄为一.不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J].土壤学报,2005,42(2):286-294.
[25] 乔欢,吴小芹,王早.一株嗜松青霉JP-NJ4的解磷特性[J].微生物学通报,2014,41(9):1741-1748.
[26] 陈阳,朱天辉,朴春根,等.解磷芽孢杆菌的筛选及其解磷能力的测定[J].贵州林业科技,2008,36(2):17-24.
[27] TURNER B L, DRIESSEN J P, HAYGARTH P M, et al. Potentialcontribution of lysed bacterial cells to phosphorus solubilisation in two rewetted Australian pasture soils[J]. Soil Biology and Biochemistry,2003,35(1):187-189.
[28] 林启美,王华,赵小蓉,等.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001,28(2):26-30.
[29] ASEA P, KUCEY R, STEWART J. Inorganic phosphate solubilization by twoPenicilliumspeciesin solution culture and soil[J]. Soil Biology and Biochemistry,1988,20(4):459-464.
[30] Yi Y M, HUANG W Y, Ge Y. Exopolysaccharide: A novel importantfactor in the microbial dissolution of tricalcium phosphate[J]. World Journal of Microbiology and Biotechnology,2008,24(7):1059-1065.
[31] 乔志伟,洪坚平,谢英荷,等.石灰性土壤拉恩式溶磷细菌的筛选鉴定及溶磷特性[J].应用生态学报,2013,24(8):2294-2300.
[32] 赵飞龙,徐亚军,曹东建,等.溶磷性大豆根瘤内生菌的筛选、抗性及系统发育和促生[J].生态学报,2015,35(13):4426-4435.
[33] 叶德练,齐瑞娟,管大海,等.免耕冬小麦田土壤微生物特征和土壤酶活性对水分调控的响应[J].作物学报,2015,41(8):1212-1219.
[35] 周鑫斌,谢英荷,洪坚平,等.不同水分条件下磷细菌肥施用效果的研究[J].山西农业大学学报(自然科学版),2003,23(4):331-334.
[36] YANCEY P H, CLARK M E, HAND S C, et al. Living with water stress: evolution of osmolyte systems[J]. Science,1982,217:1214-1222.
Phosphate-solubilizing Capacity of Phosphate-solubilizing Bacteria inEucalyptusRhizosphere under Drought Stress Simulated by PEG and Different Insoluble Phosphates Conditions//
Lin Fenglian, Yu Xinling, Lin Yongming
(Key Laboratory for Forest Ecosystem Process and Management of Fujian Province, Fujian Agriculture and Forestry University, Fuzhou 350002, P. R. China); Wu Chengzhen(Wuyi University); Chen Can, Li Jian, Xie Anqiang, Fan Hailan(Key Laboratory for Forest Ecosystem Process and Management of Fujian Province, Fujian Agriculture and Forestry University)//Journal of Northeast Forestry University,2016,44(9):93-98.
Eucalyptusrhizosphere; Phosphate-solubilizing bacteria; Phosphorus source; Available phosphorous; Drought stress
林凤莲,女,1991年4月生,福建省高校森林生态系统经营与过程重点实验室(福建农林大学),硕士研究生。E-mail:352570138@qq.com。
吴承祯,武夷学院生态与资源工程学院、福建省高校森林生态系统经营与过程重点实验室(福建农林大学),教授。E-mail:fjwcz@126.com。
2016年3月28日。
S718.83;Q945.78
1)教育部博士点学科专项基金(20123515110011)、福建省科技重大专项(2012NZ01)。
责任编辑:任 俐。

