利用合成多肽制备兔多克隆抗体
谭凤彪,高家林,陆晓华,章 尧
(1.皖南医学院 生物化学教研室,安徽 芜湖 241002;2.皖南医学院 活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002;3.皖南医学院 机能学实验中心,安徽 芜湖 241002;4.皖南医学院第一附属医院 弋矶山医院 内分泌科,安徽 芜湖 241001)
·基础医学·
利用合成多肽制备兔多克隆抗体
谭凤彪1,2,高家林2,4,陆晓华3,章尧1,2
(1.皖南医学院生物化学教研室,安徽芜湖241002;2.皖南医学院活性生物大分子研究安徽省重点实验室,安徽芜湖241002;3.皖南医学院机能学实验中心,安徽芜湖241002;4.皖南医学院第一附属医院 弋矶山医院内分泌科,安徽芜湖241001)
目的:利用人工合成多肽制备载脂蛋白M(appliprotein M,ApoM)兔多克隆抗体。方法:分析并选取一段特异性的ApoM氨基酸序列用于合成多肽,并耦联钥孔血蓝蛋白(KLH),用来免疫雄性的新西兰大白兔,经过多次加强免疫后用收集的兔抗血清制备多克隆抗体,并进行Western Blot检测。结果:利用人工合成并纯化的多肽,经多次免疫后获得所需的多克隆抗体。结论:成功制备了兔ApoM多克隆抗体,为后续的实验研究ApoM的功能提供实验基础。
载脂蛋白M;多肽;多克隆抗体
载脂蛋白M (apolipoprotein M,ApoM)是由徐宁等[1]人在研究富含甘油三酯脂蛋白(triglyceride-rich lipoprotein,TGRLP)时发现的一种不同于以往的脂蛋白转运蛋白类蛋白,优势表达于HDL中,少量表达于TGRLP 及LDL 中。人类ApoM基因定位于6号染色体短臂(6p21.3),邻接MHCⅢ区域,含有6个外显子和5个内含子,系单拷贝基因。人类ApoM cDNA (734 bp) 编码一种含188 个氨基酸残基的蛋白质,相对分子量约26 kU,结构与Lipocalin 家族相关联。多组织表达列阵研究显示[2],ApoM表达具有高度的组织特异性,人ApoM特异表达于肝脏和肾脏,在胚胎、胚肾、胃、骨骼肌细胞、小肠、心脏、大脑、脾脏和睾丸中也有低表达,在肌肉组织、十二指肠和卵巢中无表达,具有较高的组织特异性,这提示ApoM的生理功能可能与肝脏和肾脏的功能密切相关[3]。ApoM在HDL中含5%,是HDL的主要成分之一,成人血浆ApoM含量约为0.63~1.13 mmol/L。ApoM主要与HDL相互作用,促进HDL颗粒的成熟并调节其代谢[1]。目前的研究发现ApoM具有抗动脉粥样硬化作用,与冠心病和糖尿病的发生密切相关,已成为研究的热点[4-6]。细胞核因子-1α(HNF-1α)可提高ApoM的表达水平,对心血管具有保护作用,是通过促进胆固醇代谢关键酶的表达并抑制胆固醇代谢相关抑制因子的生成进而促进胆固醇的转化来实现的。新的研究发现,ApoM通过对血管内皮细胞的1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)受体提供S1P充当HDL的血管保护成分[7-8]。在研究蛋白质的功能和诊断检测方面,抗体是一种重要的研究工具。为进一步探明ApoM的功能,我们设计并合成人工多肽,通过免疫新西兰大白兔,制备ApoM兔多克隆抗体,为后续研究奠定基础。
1 材料与方法
1.1材料抗原多肽由上海生工全自动合成仪合成,完全福氏佐剂(complete Freund′s adjuvant,CFA)、不完全福氏佐剂(incomplete Freund′s adjuvant,IFA),丙烯酰胺,购自Sigma公司;放射免疫沉淀技术(radioimmunopreciptation assay,RIPA)裂解液、二辛可宁酸(bicinchonininc acid,BCA)蛋白浓度测定试剂盒、loading buffer,辣根过氧化物酶(HRP)标记的羊抗兔IgG(H+L)和羊抗鼠IgG(H+L)抗体均购自碧云天公司,ApoM单克隆抗体购自CST(Cell Signaling Technology)公司,Ladder(10-170 kU)购自Pierce 公司,聚偏二氟乙烯(polycinylidene fluoride,PVDF)膜购自Bio-RAD公司,化学发光试剂盒购自赛默飞公司,其他试剂均为国产分析纯。雄性健康8周龄新西兰大白兔2只(每只2.5 kg左右)购自南京大学-模式动物研究所,动物实验得到皖南医学院弋矶山医院动物伦理委员会的批准。
1.2方法
1.2.1ApoM特征性抗原肽段的合成根据ApoM基因编码的氨基酸序列,利用在线蛋白分析软件对ApoM蛋白信号肽、亲水性和抗原性进行分析,确定抗原肽段氨基酸序列,由上海生工合成并偶联KLH,合成后的总量为10 mg,置于4℃保存备用。
1.2.2合成多肽的溶解和分装多肽的溶解性很大程度上取决于多肽的极性。酸性蛋白溶解于碱性溶液,而碱性蛋白可溶解于酸性溶液,含有大量不带电荷的极性氨基酸残基或疏水性氨基酸的疏水性多肽和中性多肽可采用少量有机溶剂如二甲基亚砜(DMSO)溶解,然后再用PBS稀释。但是含有甲硫氨酸或半胱氨酸的多肽不能用DMSO溶解,因为DMSO可能造成侧链氧化。耦联了KLH的人工合成多肽颗粒,在溶解前先加入DMSO到多肽粉末中,方法是1 mg多肽溶于200~300 μL的DMSO,然后加PBS补足至1 mL,这样所得多肽溶液的浓度是1 mg/mL,便于后续实验取用。超声处理有助于打碎颗粒并增加溶解度,但应注意降温,避免超声处理引起溶液发热和多肽降解。溶解后的多肽分装到冻存管中置于-20℃冰箱保存备用,避免反复冻融。
1.2.3抗原与佐剂的乳化取溶解后的多肽抗原1mL,加入等体积的佐剂,用2.5 mL注射器抽取液体后,注射器留存少量空气,通过三通头连接另一注射器,然后相互推动注射器的活塞,使抗原与佐剂相互混合[9]。当抗原和佐剂充分乳化后,滴一滴乳化后的液体在水面上,如果液体呈球形而不扩散,表示抗原与佐剂乳化完全。
1.2.4免疫兔子制备新西兰大白兔(分别标记兔1、兔2)实验前常规饲养1周,采用背部脊柱旁多点皮下注射的方法免疫。首次免疫采用CFA乳化抗原,兔1和兔2分别注射抗原乳化液800 μL(400 μg)和400 μL(200 μg)作为基础免疫,分4~8点作皮丘注射。首次免疫前先于注射点备皮并用75%的乙醇消毒,预防感染。注射前排净注射器内空气后捏起兔子皮肤,按针头与皮肤呈15°角进针,进针深度以1~2 cm为宜,不宜刺入肌肉。首次免疫后每2周加强免疫1次,加强免疫采用IFA乳化抗原,相较于首次免疫,加强免疫剂量减半。第3次免疫后通过耳缘静脉采血1 mL,获得抗ApoM血清,做Western Blot检测。如果检测到抗体后,于再次免疫1周后取血。
1.2.5免疫前后采血准备两个5号医用输液针,从针头后约2 cm处剪断皮管备用。在助手协作下固定兔子,用手指轻弹其耳根部使血管充盈,采用乙醇消毒后,将输液针头插入耳部血管中,血液顺着针管一滴滴流出,用离心管收集所需量血液后退出针头,并用干棉球按压止血。该方法操作简单,每次取血量不超过8 mL,饲养一段时间后可反复取血。先将离心管置于37℃的恒温箱中30 min,然后置于4℃冰箱中过夜,使其自然凝固,析出血清。以4000 r/min,4℃离心10 min,收集上清后分装置于-80℃冰箱保存备用。
1.2.6 Western bIot检测抗体①组织蛋白的处理。分别取野生型、杂合型和剔除型ApoM模型小鼠的肝脏组织,严格按RIPA试剂盒说明书操作法提取肝组织蛋白,采用BCA蛋白浓度测定试剂盒测定提取蛋白浓度后,取适量蛋白样品与上样缓冲液按4∶1混匀,100℃金属浴10 min后冷却至室温备用,其余样品置于-80℃备用。②配制SDS-PAGE胶。按照制胶方案制备15%的分离胶和5%的浓缩胶。③采用SDS-PAGE方法检测血清中ApoM的抗体。具体操作方法为每孔点样金属浴后的蛋白30 μg后电泳,100V恒压转膜70 min,标记蛋白面后将PVDF膜置于5%的脱脂奶粉中封闭1 h,以1∶500稀释的兔抗血清作为一抗,用商业化的ApoM单克隆抗体作为对照,4℃孵育过夜。以1∶10 000稀释的HRP标记的羊抗兔IgG或羊抗鼠IgG抗体作为二抗孵育1 h后洗膜,滴加发光液在多功能成像仪中检测Western blot结果并分析。
2 结果
2.1ApoM多肽氨基酸序列分析利用在线蛋白分析软件对ApoM蛋白氨基酸序列进行分析,并结合市场上利用多肽制备的成熟抗体所选择的氨基酸序列,避免选择蛋白内部重复或接近重复段的序列以及同源性太强的肽段作为抗原,以提高获得抗体的特异性。经过对ApoM蛋白信号肽、亲水性和抗原性分析,最终选择ApoM蛋白氨基酸序的第106~120位氨基酸(ETRARLSKELQAAQA)作为合成多肽的序列,见图1。
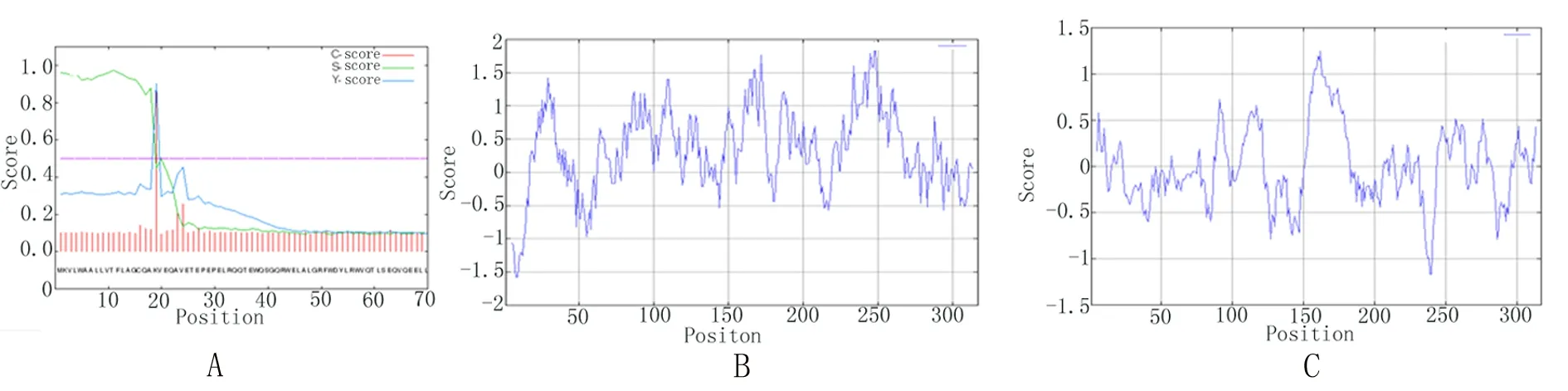
A为信号肽分析结果,位于19位氨基酸对应的c值最大,s值陡峭,y值最高峰,该处预测为信号肽的剪切位点。B为亲水性分析结果,蛋白的亲水部位与蛋白抗原表位有密切的联系。C为抗原性分析结果,抗原肽段应选择亲水性和抗原性强的区域,并综合参考各种参数。
图1ApoM蛋白质性质分析结果
2.2抗原多肽的溶解和分装取一个10 mL的离心管,加入6 mg多肽,滴加DMSO溶解后,加入PBS调至6 mL并混匀,然后分装在6支冻存管中,每支1 mg/mL,便于后续实验,置于-20℃冰箱保存备用,避免反复冻融,见图2。
2.3ApoM多克隆抗体的检测利用耦联了KLH的ApoM多肽抗原免疫新西兰大白兔,获得兔抗血清。通过Western bIot检测,ApoM剔除小鼠及野生型和杂合子小鼠肝组织中ApoM的表达,结果显示在23 ku左右有一特异性条带,结果与预测一致,商业化的ApoM单抗约为25 ku,如图3所示。

A:向多肽粉末中加入DMSO,溶解多肽;B:用PBS定容至6 mL;C:将溶解后的多肽溶液分装冻存管中,放-20℃冰箱保存备用。
图2多肽的溶解和分类

A为免疫后兔抗血清的检测结果,Lane1~2为野生型鼠,Lane3~4为杂合子鼠,Lane5~6为剔除鼠;B为商业化的ApoM单克隆抗抗的检测结果,Lane1~2为野生型鼠,Lane3~4为剔除鼠。
图3western blot检测结果
3 讨论
ApoM是一种新型的与脂蛋白相关的载脂蛋白,主要存在于高密度脂蛋白(HDL),ApoM可能影响HDL代谢和抗动脉粥样硬化的功能,并与糖尿病等代谢性疾病关系密切。对ApoM 近启动子侧多态性位点研究发现,T-778C的单核苷酸多态性与 1 型糖尿病显著相关;且T-778C与胆固醇水平相关,与2 型糖尿病的易感性有关,提示 ApoM 基因启动子的 T-778C 可能参与了1型和2 型糖尿病的共同发病机制[6,10]。ApoM在冠心病发生发展扮演重要角色,促进HDL成熟,可逆转动脉粥样斑块的形成,可能作为冠心病诊断与治疗的新靶点。而在糖尿病的发病过程中,胰岛素、血糖对ApoM调控的复杂机制以及ApoM与糖尿病的发病关联还有待进一步实验揭示。ApoM在肾脏组织中高表达,为肾巨蛋白配体,可阻止肾脏脂质分子的丢失,但是其在肾脏疾病中的作用尚少见报道,对于其在肾脏组织内的生理及病理作用有待进一步揭示。为进一步研究ApoM在上述疾病中的作用及其对信号通路的影响机制,我们采用人工合成并耦联了KLH的ApoM多肽片段作为抗原,为了增强机体的免疫应答反应,采用佐剂和抗原混合免疫的方法。该方法可以刺激网状内皮系统,通过增加免疫活性细胞来促进T细胞与B细胞的相互作用,进而增强抗体的产生。用乳化后的抗原免疫新西兰大白兔,最终获得兔多克隆抗体。免疫动物时,由于个体差异及不同抗原的最佳免疫剂量不同,过高或过低都无法获得最佳的免疫效果。因此我们选择两只实验兔子,分别注射采用不同剂量的抗原,以保证有一只兔子能产生最佳的免疫效果。采用人工合成多肽的方法制备抗原,与传统原核表达目的蛋白制备的抗原相比,人工合成多肽纯度高,且操作简洁,所得抗体特异性强,灵敏度高,进一步节约制备抗体所用时间[11]。为进一步方便研究人员研究该分子在疾病中的作用提供便利的检测基础,同时也为探明ApoM信号传导通路及机制提供有效的研究手段。
[1]XU N,DAHLBACK B.A novel human apolipoprotein (apoM)[J].J Biol Chem,1999,274(44):31286-31290.
[2]ZHANG XY,DONG X,ZHENG L,etal.Specific tissue expression and cellular localization of human apolipoprotein M as determined by in situ hybridization[J].Acta Histochem,2003,105(1):67-72.
[3]黄丽珠,章 尧,陈昌杰,等.ApoM在不同肝细胞中的表达及其与临床病理因素的关系[J].皖南医学院学报,2012,31(3):182-185.
[4]XU WW,ZHANG Y,TANG YB,etal.A genetic variant of apolipoprotein M increases susceptibility to coronary artery disease in a Chinese population[J].Clin Exp Pharmacol Physiol,2008,35(5-6):546-551.
[5]WU X,NIU N,BRISMAR K,etal.Apolipoprotein M promoter polymorphisms alter promoter activity and confer the susceptibility to the development of type 1 diabetes[J].Clin Biochem,2009,42(1-2):17-21.
[6]NIU N,ZHU X,LIU Y,etal.Single nucleotide polymorphisms in the proximal promoter region of apolipoprotein M gene (apoM) confer the susceptibility to development of type 2 diabetes in Han Chinese[J].Diabetes Metab Res Rev,2007,23(1):21-25.
[7]章尧,陈昌杰,杨清玲,等.干扰肝细胞核因子-1α对HepG2细胞载脂蛋白M及胆固醇相关代谢酶表达的影响[J].中华肝脏病杂志,2011,19(2):121-126.
[8]CHRISTOFFERSEN C,OBINATA H,KUMARASWAMY SB,etal.Endothelium-protective sphingosine-1-phosphate provided by HDL-associated apolipoprotein M[J].Proc Natl Acad Sci USA,2011,108(23):9613-9618.
[9]王德斌.快速制备抗原-佐剂乳化液新方法[J].细胞与分子免疫学杂志,2001,17(6):596.
[10] ZHOU JW,TSUI SK,NG MC,etal.Apolipoprotein M gene (APOM) polymorphism modifies metabolic and disease traits in type 2 diabetes[J].PLoS One,2011,6(2):e17324.
[11] 胡小元,张岐蜀,段伟,等.用人工合成多肽作为半抗原制备Bt Cry1Ac的单克隆抗体[J].中国农业科技导报,2012,14(2):88-94.
Using synthetic peptide to prepare the rabbit anti-ApoM polyclonal antibody
TAN Fengbiao,GAO Jialin,LU Xiaohua,ZHANG Yao
Department of Biochemistry,Wannan Medical College,Wuhu 241002,China
Objective:To prepare rabbit anti-appliprotein M (ApoM) polyclonal antibody using synthetic peptides.Methods:Specific amino acid sequences of ApoM was initially synthesized and selected after analysis.Keyhole limpet hemocyanin (KLH) was used as carries in the conjugation of the peptides for antibody production.Then rabbit anti-ApoM polyclonal antibody was prepared using the serum obtained from male New Zealand white rabbits undergone repeatedly boosted immunization,and determined with Western blot.Results:The rabbit anti-ApoM polyclonal antibody was successfully prepared with artificially recombined and purified polypeptides.Conclusion:The rabbit anti-ApoM polyclonal antibody may lay a foundation for following experimental study of the ApoM expression.
appliprotein M;polypeptide;polyclonal antibody
1002-0217(2016)05-0422-04
芜湖市科技局产学研项目(2013cxy04);安徽省自然科学基金项目(1508085NH149)
2016-04-10
谭凤彪(1984-),男,2014级硕士研究生,(电话)13955375794,(电子信箱)253791056@qq.com;
.1
A
10.3969/j.issn.1002-0217.2016.05.004
章尧,男,教授,博士,硕士生导师,(电子信箱)zhangyao@ahedu.gov.cn,通信作者.

