糖尿病模型大鼠痛觉的心理生理学观察
蒋佳珅, 袁 佳,邵姚君,刘 菊,傅雨晨,周婷婷,郑 超,汪萌芽
(皖南医学院 1.细胞电生理研究室;2.启明星小组,安徽 芜湖 241002)
·基础医学·
糖尿病模型大鼠痛觉的心理生理学观察
蒋佳珅1,2, 袁佳1,2,邵姚君1,2,刘菊1,2,傅雨晨1,2,周婷婷1,2,郑超1,汪萌芽1
(皖南医学院1.细胞电生理研究室;2.启明星小组,安徽芜湖241002)
目的:探讨糖尿病模型大鼠的痛反应、痛感觉、痛情绪的变化及其心理生理特性。方法:成年SD大鼠18只随机均分为对照组和糖尿病模型组,模型组用链唑霉素(STZ)腹腔注射法制备。在造模前、造模后第21天,检测两组大鼠的光辐射热甩尾反应潜伏期。并在第21天的检测后,对麻醉大鼠的痛感觉代表区异颗粒区(DZ)和痛情绪代表核团基底外侧杏仁核(BLA)电活动,以及心电、呼吸肌肌电、皮肤电导、体温进行心理生理学记录,并观察热、夹尾刺激的影响。结果:模型组大鼠血糖在STZ注射后维持在>16 mmol/L,其甩尾反应潜伏期较正常组缩短(P<0.01)。模型组大鼠的BLA基础放电频率高于正常组(P<0.01),两组大鼠BLA、DZ的放电频率在两种伤害性刺激时均提高(P<0.05),热刺激时,模型组大鼠反应时BLA、DZ的放电频率增加高于正常组(P<0.05),而在夹尾刺激时,模型组仅BLA的放电频率增加高于正常组(P<0.05)。同时,两种刺激导致两组大鼠均出现心率、呼吸频率加快,但正常组在热刺激后心率、呼吸频率较快恢复,模型组未完全恢复(P<0.01)。结论:糖尿病模型大鼠的痛反应显著敏化,且伤害性刺激所诱发的痛感觉、痛情绪及其生理反应亦明显增强。
糖尿病神经病理性痛;痛反应;痛觉;痛情绪;心理生理学
国际疼痛研究协会(IASP)将慢性疼痛定义为“超过正常的组织愈合时间的疼痛”[1]。 慢性疼痛不仅给患者带来躯体的痛苦,而且使患者在心理上承受沉重的压力,导致生活质量的严重受损。尽管已有较多研究提示,慢性疼痛是一种脑功能障碍性疾病,因改变大脑脑区间的信息交流和整合,进而影响脑的功能、心理,以及行为活动[2],但慢性疼痛的产生机制仍是需要进一步研究的热点课题。在临床上,各种疾病所致的周围神经病变是引起慢性疼痛较为常见的原因,而糖尿病神经病理性痛是糖尿病的严重并发症之一[3]。注射链唑霉素可损坏胰岛素内分泌细胞,使大鼠体内血糖浓度快速上升且这种高血糖水平能稳定地维持数月,形成糖尿病。这种糖尿病模型可导致大鼠长时间的热和机械痛觉过敏[4],这为研究疾病所致的慢性疼痛的病程发展提供了一个可靠的模型。本文旨在应用心理生理学实验技术,观察和探究在疾病所致的慢性疼痛的痛感觉、痛情绪代表核团的电活动和外周生理指标的变化以及三者间的相关性,为进一步认识痛感觉、痛情绪和相关生理指标变化与慢性疼痛病情发展的关系,以及深入研究慢性疼痛发展变化的机制,提供参考。
1 材料与方法
1.1动物选用成年雄性SD大鼠(体质量240~260 g)18只,由南京青龙山动物繁殖场提供,动物合格证号SCXK(浙)2014-0001。分组饲养,自由取食。适应性饲养1周。
1.2药品与仪器链唑霉素(streptozotocin,STZ),血糖仪(Accu-Chek Active,Roche Diagnostics GmbH,German),光辐射热测痛仪(LE 7106 Light Beam Analgesy-Meter, Panlab,USA),Model 1800 双通道微电极放大器(A-M Systems,USA)、Powerlab生理信号采集与分析系统(含Chart Pro软件,澳大利亚)、充气防震台(江西连胜实验装备有限公司)、手术显微镜、脑立体定位仪(上海奥尔科特生物科技有限公司)、电钻、恒温毯(上海奥尔科特生物科技有限公司)、同芯不锈钢电极、双层铜网电生理屏蔽室、常规动物手术器械等。
1.3模型制备及分组18只大鼠随机均分为模型组和对照组。模型大鼠制备:9只大鼠禁食 16 h后,按 60 mg/kg一次性腹腔注射3% (W/V)STZ溶液。对照组注射等量的生理盐水。两组大鼠分别在注射STZ或生理盐水前及注射后7、14、21 d测尾静脉血糖,血糖持续≥16 mmol/L则为糖尿病模型大鼠[5]。
1.4实验方法
1.4.1光辐射热甩尾反应潜伏期测定将两组大鼠分别于造模前、造模后第21天进行光辐射热甩尾反应测试,即应用光辐射热测痛仪,分别测定各大鼠在不同光刺激强度(Focus=10、15、23、34、51、76)下甩尾反应的潜伏期(潜伏期>20 s的记为20 s)。获得光辐射热甩尾反应的时反应量-效关系(TDRR)数据。
1.4.2多项生理指标及脑内双核团细胞外记录大鼠腹腔注射20%氨基甲酸乙酯(1.5 ml/kg),待麻醉后将大鼠置于37.0℃保温毯上,头部固定于脑立体定位仪上,整个实验装置置于双层铜网电生理屏蔽罩内的防震台上。固定大鼠头颅后,暴露颅骨,按Paxinos和Watson大鼠立体定位图谱确定异颗粒区(DZ)、基底外侧杏仁核(BLA)的电极尖端位置[6],DZ:前囟前后(AP)0.48~-3.30 mm,旁开(L)3.50~4.60 mm,背腹深度(DV)0.80~3.00 mm; BLA:AP -1.56~-3.36 mm,旁开(R)3.90~4.60 mm,DV 7.80~8.82 mm,建立六通道(皮肤电导、肌电、心电、体温、BLA、DZ)同步记录。记录20 min基础数值后,对尾部外1/3处依次进行①热刺激,50℃,10 s;②夹尾刺激,10 s,强度以大鼠四肢抽动为宜,刺激间隔时间为20 min,同时记录脑核团放电频率及外周生理指标的变化[7]。
1.4.3信号采集的参数由记录电极引导的生物电信号经放大器放大后,导入PowerLab 8通道生理信号采集系统,通过Chart软件进行信号采集、存盘,采样频率为10 kHz。心电信号设置为高通10 Hz、低通200 Hz,呼吸肌肌电信号为高通0.1 Hz、低通200 Hz,设置皮肤电导信号量程为10 μS,脑内核团BLA、DZ细胞外记录的生物电信号设置为高通10 Hz、低通2 kHz,体温信号设置低通为10 Hz。
1.5数据分析
1.5.1记录信号的分析呼吸肌肌电周期用Chart Pro软件中周期测量功能进行分析,即设150 Hz的高通滤波,按数据模拟的准确程度适当调整最小周期与最小峰高S.D.,再将数据添加到数据板,所算出的均数即为平均肌电周期。对其他记录到的信号,亦用Chart Pro软件进行常规测量和分析,其中核团电活动的频率采用放电频率直方图反映、幅值则是选定时间的每2 s内信号幅度最大值减去最小值的平均值。
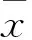
2 结果
2.1大鼠血糖、体质量的变化9只模型组大鼠血糖在注射STZ后的第7、14、21天检测均维持>16 mmol/L水平,糖尿病发生率为100%(表1)。同时观察到模型组大鼠在注射STZ后第2天就出现多饮、多食、多尿。与对照组相比,模型组大鼠体质量在造模后第1周明显下降,后两周体质量无明显增长(表1)。与对照组大鼠相比,还观察到糖尿病模型大鼠的毛色暗淡、肌肉萎缩、尾静脉采血点愈合缓慢,安静休息时间增多,自发活动和理毛动作减少。
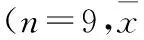

指标组别注射前注射后7d14d21d体质量/g对照组270.5±15.0288.2±12.4305.7±9.3318.5±11.1模型组270.8±6.5255.2±16.6*#260.6±14.2*#259.1±14.1*#血糖/(mmol/L)对照组4.7±1.37.5±0.57.3±0.57.8±0.4模型组5.2±0.730.9±2.3*#31.7±1.5*#32.3±1.4*#
与注射前比:*P<0.05, 与对照组相比:#P<0.05。
2.2两组大鼠甩尾反应潜伏期的比较分析两组大鼠在不同光辐射热刺激强度(Focus=10、15、23、34、51、76)下甩尾反应的潜伏期,结果显示在各刺激强度下,模型组大鼠甩尾反应潜伏期低于对照组(P<0.01,图1)。
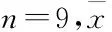
图1两组大鼠甩尾反应潜伏期时反应量-效关系的比较
2.3两组大鼠BLA、DZ电活动基础值的比较对两组大鼠两核团前20 min基础记录数据分析显示,模型组大鼠的BLA基础平均放电频率1.99 Hz,显著高于对照组的1.69 Hz(P<0.01,图2A),而两组比较DZ的放电频率变化不明显(图2B)。BLA和DZ核团放电频率的相关系数在对照组大鼠为r=0.685(P=0.029),在模型组大鼠为r=0.823(P=0.006)。
2.4热刺激引起的反应
2.4.1热刺激对两组大鼠BLA、DZ放电频率的影响在热刺激后,对两组大鼠进行BLA、DZ放电频率直方图分析,结果显示对照组有8只、模型组有7只大鼠出现刺激后两核团放电频率增高。对诱发反应大鼠的热刺激前2 min、峰反应时及峰反应后2 min的核团放电频率进行统计学分析显示(图3),两组大鼠反应时BLA、DZ放电频率相对刺激前有明显增加(P<0.01),对照组BLA反应后相对反应时放电频率恢复(P<0.01),而模型组BLA反应后并未恢复,频率仍较刺激前高(P<0.05)。将峰反应时与刺激前放电频率之比记作反应的放电频率变化率,将两组大鼠热刺激引起的放电频率变化率进行统计学分析,结果显示模型组反应时BLA、DZ放电频率变化率高于对照组(P<0.05)。
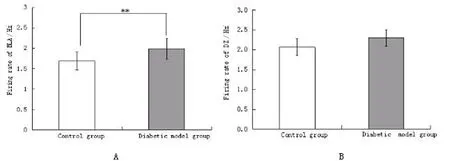

图2两组大鼠BLA(A)、DZ(B)基础放电频率的比较
2.4.2热刺激对两组大鼠生理指标的影响对两组大鼠热刺激前、反应时、反应后的心率、呼吸肌肌电频率进行分析,观察到两组大鼠均出现反应时较刺激前心率及呼吸频率加快的现象(图4A、B,P<0.01)。且对照组中,反应后大鼠心跳加快后又恢复(P<0.01),而在模型组中,热刺激心率未完全恢复(P<0.01)。进一步分析两组大鼠刺激时的心率变化率及呼吸变化率,模型组的心率变化率及呼吸变化率均大于对照组(P<0.01)。


图3热刺激对两组大鼠BLA(A)、DZ(B)放电频率的影响


图4热刺激对两组大鼠心率(A)、呼吸频率(B)的影响
2.5夹尾刺激引起的反应
2.5.1夹尾刺激对两组大鼠BLA、DZ放电的影响在夹尾刺激后,分析两组大鼠核团放电频率直方图,结果显示对照组有7只、模型组有8只大鼠出现刺激后两核团放电频率增高的现象。对诱发反应大鼠的夹尾刺激前2 min、峰反应时及峰反应后2 min的核团放电频率进行统计学分析显示,两组大鼠反应时BLA、DZ放电频率较刺激前增加(P<0.01)。分析两组大鼠夹尾刺激引起的放电频率变化率(图5),模型组BLA放电频率变化率高于对照组(P<0.05),两组的DZ放电频率变化率差异无统计学意义。


图5夹尾刺激两组大鼠BLA(A)、DZ(B)放电频率变化率的比较
2.5.2夹尾刺激对两组大鼠生理指标的影响对两组大鼠夹尾刺激前、刺激时、刺激后的心率、呼吸肌肌电频率进行分析,结果显示,两组大鼠均出现刺激时较刺激前心率及呼吸频率加快(P均<0.01)。模型组的心率变化率及呼吸变化率均大于对照组(图6,P<0.01)。
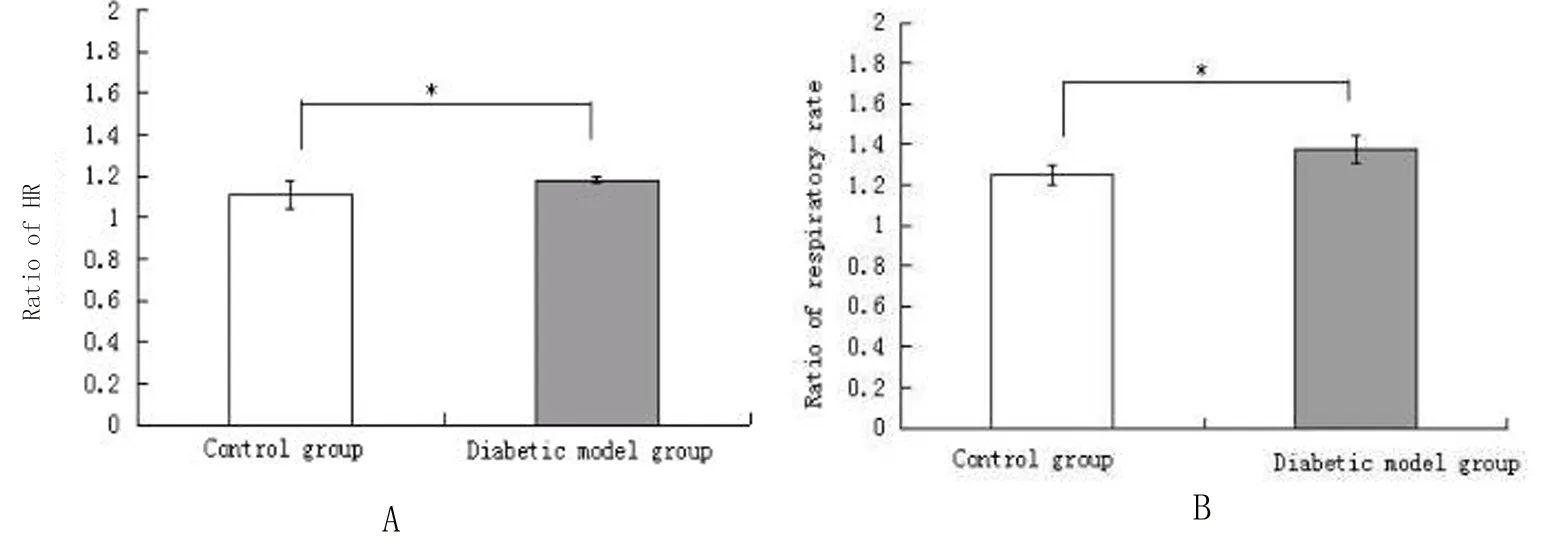

图6夹尾刺激两组大鼠心率(A)、呼吸肌肌电频率(B)变化率的比较
3 讨论
本实验采用注射链唑霉素(STZ)损伤胰岛β细胞的方法来诱导糖尿病。相较于其他造模方式,此方法具有稳定、快速、组织毒性相对较小等优点[5]。同时造模过程中需注意,STZ易见光分解, 配置溶液时应快速完成,且配置完后置于避光容器中,将容器置于冰水混合物中,减少药效损失。注射后立即将大鼠倒立,有利于药物流向位置较低的胰腺部位,可直接与胰腺接触,破坏胰岛,提高造模成功率[8]。本实验采用的是SD大鼠,有实验表明SD大鼠对STZ的抵抗力强于Wistar大鼠[9],同时给药后需加强饲养,勤换垫料,采完血后采血部位涂抹抗生素软膏,防止感染,所以试验中模型组大鼠的死亡率较低。本实验在注射STZ后测得随机血糖>16 mmol/L,这也与文献报道中测得的大鼠空腹血糖检测相近[9-10]。
由于机械刺激和热刺激对感受器有抑制或致敏作用[5],这会导致后续的无论是甩尾反应还是核团记录时产生误差,此作用依赖于两次刺激的时间间隔,完全恢复需要10 min以上,故本实验光热刺激时间间隔为10 min,核团记录时刺激间隔为20 min。此外,有研究表明同一大鼠夜间疼痛阈值明显高于白天,上午和下午的痛阈也存在差异[11]。故本实验的光辐射热甩尾反应检测定点于上午8点至10点进行。大部分的文献报道都指出:注射STZ 1周后,大鼠机械痛阈和热痛阈开始下降[12],本实验中,注射STZ 3周后,在各光热刺激强度下,模型组大鼠甩尾反应潜伏期均明显低于对照组,与国外相应报道[12-13]一致,表明糖尿病神经病理性痛大鼠的痛反应显著敏化。
本实验采用脑内双核团细胞外记录和多项生理指标同步记录技术,既可检测在伤害性刺激时脑内痛感觉代表区和痛情绪代表核团的放电频率,还能将反映情绪反应的多项生理指标进行同步分析,构成了痛觉的综合性心理生理学记录和分析系统[6-7]。结果表明,模型组大鼠BLA的基础放电频率高于对照组,DZ无显著差异。可以看出,与痛情绪相关的核团BLA的兴奋性增高。而在对于热刺激的反应中,对照组BLA反应后放电频率恢复,而模型组BLA反应后并未恢复,频率仍较刺激前高。这表明,神经病理性疼痛大鼠在热刺激时诱发了BLA更为长时程的放电反应。与之相应的是对照组中,热刺激后大鼠心跳加快后又恢复,而在模型组中,热刺激心率均未完全恢复。由此推测热刺激引起了神经病理性痛大鼠更为强烈及持久的痛情绪反应。而在夹尾刺激引起的反应中,两组大鼠反应时BLA、DZ放电频率较刺激前有明显增加,模型组BLA放电频率变化率高于对照组,DZ放电变化率则相似。这表明糖尿病神经病理性疼痛大鼠在夹尾刺激时更易诱发明显的BLA放电变化。据此推测,在大鼠糖尿病神经病理性疼痛中,处理痛情绪的中枢对刺激可能更加敏感,反应时间也更长。
[1]韩济生. 疼痛学[M]. 北京:北京大学出版社,2012: 2-61.
[2]BALIKI MN, BARIA AT, APKARIAN AV. The cortical rhythms of chronic back pain[J]. J Neurosci, 2011, 31(39): 13981-13990.
[3]周强,李起鸿,杨柳,等. 大剂量糖皮质激素诱导兔股骨头坏死的研究[J]. 第三军医大学学报,2000,22(3): 249-252.
[4]COURTEIX C, ESCHALIER A, LAVARENNE J. Streptozocin-induced diabetic rats: behavioural evidence for a model of chronic pain[J]. Pain, 1993, 53(1): 81-88.
[5]王群,王清秀,冉然,等. 糖尿病神经病理性痛大鼠模型的制备[J]. 郧阳医学院学报,2009,28(3):240-243.
[6]汪伟伟,刘菊,蒋雪丽,等. 不同伤害性刺激致大鼠痛感觉与痛情绪的比较[J]. 生命科学研究,2014,18(5): 411-417.
[7]刘伟,汪伟伟,黄军,等. 大鼠脑内双核团电活动与多项生理指标的同步记录技术[J]. 皖南医学院学报,2013,32(5):423-429.
[8]王太成, 任大力, 陈启龙. 链脲佐菌素诱导 1 型糖尿病大鼠模型方法改进[J]. 新疆医科大学学报, 2010, 33(5): 499-500.
[9]郭学军, 邹移海, 吴凌, 等. 链脲佐菌素诱导 1 型糖尿病大鼠模型的影响因素探讨[J]. 动物医学进展, 2008, 29(4): 1-5.
[10] 蒋升, 谢自敬, 张莉. 链脲佐菌素诱导 1 型糖尿病大鼠模型稳定性观察[J].中国比较医学杂志, 2006, 16(1): 16-18.
[11] QUATTRINI C, TESFAYE S. Understanding the impact of painful diabetic neuropathy[J]. Diabetes Metab Res Rev, 2003, 29(Suppl 1): s2-8.
[12] COURTEIX C, BARDIN M, CHANTELAUZE C,etal. Study of the sensitivity of the diabetes-induced pain model in rats to a range of analgesics[J]. Pain, 1994, 57(2): 153-160.
[13] FOX A, EASTWOOD C, GENTRY C,etal. Critical evaluation of the streptozotocin model of painful diabetic neuropathy in the rat[J]. Pain, 1999, 81(3): 307-316.
Psychophysiological observations of the pain in diabetic rats
JIANG Jiashen, YUAN Jia,SHAO Yaojun, LIU Ju, FU Yuchen,ZHOU Tingting,ZHENG Chao,WANG Mengya
Cell Electrophysiology Laboratory,Wannan Medical College,Wuhu 241002, China
Objective:To investigate the underlying psychophysiological mechanisms of diabetes-induced pain in rat models via observing the changes of pain response, sensation and emotion in model rats. Methods:Eighteen adult male rats were randomized into control group and diabetic model group. Rat models were induced by intraperitneal injection of streptozotocin (STZ), and light radiant heat test was performed to measure the tail-flick latency of rats in the two groups before and on day 21 after STZ induction. Electrical activities at dysgranular zone (DZ), the pain sensation-related brain region,and basolateral amygdala (BLA) ,the pain emotion-related nucleus were both extracellularly recorded with simultaneous observation of physiological functions, including electrocardiograph, electromyography of respiratory muscles, skin conductance and body temperature, in anaesthetized rats. Thermal stimulation and tail pinch stimulation were used to elicit nociceptive responses. Results:The model rats had blood glucose concentration over 16 mmol/L after injection of STZ, significantly shortened tail-flick latency(P<0.01),and higher BLA basal firing rate(P<0.01). Although the firing rate of BLA and DZ was increased in both groups by the two types of stimulation (P<0.05), yet rats in model group had increased firing rate at BLA and DZ to the radiant test(P<0.05), and exclusively increased BLA firing rate to the tail pinch(P<0.05). The heart rate and the respiratory rate were increased in both groups by two types of stimulation, and recovery of the heart and respiratory rate was quicker following stimulation in the control group, whereas was incomplete in model group(P<0.01). Conclusion:The pain response appears more sensitized for diabetic rats that have significantly enhanced pain sensation, pain emotion and physiological functions under nociceptive stimulations.
diabetic neuropathic pain; pain response; pain sensation; pain emotion; psychophysiology
1002-0217(2016)05-0409-06
安徽省大学生创新创业训练计划项目 (AH201410368062);人文与管理学院大学生科研培育基金项目 (RG201430);国家自然科学基金项目(31271155)
2016-07-11
蒋佳珅(1993-),女,2011级医学影像学专业本科生,(电话)18355351121,(电子信箱)j1j1s93@163.com;
.1
A
10.3969/j.issn.1002-0217.2016.05.001
汪萌芽,男,教授,硕士生导师,博士,(电子信箱)wangmy@wnmc.edu.cn,通信作者.

