高盐饮食诱导和两肾一夹法复制高血压大鼠模型的比较
史 娜,王竹青,王海珍,王 静,周萍萍,姜玉新,王海华
(皖南医学院 1.生理学教研室;2.临床医学院,安徽 芜湖 241002)
·基础医学·
高盐饮食诱导和两肾一夹法复制高血压大鼠模型的比较
史娜1,王竹青2,王海珍1,王静1,周萍萍1,姜玉新1,王海华1
(皖南医学院1.生理学教研室;2.临床医学院,安徽芜湖241002)
目的:通过高盐饮食诱导和两肾一夹法分别复制高血压大鼠模型,初步探讨其可能机制。方法:18只雄性SD大鼠随机分成3组(n=6),正常对照组(NC组)、两肾一夹高血压模型组(2K1C组)和高盐饮食性高血压模型组(SH组),采用左肾动脉结扎的方法复制肾性高血压模型,给予含4% NaCl饲料喂养复制高盐饮食性高血压模型,普通饲料喂养不进行手术措施的为正常对照组。各组大鼠在每天相同时间点测量体质量和血压,连续4周;造模成功后,通过生物信号处理系统测定各组大鼠胸主动脉环张力,HE染色观察各组大鼠肾脏及血管形态学变化,检测血管匀浆中诱导型一氧化氮合酶(iNOS)活性及一氧化氮(NO)含量。结果:同NC组大鼠相比,SH组和2K1C组大鼠血压明显升高(P<0.05),体质量变化无统计学意义;SH组和2K1C组胸主动脉环对去氧肾上腺素(Phe)的收缩反应明显增强(P<0.05),对乙酰胆碱(ACh)的舒张反应显著降低(P<0.05或P<0.01);对硝普钠(SNP)的舒张反应无统计学意义;HE染色显示,SH组和2K1C组肾小体萎缩,肾脏组织结构中的小动脉出现玻璃样变性,主动脉内膜损伤,中膜层增厚且细胞形态改变;SH组和2K1C组血管环匀浆中iNOS活性明显增强(P<0.01),NO含量明显下降(P<0.05)。结论:高盐饮食诱导和两肾一夹法均成功复制高血压大鼠模型,内皮损伤可能是其产生机制之一,前者简易安全,大鼠死亡率低,更接近于临床,是复制高血压大鼠模型的优先选择。
高血压;高盐饮食;两肾一夹法
高血压是我国多发疾病之一,其主要发病因素有遗传和环境,大量研究证明高盐膳食是高血压发病的主要危险因素之一。为了研究高血压疾病,在众多动物模型中选择最适合的模型是至关重要的。两肾一夹的肾性高血压模型通过激活肾素-血管紧张素系统(RAS)使血压升高。而高盐饮食诱导的高血压模型,其发生机制尚不明确,目前研究发现血流量改变、RAS激活、一氧化氮水平降低、交感神经活性增强、内分泌、氧化应激、肾脏及遗传基因等[1-4]是其可能机制。本文通过高盐饮食诱导和两肾一夹法分别诱导高血压大鼠模型入手,比较两者的优缺点,并初步探讨其发生的可能机制。
1 材料与方法
1.1实验动物正常SD大鼠18只,雄性,(240±20)g,购自合肥蜀山实验动物中心,合格证号:SCXK(苏)2009-0001。
1.2主要试剂与仪器去氧肾上腺素(Phenylephrine,Phe),上海禾丰制药有限公司;氯化乙酰胆碱(Acetylcholine,ACh),上海源叶生物科技有限公司;注射用硝普钠(sodium nitroprusside,SNP),广东宏远集团药物有限公司;NO、 iNOS检测试剂盒(南京建成生物工程研究所);无创血压计和生物信号采集系统RM6240BD(成都仪器制造厂);Medlab-U/8c生物信号采集分析系统(南京美易科技有限公司);10 g张力换能器(北京新航兴业科贸有限公司);倒置荧光显微镜及成像系统(日本Olypums公司);D3024R高速微量冷冻离心机;UV-3200PCS 可见紫外分光光度计( 上海精密科学仪器有限公司)。
1.3实验方法
1.3.1高血压大鼠模型制备高盐饮食性高血压参照张玉青等[5]方法;肾性高血压大鼠模型参照王文靖等[6]方法,待手术2周后,以尾动脉收缩压超过140 mmHg且较手术前升高10 mmHg以上者为造模成功。
1.3.2大鼠血管环功能实验20%氨基甲酸乙酯溶液(5 mL/kg)麻醉大鼠,固定后迅速开胸,取主动脉胸腹段,在通以95% O2+ 5% CO2混合气体的4℃ K-H液中制作约3~4 mm长的动脉环,经Medlab-U/8C生物信号采集系统记录血管张力,灌流装置浴槽内通以 95% O2+ 5% CO2混合气体的37℃ Krerbs-Henseleit(K-H)液,血管环先以0 g张力稳定30 min,再1.5 g前负荷平衡60 min,每15 min置换新鲜K-H液1次;待血管环张力稳定后,用60 mmol/L KCl刺激使血管环收缩达峰值,再用K-H液洗脱至基线,重复三次。待血管环张力重新稳定后,运用10-6mol/L Phe使血管环收缩达峰值并稳定后,用10-5mol/L ACh检验血管内皮完整性。若加入ACh后使Phe预收缩的血管舒张60%~90%则可认为内皮完整;反之,则认为内皮被破坏。以10-6mol/L Phe诱发的最大收缩幅度为100%,以加入药物后的血管张力幅度与Phe诱发的最大收缩幅度之间的比例反应血管张力的变化。动脉环收缩率(%)=(累加Phe后的胸主动脉环收缩张力-最适初始张力)/空白组最大收缩张力平均值×100%;动脉环舒张率(%)=(加Phe后的胸主动脉环最大收缩力-累加ACh后的血管张力)/(加Phe后的胸主动脉环最大收缩张力-基础血管张力)×100%。
1.3.3实验动物分组NC组(普通饲料喂养不进行手术措施),SH组(含4% NaCl饲料喂养)和2K1C组(左肾动脉结扎),每组6只。
1.3.4血压、体质量测定分别于造模前和造模第1~28天每天相同时间点,在大鼠清醒安静状态下无创性测定尾动脉收缩压,每只测3次,取平均值;于造模前和造模第7、14、21、28天测量大鼠体质量。
1.3.5生化指标检测待血管环功能实验结束后,制备血管环匀浆,在4℃下3500 r/min 离心15 min,取上清液待测血管中iNOS 活性和NO含量。
1.3.6组织形态学检测在制备血管环的同时,留取各组大鼠肾脏用10%福尔马林溶液固定,血管环功能实验结束后,10%福尔马林溶液固定,常规石蜡包埋切片,HE染色,光学显微镜下观察其形态学变化。
1.4统计学处理数据分析处理使用SPSS 18.0统计软件。数据用均数±标准差表示。多组数据之间均数比较用单因素方差分析,两两比较用q检验法,以P<0.05表示差异具有统计学意义。
2 结果
2.1大鼠体质量的组间变化各组大鼠体质量测定结果显示,与NC组相比,SH组在整个造模过程中无统计学意义(P>0.05);2K1C组大鼠在手术第28天体质量才有明显变化(F=6.38,P<0.05),见图1。
2.2大鼠尾动脉收缩压测定通过无创法测定大鼠尾动脉收缩压,结果显示,与NC组相比,2K1C组大鼠手术第4天开始,血压明显升高(F=7.07,P<0.05);而SH组大鼠在给予4%NaCl饲料喂养第16天开始血压明显升高,差异有统计学意义(F=46.58,P<0.05或P<0.01),见图2。

*P<0.05vs. NC组。
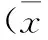

*P<0.05,**P<0.01vs. NC组;#P<0.05,△P<0.01vs. SH组。
2.3收缩和舒张药物对血管环的影响
2.3.1Phe对大鼠胸主动脉环收缩率的影响胸主动脉环在1.5 g的前负荷稳定的基础上,通过累积浓度给药,使Phe的浓度分别为10-8~10-5mol/L,结果发现,与NC组相比,Phe浓度10-7~10-5mol/L时,SH组和2K1C组胸主动脉环收缩率显著升高(P<0.05或P<0.01),随浓度依赖式增强(见图3)。
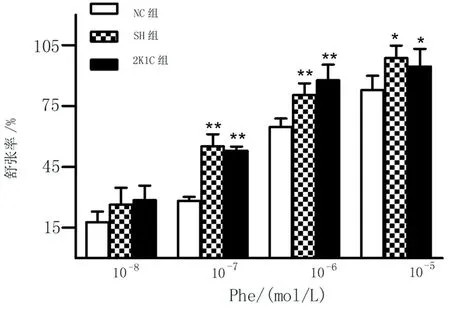
*P<0.05,**P<0.01vs. NC组。10-7mol/L 时F=89.36,P<0.01;10-6mol/L时F=23.19,P<0.01;10-5mol/L时F=7.19,P<0.05。
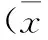
2.3.2乙酰胆碱(ACh)对大鼠胸主动脉环舒张率的影响胸主动脉环在1.5 g的前负荷稳定的基础上,向浴槽中加入10-6mol/L Phe使收缩达峰值并稳定后,通过累积浓度给药,使ACh的浓度为10-8~10-5mol/L,结果显示,与NC组相比,SH组和2K1C组血管环舒张率在ACh浓度为10-8mol/L与10-7mol/L时差异无统计学意义(P>0.05),ACh的浓度为10-6mol/L(F=12.93,P<0.05或P<0.01)与10-5mol/L(F=41.82,P<0.01)时舒张率随ACh浓度增加而显著下降(见图4)。

*P<0.05,**P<0.01vs. NC组。
2.3.3SNP对大鼠胸主动脉环舒张率的影响胸主动脉环在1.5 g的前负荷稳定的基础上,向浴槽中加入10-6mol/L Phe使收缩达峰值并稳定后,通过累积浓度给药,使浴槽中SNP浓度为10-8~10-5mol/L,结果显示,与NC组相比,SH组和2K1C组大鼠胸主动脉舒张率无统计学意义(P>0.05,见图5)。

2.4大鼠胸主动脉环匀浆iNOS活性和NO含量的组间比较通过紫外分光光度计对大鼠胸主动脉环匀浆中iNOS活性、NO含量进行检测,结果显示,与NC组相比,SH组和2K1C组组织匀浆中iNOS活性明显升高(P<0.01),NO含量明显下降(P<0.05),见表1。
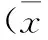
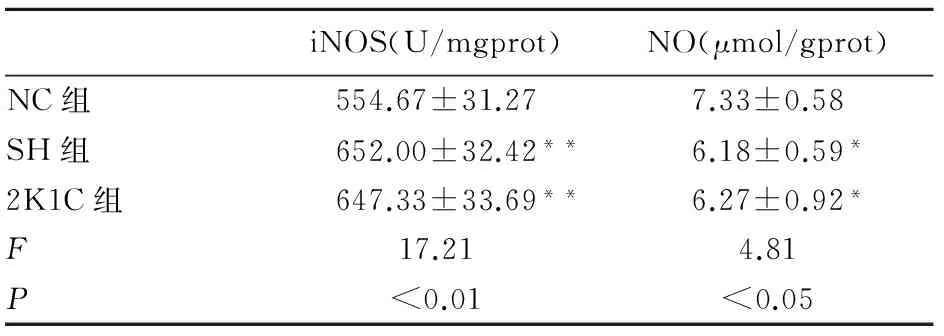
iNOS(U/mgprot)NO(μmol/gprot)NC组554.67±31.277.33±0.58SH组652.00±32.42**6.18±0.59*2K1C组647.33±33.69**6.27±0.92*F17.214.81P<0.01<0.05
*P<0.05,**P<0.01vs. NC组。
2.5血管环和肾脏的形态学观察HE染色结果显示,NC组肾小体形态结构正常,肾脏小血管未见病变;主动脉内皮细胞形态均匀扁平,呈紧密排列,中膜层细胞排列整齐规则,血管壁厚度均匀;SH组和2K1C组出现肾小体萎缩,肾脏组织结构中的小动脉出现玻璃样变性,主动脉内膜损伤,血管壁增厚且细胞形态改变(见图6、7)。

A.NC组,B.SH组,C.2K1C组。
图6大鼠肾脏形态学改变(HE染色×400)
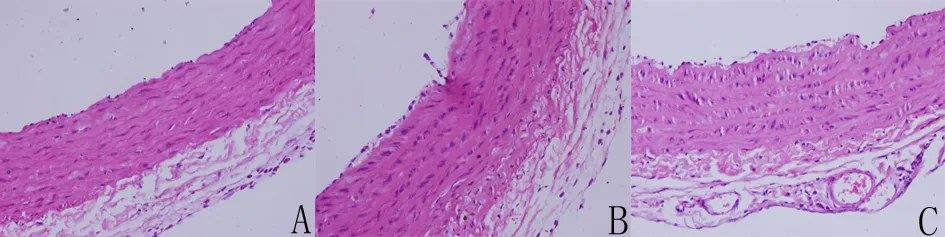
A.NC组,B.SH组,C.2K1C组。
图7大鼠胸主动脉环形态学改变(HE染色×400)
3 讨论
遗传、环境及其他因素均可导致高血压的发生,其产生机制复杂,在众多环境因素中,高盐是高血压发病的主要环境因素之一,在高血压病的发生发展中起重要作用,其致病机制尚不十分明晰,为了进一步明确高盐诱导高血压的产生机制,我们通过复制高盐诱导高血压大鼠模型,同时与两肾一夹法诱导高血压大鼠模型相比较,通过无创法测定大鼠尾动脉收缩压,以判断造模是否成功。
大鼠尾动脉收缩压测定结果显示,与NC组相比,2K1C组大鼠手术第4天开始,血压明显升高(P<0.05);而SH组大鼠在给予4%NaCl饲料喂养第16天开始血压明显升高,差异有统计学意义(P<0.05或P<0.01);表明通过两种方法均成功复制大鼠高血压模型。在此基础上,通过血管环功能实验和生化指标检测探讨其可能产生机制。血管环功能实验结果显示,与NC组相比,Phe浓度在10-7~10-5mol/L时,SH组和2K1C组胸主动脉环收缩率随Phe浓度增加显著升高(P<0.05);在 Phe(10-6mol/L)预收缩的基础上,ACh浓度为10-6mol/L与10-5mol/L时,SH组和2K1C组胸主动脉环舒张率随ACh浓度增加显著下降(P<0.05);在Phe(10-6mol/L)预收缩的基础上,SNP对动脉环的舒张率差异无统计学意义(P>0.05)。ACh和SNP均为舒张血管药物,前者具有内皮依赖性,后者通过释放外源性NO舒张血管,结果表明通过两种方法复制的高血压模型大鼠主动脉内皮损伤可能是其机制之一。有研究证实了高盐引起血管主动脉内皮细胞损伤的主要分子机制是盐负荷刺激的氧化应激[7],从细胞分子水平证实了我们的结论。
通过大鼠胸主动脉环匀浆iNOS活性和NO含量测定,结果显示,与NC组相比,SH组和2K1C组iNOS活性明显升高(P>0.05),NO含量明显下降(P>0.05),NO和一氧化氮合酶(NOS)与血管舒张有关,NOS有神经型(nNOS)、内皮型(eNOS)和诱导型(iNOS)3种。已有文献表明,在原发性高血压大鼠动脉血管匀浆中iNOS活性增加,NO含量下降[8-9]。盐敏感高血压大鼠有炎症反应[10],产生大量iNOS,损伤内皮并降低NO的生物利用度,同时抑制eNOS产生NO,破坏内皮的舒张功能[11-13]。提示内皮损伤可能是造成血管舒张功能下降,引起血压升高的机制,推测iNOS的过表达造成了血管内皮损伤。
大鼠胸主动脉环和肾脏HE染色结果显示,与NC组相比,SH组和2K1C组大鼠血管壁增厚,平滑肌细胞排列紊乱,肾细小动脉出现玻璃样变,这些均从形态学进一步说明高血压模型成功,且造模方法改变了血管结构。
临床大部分高血压患者早期肾脏、血管等靶器官无病变,功能障碍较早出现,这种状态持续较久才造成靶器官损伤。肾性高血压模型经过改良,仍然无法避免严重肾脏损伤,模型有局限性,死亡率较高;高盐饮食诱导高血压大鼠模型,血压升高伴轻微肾损伤,与临床高血压患者病变进程接近。
综上所述,高盐饮食诱导和两肾一夹法均能成功复制高血压模型,内皮损伤可能是其机制之一,高盐饮食诱导高血压大鼠模型是一种更符合临床高血压病的模型,该模型简便易行,动物死亡率低,是复制大鼠高血压模型的优先选择。
[1]张琪,谭颖颖.脑内活性氧抑制对醋酸去氧皮质酮-盐型高血压大鼠交感神经活动的影响[J].南方医科大学学报,2014,34(11):1632-1636.
[2]EVANS LC,IVY JR,WYRWOLL C,etal.Conditional deletion of Hsd11b2 in the brain causes salt appetite and hypertension[J].Circulation,2016,133(14):1360-1370.
[3]唐亮亮.血管内皮TRPP2/TRPV4通道复合体参与调节盐敏感性高血压大鼠血管内皮功能[J].中国病理生理杂志,2015,10:1814.
[4]FANGCHAO LIU,JIANG HE,DONGFENG GU,etal.Associations of endothelial system genes with blood pressure changes and hypertension incidence:the gensalt study [J].American Journal of Hypertension,2015,28(6):780-788.
[5]张玉青,金芃芃,郭益民,等.高盐饮食对大鼠离体胸主动脉环收缩功能的影响及其机制[J].温州医学院学报,2007,37(6):537-539.
[6]王文靖,潘毅,杨涛.两肾一夹型高血压大鼠模型的改良及评价[J].中国实验方剂学杂志,2012,18(1):203-205.
[7]张玉婕,朱男,张效林,等.高盐激活氧化应激-p38丝裂原活化蛋白激酶肌动蛋白骨架重组诱导血管内皮细胞损伤[J].中华高血压杂志,2014,22(8):742-748.
[8]金海燕,钟久昌,宋蓓,等.替米沙坦对高血压大鼠血管ACE2表达及氧化应激水平的影响[J].中国药理学通报,2012,28(1):54-58.
[9]闫莉,谭晓秋,陈文轩,等.自发性高血压大鼠血管对α1肾上腺素受体自身抗体的血管收缩作用敏感性增强[J].中国科学,2014,44(6):562-570.
[10] 刘时彦,黄为民,张润慧,等.盐敏感性高血压大鼠炎症因子和内皮损伤因子的表达[J].中国动脉硬化杂志,2015,23(8):779-783.
[11] 赵锦燕,林久茂,庄群川,等.芎芍胶囊对人脐静脉内皮细胞NO、iNOS和eNOS表达的影响[J].癌变.畸形.突变,2009,21 (6):460-462,481.
[12] HONG-JYE HONG,SHIH-HURNG LOH,MAO-HSIUNG YEN.Suppression of the development of hypertension by the inhibitor of inducible nitric oxide synthase[J].British Journal of Pharmacology,2000,131(3):631-637.
[13] OLIVEIRA-PAULA GH,LACCHINI R,COELI-LACCHINI FB,etal.Inducible nitric oxide synthase haplotype associated with hypertension and responsiveness to antihypertensive drug therapy[J].Gene,2013,515(2):391-395.
Comparison of the hypertensive rat models induced by high salt diet and two-kidney one-clip method
SHINa,WANGZhuqing,WANGHaizhen,WANGJing,ZHOUPingping,JIANGYuxin,WANGHaihua
Department of Physiology,Wannan Medical College,Wuhu241002,China
Objective:To compare the hypertensive rat models induced by either high salt diet or two-kidney one-clip(2K1C) technique,and preminarily investigate the posssible mechanisms in duplicating such animal models.Methods:Eighteen male SD rats were randomized into normal control group(NC group),2K1C group and high salt diet induced group(SH group)(n=6 for each group).Duplicating of the hypertensive rat models was performed by 2K1C technique for 2K1C group,feeding with 4%NaCl for SH group,and conventional feeding for NC group.The body weight and blood pressure were daily measured in the same time point for the three groups for consecutive 4 weeks.After successful modeling,biological signal processing system was used to measure the tension of aortic annuli,and HE staining was performed to examine the morphological changes of kidney and aortic rings in rats in the three groups.Besides,inducible nitric oxide synthase (iNOS) activity and nitric oxide(NO) content in aortic annulus homogenates were determined.Results:Compared to NC group,the systolic blood pressure of SH group and 2K1C group were significantly increased(P<0.05),yet the body weight showed no significant difference(P>0.05).The tension rate of SH group and 2K1C group was much more increased with phenylephrine(Phe)intervention (P<0.05),yet decreased with acetylcholine (ACh) (P<0.05 orP<0.01),and sodium nitroprusside(SNP) treatment caused no significant variation(P>0.05).HE staining indicated atrophied renal corpuscle,hyaline degeneration in the small arteries of renal tissue structure,damaged aortic intima and thickened middle membrane layer with cellular derangement as well as significantly increased iNOS activity of aortic annulus homogenates in rats of SH group and 2K1C group (P<0.01),yet NO content were significantly decreased(P<0.05).Conclusion:Both high salt diet and 2K1C may be used for duplicating the hypertensive rat models.Successful establishment of such rat models may be associated with endothelial damage.However,high salt diet induction can be prioritized,for such technique appears simpler and safer in performance,with lower death rate.Importantly,such model may be clinical analogue of human hypertension.
hypertension;high salt diet;two-kidney one-clip method
1002-0217(2016)05-0418-05
安徽省高校省级自然科学研究重点项目(KJ2016A729,KJ2013A251);国家级大学生创新创业训练计划项目(201510368009)
2016-07-10
史娜(1989-),女,2014级硕士研究生,(电话)18895300289,(电子信箱)yiwanbuer@126.com;
.1
A
10.3969/j.issn.1002-0217.2016.05.003
王海华,男,副教授,(电子信箱)wanghaihua9972@sina.com,通信作者.

