间充质干细胞条件培养基治疗肝氧化应激损伤中部分miRNA的变化*
徐雪晶, 李 栋, 李 雪, 鞠秀丽△
(1山东大学深圳研究院,广东 深圳 518057; 2山东大学齐鲁医院儿科,山东 济南 250012)
间充质干细胞条件培养基治疗肝氧化应激损伤中部分miRNA的变化*
徐雪晶1, 李 栋2, 李 雪2, 鞠秀丽2△
(1山东大学深圳研究院,广东 深圳 518057;2山东大学齐鲁医院儿科,山东 济南 250012)
目的: 研究采用人脐带间充质干细胞条件培养基(MSC-CM)治疗肝细胞氧化应激损伤中微小RNA(miRNA)的差异性表达并探讨其调控机制。方法: 制备人正常肝细胞株L02氧化应激损伤模型,体外分离培养健康人脐带间充质干细胞并制备MSC-CM。损伤模型经MSC-CM治疗,用凋亡、细胞活力、细胞周期及线粒体膜电位等实验验证其治疗效果。定量RT-qPCR筛选差异性表达miRNA。应用生物信息学预测其靶蛋白后使用Western blot实验验证。结果:MSC-CM 治疗可以显著减少H2O2氧化应激损伤所致的细胞凋亡比率,增加细胞活力,调节细胞周期。经RT-qPCR筛选出显著差异表达的miR-143、miR-145、miR-301a与let-7a,均在损伤后表达升高,而在MSC-CM作用后表达降低。Western blot实验结果显示miR-143的预测靶蛋白HK2和ADRB1的表达在肝细胞损伤后降低,MSC-CM作用后升高,与miR-143调控趋势一致。结论:MSC-CM治疗可能通过调节相关miRNA及其靶蛋白逆转H2O2所致肝细胞氧化应激损伤。
肝细胞; 氧化应激损伤; 间充质干细胞; 微小RNA
肝细胞氧化应激损伤是肝脏疾病中常见的病理生理过程,常规治疗手段为药物干预,疗效欠佳,如何预防和修复肝细胞氧化应激损伤是亟需解决的问题。间充质干细胞(mesenchymal stem cells,MSC)为肝细胞氧化应激损伤的防治提供了一个新的治疗策略。MSC的作用机制与其旁分泌某些化学物质密切相关,如HGF、 IGF-1、 EGF、VEGF、 bFGF与TGF-β等。研究证实MSC通过改变微小RNA(microRNA, miRNA)的表达进而参与氧化应激损伤细胞的修复[1-2]。miRNA与氧化应激损伤修复的发生、发展、临床表现和预后有密切联系[3]。基于本实验室前期[4]就MSC对肝硬化大鼠治疗机制所行miRNA微阵列基因芯片的杂交分析结果筛选了21种显著差异性表达的miRNA,用RT-qPCR验证并筛选出高敏感性高特异性、差异表达显著的4种miRNA(miR-143、miR-145、miR-301a与let-7a)。本文研究了间充质干细胞条件培养基(mesenchymal stem cell-conditioned medium,MSC-CM)在修复肝细胞氧化应激损伤过程中,miR-143、miR-145、miR-301a与let-7a及其潜在靶基因表达的变化,并探讨了miRNA在肝脏氧化应激损伤中可能的调控机制。
材 料 和 方 法
1 主要试剂
αMEM培养基、1640培养基均购自HyClone;胎牛血清为Gibco产品;凋亡检测Annexin V/碘化丙啶(propidium iodide,PI)试剂盒、线粒体膜电位JC-1检测试剂盒购自BD;CCK-8检测试剂盒购自Dojindo;细胞周期测定PI检测试剂盒购自康为公司;miRNA提取试剂盒、miRNA逆转录试剂盒和SYBR Green荧光定量试剂盒购自北京天根生化科技公司,其中21种miRNA引物和内参U6由该公司合成;抗人GAPDH、HK2、DAB2、NR2C2、ESR2、Bax和Bcl-2的抗体与 II 抗购自Proteintech;抗人ADRB1和BMF的抗体购自Abcam。
2 主要方法
2.1 脐带MSC的分离、培养与条件培养基的制备 足月正常分娩的脐带取自山东大学齐鲁医院妇产科(产妇均知情同意)。脐带MSC的分离、培养、鉴定[4]与条件培养基的制备参见本实验室已发表的论文[5]。
2.2 肝细胞氧化应激损伤模型的制备与实验分组 人正常肝细胞株L02(山东大学齐鲁医院低温医学实验室保存)经1 mmol/L H2O2作用3 h建立氧化应激损伤细胞模型[5],换置20% MSC-CM继续培养6 h、24 h和48 h[5]。实验分为对照组(control)、H2O2组和H2O2+ MSC-CM组。利用酶标仪测定450 nm处吸光度(A)值,计算MSC-CM作用后各个时点对受氧化应激损伤肝细胞的细胞活力的影响,选择合适的时点用于后续实验。H2O2与H2O2+ MSC-CM组参考本实验室前期研究[5],为保证结果的准确性,所有实验重复5次以上。
2.3 凋亡的定量测定 收集3组细胞,预冷无菌PBS冲洗,1 000 ×g离心5 min,计数并用1×binding buffer调整细胞密度为1 × 109/L,取100 μL,加入5 μL Annexin V、5 μL PI,混匀,室温避光孵育15 min,加200 μL 1×binding buffer混匀,使用流式细胞仪检测细胞凋亡比例。
2.4 细胞周期的测定 收集105~106个细胞,预冷PBS冲洗2遍,95%乙醇固定过夜,1 000×g离心5 min,弃上清,用PBS冲洗2遍后加入400 μL PI染色液,37 ℃避光温浴30 min。流式细胞术检测细胞周期分布情况,应用Incyte软件分析数据。
2.5 线粒体膜电位(mitochondrial membrane potential,MMP)的测定 收集105~106个细胞,PBS冲洗2遍,加入500 μL JC-1工作液,37 ℃避光孵育15 min,1 000×g离心5 min,加入1×assay buffer 2 mL洗涤2次,离心弃上清,加入500 μL 1×assay buffer 重悬,使用流式细胞仪检测细胞去极化比例。
细胞凋亡、周期与MMP测定均采用Guava EasyCyte 8HT流式细胞仪(Millipore)与Guava Incyte V 2.6(Millipore)软件分析。2.6 细胞活力的测定 取对数生长期的L02细胞以每孔5 × 103细胞接种于96孔板,1 mmol/L H2O2作用3 h后,加入MSC-CM 作用24 h(根据CCK-8实验结果选取),每孔(设置3个复孔)分别加10 μL CCK-8试剂,37 ℃孵育2 h。酶标仪测定各实验组肝细胞在波长为450 nm 处的A值,利用各时刻生长抑制率研究MSC-CM对肝细胞氧化应激损伤的修复程度。
2.7 miRNA的提取和RT-qPCR 富集miRNA提取按miRNA提取试剂盒说明书操作。基于本实验室前期MSC对肝硬化大鼠模型拯救机制的miRNA微阵列基因芯片杂交分析结果筛选了21种显著差异性表达的miRNA,用RT-qPCR验证筛选高敏感性高特异性的miRNA。0.25 μg的富集miRNA加入20 μL miRNA逆转录体系[采用miRNA 3’ 末端加多聚A尾ploy(A),使用Oligo(dT)-universal tag通用逆转录引物进行逆转录反应,最终生成miRNA对应的cDNA第一链]。cDNA在ABI 7500荧光定量PCR仪上进行SYBR Green荧光定量PCR检测(试剂盒提供通用下游引物)。引物设计参考miRBase。实验设3个复孔,软件分析其Ct值,以U6作为内参照,由公式2-ΔΔCt计算miRNA在氧化应激损伤与MSC-CM拯救过程中的相对表达量。
2.8 miRNA靶基因的生物信息学预测 采用miRBase(http://www.mirbase.org/)、 TargetScan(http://www.targetscan.org/)和 PubMed(http://www.ncbi.nlm.nih.gov/pubmed/)3个在线分析软件预测miRNA的靶基因。
2.9 Western blot法验证靶基因与凋亡相关蛋白的表达 收集3组L02细胞,提取总蛋白,根据内参照GAPDH定量结果对各蛋白样本上样量校正定量。通过SDS-PAGE进行检测。本操作对MSC-CM逆转肝细胞氧化应激损伤过程中定量验证miRNA下游靶基因和凋亡相关蛋白Bcl-2、Bax、 BMF的变化,所有实验重复5次以上。
3 统计学处理
采用SPSS 20.0统计学软件分析,计量资料以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Tukey检验,以P<0.05为差异有统计学意义。数据制图采用Graphpad Prism6软件。
结 果
1 MSC-CM对肝细胞氧化应激损伤致凋亡的影响
1.1 Annexin V/PI双染实验结果 对照组、H2O2组和H2O2+ MSC-CM组的凋亡率分别为11.04%±0.48%、31.60%±1.07%和15.58%±0.55%;活细胞比例分别为82.87%±3.01%、65.69%±2.91%和82.00%±3.11%;与H2O2组相比, MSC-CM能减少H2O2诱导的细胞凋亡,增加活细胞比例,上述差异有统计学显著性(P<0.05),见图1A。
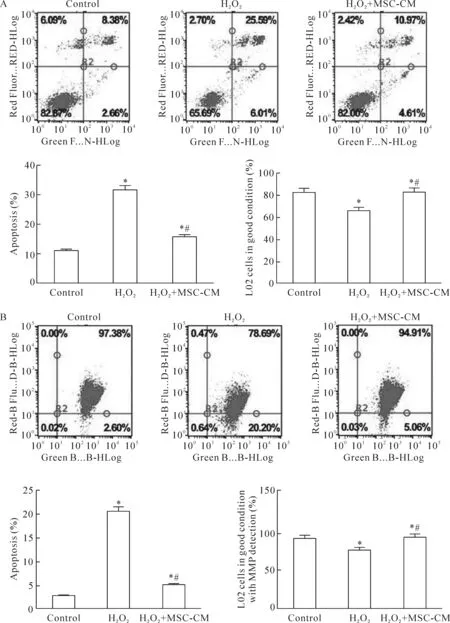
Figure 1.MSC-CM reduced the apoptosis of L02 cells with oxidative stress injury. A: typical protective effect of MSC-CM on the apoptosis of L02 cells induced by H2O2examined by Annexin V/PI double staining and flow cytometryic analysis; B: MSC-CM protected L02 cells from MMP depolarization observed by JC-1 staining and flow cytometryic analysis. Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsH2O2group.
图1 MSC-CM逆转肝细胞氧化应激损伤所致的细胞凋亡
1.2 肝细胞MMP的变化 JC-1染色示去极化的细胞比例对照组为2.60%±0.12%,H2O2组为20.20%±0.93%,H2O2+ MSC-CM组为5.06%±0.21%。H2O2+ MSC-CM组早期凋亡的比例显著低于H2O2组,上述差异有统计学显著性(P<0.05),见图1B。
1.3 肝细胞凋亡相关蛋白的变化 Western blot实验结果表明,Bcl-2在H2O2处理L02细胞后蛋白表达下调,Bax和BMF蛋白表达上调;MSC-CM作用后,Bcl-2蛋白表达增加,Bax和BMF蛋白表达下降,差异具有统计学显著性(P<0.05),见图2。
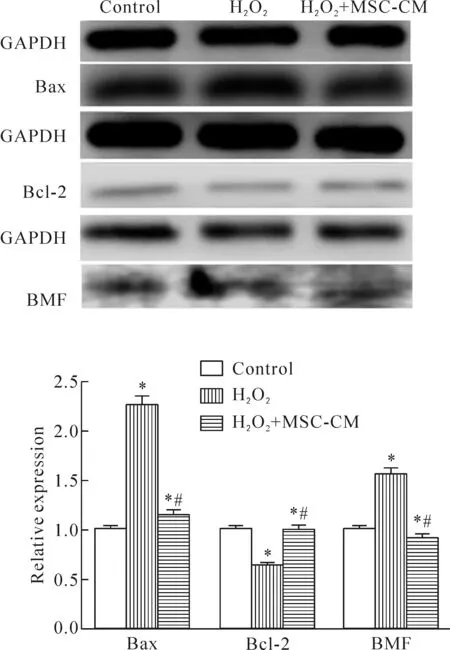
Figure 2.The expression levels of apoptosis-related proteins in the L02 cells detected by Western blot. In H2O2- treated L02 cells, the expression level of Bax and BMF proteins increased, while the expression level of Bcl-2 decreased. In MSC-CM-treated L02 cells, the expression levels of BAX and BMF proteins decreased, while the expression level of Bcl-2 increased. Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsH2O2group.
图2 MSC-CM逆转肝细胞氧化应激损伤中凋亡相关蛋白的表达
2 细胞周期和细胞毒性的检测结果
CCK-8实验结果显示氧化应激损伤降低细胞活力,MSC-CM 作用6 h、24 h和48 h后,细胞活力明显上升,上述差异均具有统计学显著性(P<0.05),见图3。与对照组相比,H2O2组G1期的细胞比例降低,S+G2期升高,而H2O2+ MSC-CM组的上述变化发生逆转(P<0.05),见图4。
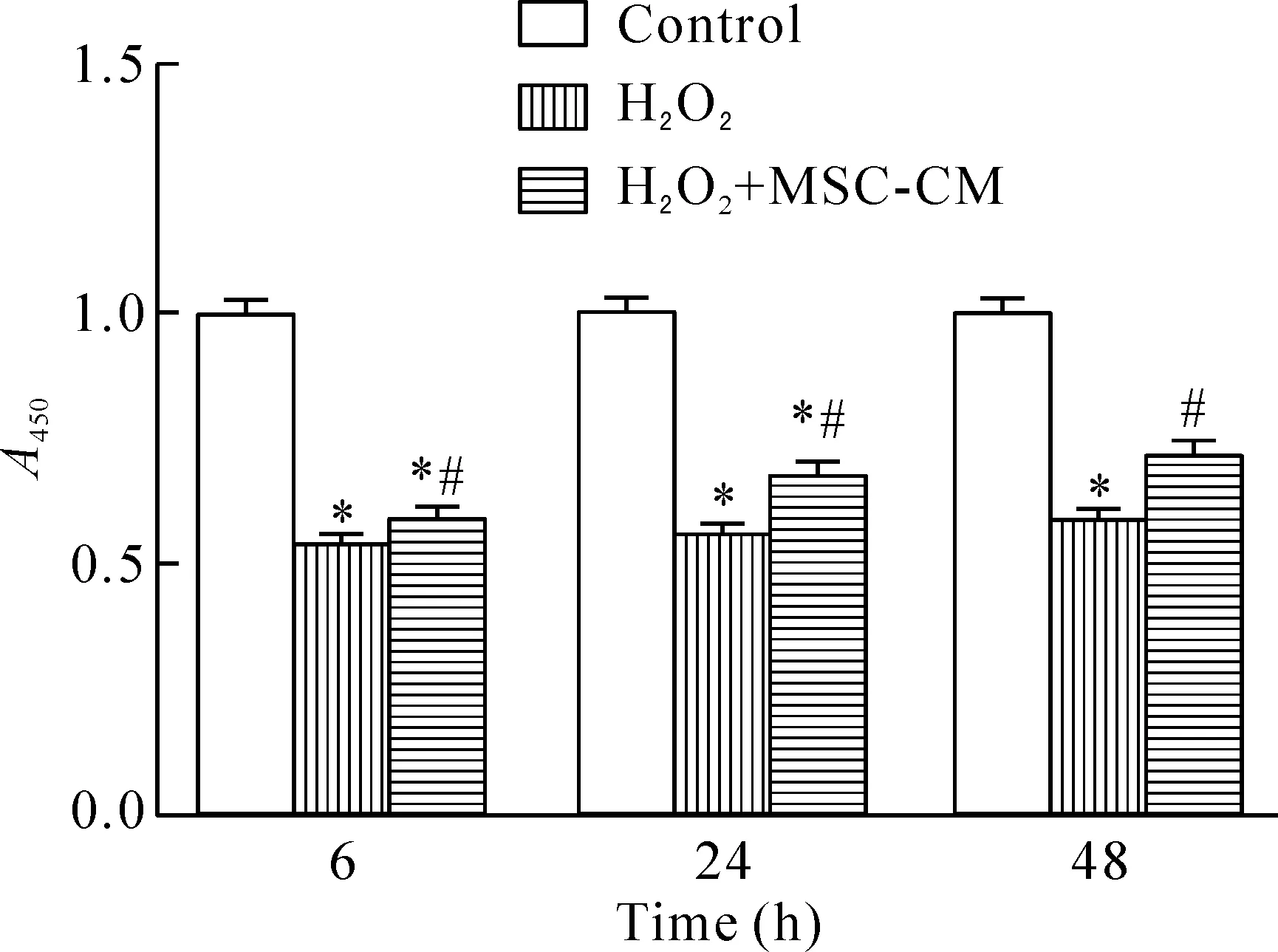
Figure 3.MSC-CM regulated the viability of L02 cells under the condition of oxidative stress injury. Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsH2O2group.
图3 MSC-CM通过提高细胞活性参与氧化应激损伤的肝细胞的修复
3 在H2O2氧化应激损伤与MSC-CM处理过程中miRNA的变化,RT-qPCR的验证与miRNA靶基因的预测
经miRNA微阵列基因芯片分析和 RT-qPCR分析,筛选4种在氧化应激损伤与MSC-CM作用过程中高敏感性、高特异性、有显著差异性表达的miRNA(miR-143、miR-145、miR-301a与let-7a)。上述miRNA在细胞氧化损伤后升高,MSC-CM作用后降低(图5)。生物信息学软件预测miR-143的靶基因为己糖激酶2(hexokinase 2,HK2)和β1-肾上腺素受体(β1-adrenoreceptor,ADRB1),miR-145的靶基因为Disabled homolog 2 (DAB2),miR-301a的靶基因为nuclear receptor subfamily 2 group C member 2(NR2C2),let-7a的靶基因为雌激素受体2(estrogen receptor 2,ESR2)。
4 H2O2氧化应激损伤与MSC-CM处理后肝细胞靶蛋白的变化
Western blot实验检测结果表明,H2O2处理L02细胞后,HK2、ADRB1、DAB2、NR2C2与ESR2的蛋白表达下调;而MSC-CM作用后,上述蛋白表达均增加,差异具有统计学显著性(P<0.05),见图6。
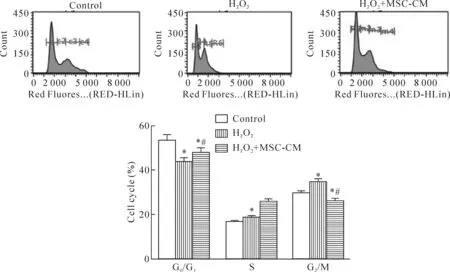
Figure 4.MSC-CM regulated cell cycle of the L02 cells with oxidative stress injury. Mean±SD.n=8.*P<0.05vscontrol group;#P<0.05vsH2O2group.
图4 MSC-CM通过调节细胞周期参与氧化应激损伤肝细胞的修复
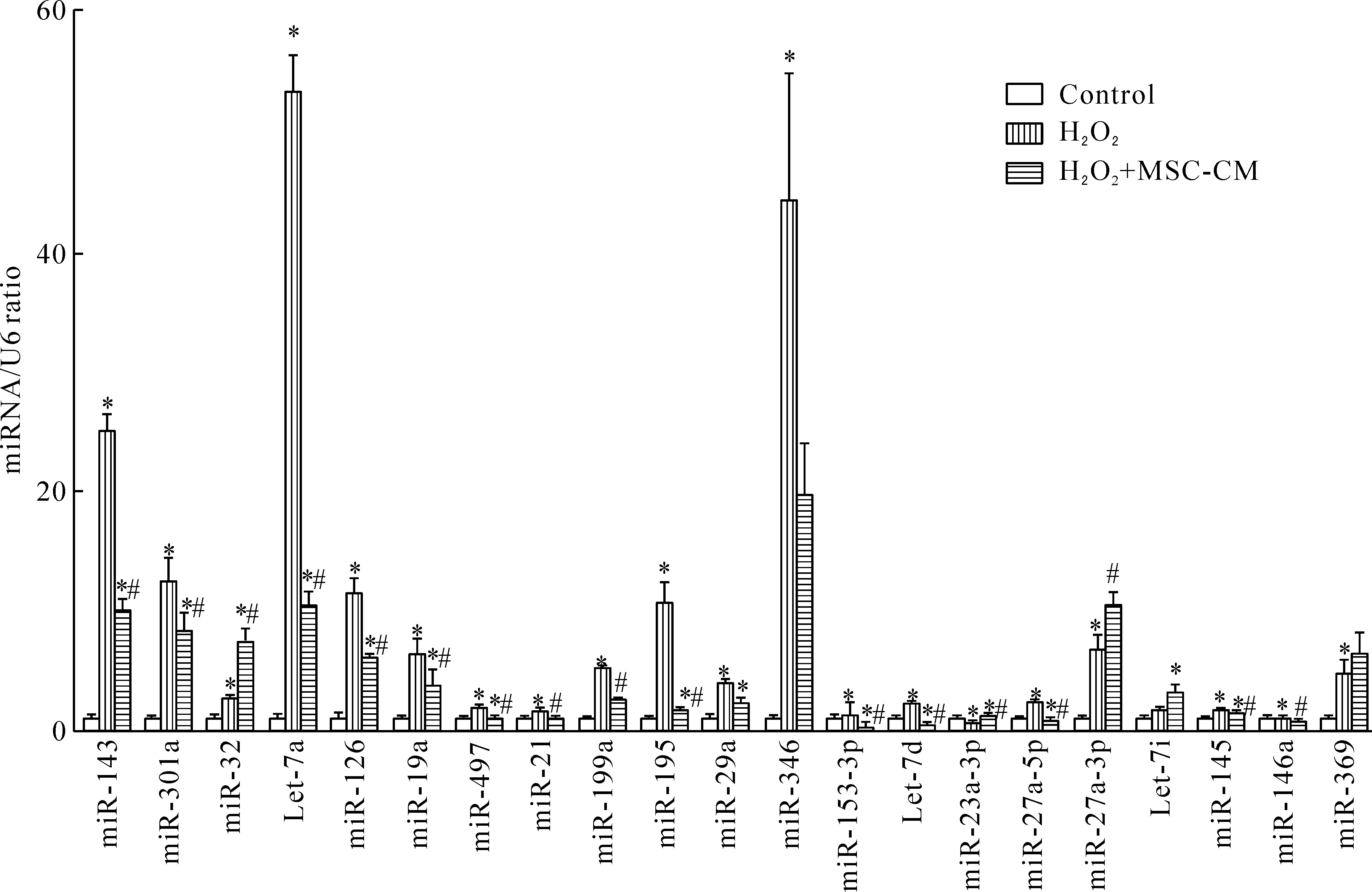
Figure 5.The effects of MSC-CM on the differential expression of miRNAs in the L02 cells with H2O2- induced oxidative stress injury as validated by RT-qPCR. Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsH2O2group.
图5 RT-qPCR验证miRNA在氧化应激损伤与MSC-CM处理过程中的差异性表达
讨 论
间充质干细胞的应用为氧化应激损伤提供了新的治疗策略。MSC通过分泌多种生长因子、细胞因子及其趋化因子调节细胞和组织活性进而参与氧化应激损伤的修复[6-9]。研究证实MSC-CM通过调节miRNA参与H2O2所致的肝细胞氧化应激损伤的修复。miRNA是一类由内源基因编码的约22 nt大小非编码RNA分子, 通过与靶基因mRNA的结合调控其它基因mRNA和蛋白的表达, 参与细胞代谢[10]。本研究发现在氧化应激损伤与MSC-CM修复进程中,miR-143、miR-145、miR-301a与let-7a均呈损伤后升高,MSC-CM作用后降低,差异性表达显著。
miR-143在肿瘤中低表达,研究证实其通过调节靶基因KRAS、c-MYC和EBK5等,抑制细胞增殖, 促进细胞凋亡。HK2是糖酵解途径的第一个限速酶,催化己糖磷酸化,HK2还可拮抗线粒体途径的细胞凋亡。在供氧充足条件下,肝癌细胞比正常肝细胞糖酵解代谢活跃,糖酵解明显增强, 即有氧糖酵解[11]。本研究发现,miR-143可能通过HK2调节氧化应激损伤过程中的细胞代谢,即经H2O2诱导,相关代谢酶活性降低,细胞代谢降低,在供氧充足条件下加入MSC-CM,因富含细胞活性因子[5-8],发生类似肿瘤细胞的有氧糖酵解,促进代谢与氧化应激损伤的修复。β1-肾上腺素受体通过活化蛋白激酶A(protein kinase A,PKA),增强钙调蛋白激酶 II(calmodulin kinase II,CaMKII)和核因子κB(nuclear factor-κB,NF-κB)的表达,增强caspase-8/9的活性,促进脂多糖(lipopolysaccharide,LPS)所致细胞凋亡;ADRB1也可通过调节TNF-α和IL-6的表达,影响细胞炎症的进展[12]。本研究中ADRB1损伤后表达降低,可能与机体自身调节抑制细胞凋亡有关;ADRB1在多巴酚丁胺停用期间抑制骨细胞凋亡[13],本实验中MSC-CM作用后ADRB1表达轻度上升,可能与细胞微环境相关,机制仍需深入探讨。
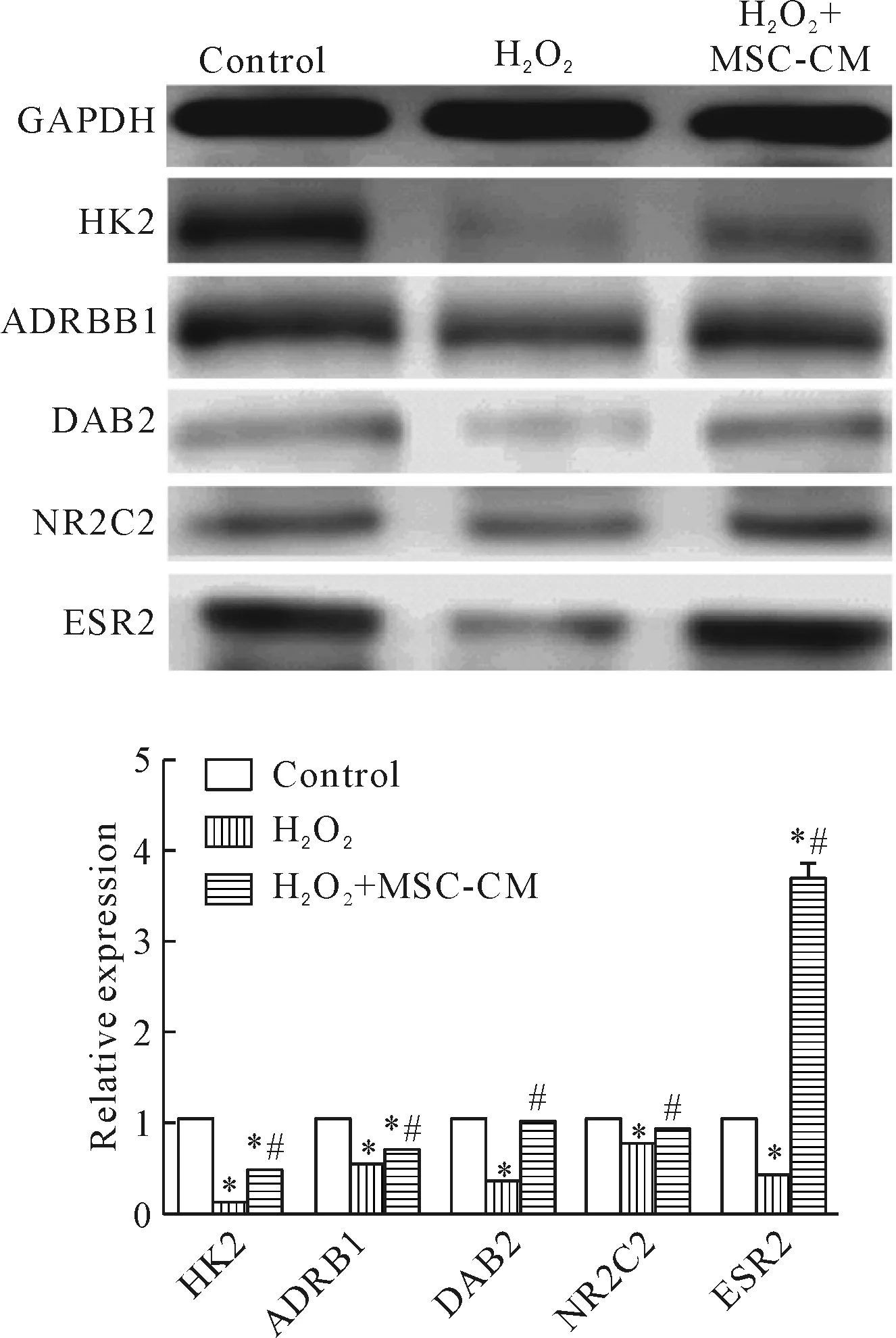
Figure 6.The expression of miRNA target proteins in H2O2- and/or MSC-CM-treated L02 cells detected by Western blot analysis.Mean±SD.n=10.*P<0.05vscontrol group;#P<0.05vsH2O2group.
图6 miRNA在氧化应激损伤与MSC-CM处理过程中相关靶蛋白的变化
NR2C2又称睾丸孤核受体4(testicular orphan nuclear receptor 4,TR4),编码核激素受体家族蛋白,该家族成员参与细胞代谢、分化与体内稳态的调节。Li等[14]指出TR4 作为FOX3a下游途径调节因子参与氧化应激损伤进程。研究指出TR4通过调节转录偶联核苷酸切除修复(transcription-coupled nucleotide excision repair,TC-NER)DNA修复途径保护细胞免受电离辐射所致的氧化应激损伤[15]。Kim等[16]提出TR4 通过调节Bcl-2的表达调控凋亡。本研究发现氧化应激损伤中NR2C2表达降低,MSC-CM作用后表达升高,升高的NR2C2可能通过调节凋亡相关蛋白及其DNA损伤的修复对抗细胞氧化应激损伤。DAB2通过绑定生长因子受体结合蛋白2竞争性结合SOS进而调节生长因子/Ras途径。DAB2参与Wnt 信号通路[17]和促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路[18]。本研究发现H2O2损伤后DAB2表达降低,MSC-CM作用后表达升高。在氧化应激损伤与修复中miR145通过调节DAB2参与上述进程。ESR2编码雌激素受体家族蛋白和核受体超家族转录因子。Kabir等[19]证实ESR通过MEK/ERK/GSK-3β通路诱导缺血/再灌注损伤心肌细胞的修复。本研究经MSC-CM作用后,ESR2的表达显著上升,MSC-CM可能通过上调的ESR2增强氧化应激损伤肝细胞的自我修复。
综上所述,MSC-CM可能通过调节凋亡、周期与相关miRNA等参与肝细胞氧化应激损伤的修复。miR-143通过调控预测靶蛋白HK2、ADRB1,调节糖酵解与炎症因子的活性,参与肝细胞氧化应激损伤的修复。此外,miR-145、miR-301a和let-7a通过调控预测靶蛋白DAB2、NR2C2和ESR2调节FOX3a途径、DNA修复、Wnt信号通路和MAPK等信号通路构建一个复杂的调控网络来调控细胞氧化应激损伤的修复。参与调控网络的其它环节与具体调控机制仍需后续深入研究。
[1] Wen ZZ, Zheng SX, Zhou CQ, et al. Bone marrow mesenchymal stem cells for post-myocardial infarction cardiac repair: microRNAs as novel regulators[J]. J Cell Mol Med, 2012, 16(4):657-671.
[2] Nie Y, Han BM, Liu XB, et al. Identification of micro-RNAs involved in hypoxia- and serum deprivation-induced apoptosis in mesenchymal stem cells[J]. Int J Biol Sci, 2011, 7(6):762-768.
[3] Nallamshetty S, Chan SY, Loscalzo J. Hypoxia: a master regulator of microRNA biogenesis and activity[J]. Free Radic Biol Med, 2013, 64:20-30.
[4] 刘祥忠,邹志强,王贵强,等. 人脐带间充质肝细胞移植肝硬化大鼠肝脏miRNA的差异表达[J]. 中国组织工程研究, 2016, 19(23):3674-3680.
[5] Fu J, Zhang H, Zhuang Y, et al. The role ofN-acetyltransferase 8 in mesenchymal stem cell-based therapy for liver ischemia/reperfusion injury in rats[J]. PLoS One, 2014, 9(7):e103355.
[6] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893):41-49.
[7] Liang X, Ding Y, Zhang Y, et al. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives[J]. Cell Transplant, 2014, 23(9):1045-1059.
[8] Khubutiya MS, Vagabov AV, Temnov AA, et al. Paracrine mechanisms of proliferative, anti-apoptotic and anti-inflammatory effects of mesenchymal stromal cells in models of acute organ injury[J]. Cytotherapy, 2014, 16(5): 579-585.
[9] 李 佳, 辛 毅, 崔 巍, 等. 人脐带间充质干细胞外泌小体保护缺氧复氧损伤的心肌细胞[J]. 中国病理生理杂志, 2016, 32(4):577-583.
[10]Ebert MS, Sharp PA. Roles for microRNAs in conferring robustness to biological processes[J]. Cell, 2012, 149(3):515-524.
[11]Mathupala SP, Ko YH, Pedersen PL. Hexokinase-2 bound to mitochondria: cancer’s stygian link to the “Warburg Effect” and a pivotal target for effective therapy[J]. Semin Cancer Biol, 2009, 19(1):17-24.
[12]Wang Y, Wang Y, Yang D, et al.β1-adrenoceptor stimulation promotes LPS-induced cardiomyocyte apoptosis through activating PKA and enhancing CaMKII and IκBα phosphorylation[J].Crit Care, 2015, 19(76):1-15.
[13]Swift JM, Swift SN, Allen MR, et al. Beta-1 adrenergic agonist treatment mitigates negative changes in cancellous bone microarchitecture and inhibits osteocyte apoptosis during disuse[J]. PLoS One, 2014, 9(9):e106904.
[14]Li GH, Lee YF, Liu S, et al. Oxidative stress stimulates testicular orphan receptor 4 through forkhead transcription factor forkhead box O3a[J]. Endocrinology, 2008, 149(7):3490-3499.
[15]Liu S, Yan SJ, Lee YF, et al. Testicular nuclear receptor 4 (TR4) regulates UV light-induced responses via Coc-kayne syndrome B protein-mediated transcription-coupled DNA repair[J]. J Biol Chem, 2011, 286(44): 38103-38108.
[16]Kim E, Ma WL, Lin DL, et al. TR4 orphan nuclear receptor functions as an apoptosis modulator via regulation of Bcl-2 gene expression[J]. Biochem Biophys Res Commun, 2007, 361(2):323-328.
[17]Cliffe A, Hamada F, Bienz M. A role of dishevelled in relocating axin to the plasma membrane during wingless signaling[J]. Curr Biol, 2003, 13(11): 960-966.
[18]Hocevar BA, Prunier C, Howe PH, et al. Disabled-2(Dab2) mediates transforming growth factor β(TGFβ)-stimulated fibronectin synthesis through TGFβ-activated kinase 1 and activition of the JNK pathway[J]. J Biol Chem, 2005, 280(27):25920-25927.
[19]Kabir ME, Singh H, Lu R, et al. G protein-coupled estrogen receptor 1 mediates acute estrogen-induced cardioprotection via MEK/ERK/GSK-3β pathway after ischemia/reperfusion[J]. PLoS One, 2015, 10(9): e0135988.
(责任编辑: 陈妙玲, 罗 森)
MicroRNA expression in hepatocytes with hydrogen peroxide-induced oxidative stress-injury and alleviating effect of mesenchymal stem cell-conditioned medium
XU Xue-jing1, LI Dong2, LI Xue2, JU Xiu-Li2
(1ShenzhenResearchInstituteofShandongUniversity,Shenzhen518057,China;2DepartmentofPediatrics,QiluHospital,ShandongUniversity,Jinan250012,China.E-mail:shellysdcn@hotmail.com)
AIM: To evaluate the changes of microRNA (miRNA) in hepatocytes during hydrogen peroxide-induced oxidative stress injury, and to observe the alleviating effect of mesenchymal stem cell-conditioned medium (MSC-CM) in this progress. METHODS: The hepatocyte oxidative stress injury model was established using hydrogen peroxide and human normal liver cell line L02. MSC-CM was prepared using centrifugation and filter. The effects of MSC-CM on hepatocyte injury were evaluated by apoptosis analysis, cell viability detection, cell cycle, and mitochondrial membrane potential (MMP). Twenty-one differentially expressed miRNAs were selected by gene chip hybridization, in which miR-143, miR-145, miR-301a and let-7a were confirmed by RT-qPCR. Bioinformatics software was utilized to predict target proteins of these miRNAs, and then the proteins were verified by Western blot.RESULTS: MSC-CM markedly attenuated hydrogen peroxide-induced oxidative stress injury by reducing apoptosis, promoting cell viability and regulating cell cycle. The expression of miR-143, miR-145, miR-301a and let-7a, indentified by RT-qPCR, increased under the condition of oxidative stress injury, while decreased after MSC-CM treatment. The expression of miR-143 predicted target proteins, HK2 and ADRB1, decreased under the hydrogen peroxide-exposure, while increased after MSC-CM treatment, which is consistent with the regulatory trend of miR-143. CONCLUSION: MSC-CM might attenuate hydrogen peroxide induced oxidative stress injury via inhibiting apoptosis and regulating some miRNA expression.
Hepatocyte; Oxidative stress injury; Mesenchymal stem cells; MicroRNA
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1670- 07
2016- 04- 25
2016- 06- 27
深圳市科技研发基金知识创新计划(No.JCYJ20140418115449178);山东省科技发展计划(No.2014GSF118131&2013GSF11812);山东大学基本科研业务费资助项目(No.2014QLKY02&2014QY003-11)
△通讯作者 Tel: 0531-82169214; E-mail: shellysdcn@hotmail.com
R363
A
10.3969/j.issn.1000- 4718.2016.09.023

