Shp2在肺腺癌细胞A549中的抑癌作用及机制研究*
陆志伟, 程玉生, 赵春阳, 王寒黎
(皖南医学院第一附属医院呼吸内科,安徽 芜湖 241001)
Shp2在肺腺癌细胞A549中的抑癌作用及机制研究*
陆志伟, 程玉生△, 赵春阳, 王寒黎
(皖南医学院第一附属医院呼吸内科,安徽 芜湖 241001)
目的: 探索Shp2在肺腺癌细胞A549中的抑癌作用及机制。方法: 应用CCK-8及EdU实验检测Shp2特异性抑制剂Phps-1抑制Shp2活性对A549细胞活力、增殖及对顺铂(DDP)耐药情况的影响,Annexin V-FITC/PI双染法检测细胞凋亡率,Western blot法检测caspase-3的17 kD片段(caspase-3-17p)、Bcl-2、Bax、p-STAT3/STAT3及p-ERK/ERK的蛋白水平。结果: Phps-1浓度为20 μmol/L、作用24 h对A549细胞活力的促进作用显著,与对照组比较具有显著性统计学差异(P<0.05)。Phps-1 20 μmol/L组的细胞增殖率为0.455±0.085,对照组为0.307±0.012。DDP 8 mg/L组及Phps-1 20 μmol/L联合DDP 8 mg/L组的细胞凋亡率分别为13.01%±2.62%和3.67%±0.93%(P<0.05)。抑制Shp2活性能够下调DDP诱导的促凋亡蛋白caspase-3-17p及Bax的蛋白水平,并上调p-STAT3及下调p-ERK蛋白水平。结论: Shp2在肺腺癌细胞A549中具有抑癌作用,抑制STAT3信号通路激活可能是Shp2发挥抑癌作用的重要分子机制。
Shp2; 肺癌; 细胞凋亡
蛋白酪氨酸磷酸酶Shp2(Src homology-2 domain-containing phosphatase 2)是非受体型蛋白酪氨酸磷酸酶(non-receptor protein tyrosine phosphatase,nRPTP)家族成员之一,由PTPN11基因编码,是一种广泛分布于机体细胞的磷酸酶,与蛋白激酶共同调控靶蛋白磷酸化水平,对细胞增殖、分化、凋亡及组织器官的发育发挥重要的调控作用[1]。目前研究发现Shp2与机体多种肿瘤的发生、发展密切相关,如血液系统恶性肿瘤[2]、乳腺癌[3]、肝癌[4-5]及胰腺癌[6]等。Shp2常被认为在肿瘤中发挥促癌作用,其蛋白水平高则提示肿瘤细胞早期发生远处转移及预后差,然而Shp2在肝癌细胞中却扮演“双重”角色,既可以发挥促癌作用,亦可发挥抑癌作用,其作用的发挥具有组织特异性[7]。Shp2在肺癌的发生、发展过程中被认为具有促癌作用[8-10]。然而,Shp2在肺癌细胞中是否具有抑癌作用目前尚未明了。本研究中我们将探讨Shp2在肺腺癌A549细胞的抑癌作用及相关分子机制。
材 料 和 方 法
1 细胞
人肺腺癌细胞株A549购自ATCC,由皖南医学院第一附属医院中心实验室保存。
2 主要试剂
RPMI-1640培养基(Gibco);胎牛血清(杭州四季青);Shp2特异性抑制剂Phps-1、顺铂(cis-diamminedichloroplatinum,DDP)购自Sigma;CCK-8细胞活力检测试剂盒(上海和元生物);EdU检测试剂盒(广州锐博生物); Annexin V-FITC/PI细胞凋亡检测试剂盒(BD);RIPA蛋白裂解液(碧云天公司);蛋白酶抑制剂(Roche);抗caspase-3-17p、p-STAT3/STAT3及p-ERK/ERK抗体(CST);抗Bcl-2及Bax抗体(Santa Cruz);HRP标记的山羊抗小鼠、抗兔II抗(中杉金桥);ECL发光底物(Pierce)。
3 主要方法
3.1 细胞培养 人肺腺癌细胞株A549培养条件为 37 °C、5% CO2、含10%胎牛血清的RPMI-1640培养基,每2~3 d传代 1 次,收集对数生长期细胞用于后续实验。
3.2 CCK-8实验检测细胞活力 收集A549细胞,计数后按照每孔2 000个细胞接种于96孔板,待细胞完全贴壁后,吸除旧培养基,加入含药的完全培养基继续培养,24 h后吸除含药培养基,培养基与CCK-8试剂按10∶1的比例加入,继续培养3 h后在酶标仪上用波长为450 nm读取A值表示细胞活力大小。
3.3 EdU细胞增殖实验 A549细胞计数后按照2×108/L接种于24孔板,待细胞贴壁后,药物干预24 h后加入EdU,继续培养2 h后吸除培养基,加入4%多聚甲醛固定细胞30 min,按照试剂盒操作说明加入染料,使用Hoechst 33342染核30 min,0.01 mol/L PBS液清洗10 min 2次,封片剂封片后于荧光显微镜下每组随机拍摄8个视野,实验重复3次,计数统计。细胞增殖率= EdU阳性细胞数/总细胞数。
3.4 流式细胞术检测细胞凋亡 A549经药物干预24 h后,收集细胞于流式检测试管中,调整细胞密度为1×105个左右,避光条件下依次加入Annexin V-FITC与PI试剂各5 μL孵育20 min后上机检测。
3.5 Western blot检测细胞蛋白水平 药物干预后的A549细胞,吸出培养基,用PBS液洗涤3次,用胰酶或细胞刮收集细胞于10 mL离心管,1 500 r/min、 4 °C离心5 min,弃去上清,加入RIPA裂解液50~80 μL,冰上超声振荡1 min后冰上继续静置30 min,期间间断振荡2~3次。取等量细胞蛋白进行SDS-PAGE后转至PVDF膜,电泳条件为5%浓缩胶恒压70 V,10%分离胶恒压120V,转膜条件为350 mA恒流90 min。转好的PVDF膜用5%的脱脂牛奶,室温下脱色摇床振荡封闭2 h。 I 抗稀释浓度分别为caspase-3-17p(1∶1 000)、p-STAT3(Tyr705)(1∶1 000)/STAT3(1∶1 000)及p-ERK(1∶1 000)/ERK(1∶1 000);Bcl-2(1∶500)及Bax(1∶500) 4 ℃孵育过夜;HRP标记的山羊抗小鼠、抗兔II抗稀释比为1∶5 000。使用Bio-Rad公司扫描仪,Image Lab 4.1软件分析条带。
4 统计学处理
使用实验数据用 SPSS 17.0 软件进行统计分析。所有结果采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA), 用 SNK-q检验进行均数之间的两两比较, 以P<0.05为差异有统计学意义。
结 果
1 抑制Shp2活性可促进A549细胞增殖
不同浓度梯度的Shp2特异性抑制剂Phps-1分别作用于A549细胞24 h,结果显示Phps-1在浓度为20 μmol/L时对A549细胞的活力促进最显著,与对照组比较差异有统计学显著性(P<0.05)。EdU检测A549细胞的增殖结果示Phps-1在浓度为20 μmol/L时的作用效果最显著,增殖率为0.455±0.085,对照组为0.307±0.012,差异有统计学显著性(P<0.05),见图1。
2 抑制Shp2活性促进A549细胞对顺铂发生耐药,减少细胞凋亡
DDP(8 mg/L)组与Phps-1+DDP组两者比较差异有统计显著性(P<0.01),结果提示抑制Shp2活性促进A549细胞对DDP产生耐药现象。正常对照组、Phps-1组、DDP组及Phps-1+DDP组A549细胞24 h的凋亡率分别为1.78%±0.46%、1.53%±0.36%、13.01%±2.62%和3.67%±0.93%。DDP 组与Phps-1+DDP 组之间差异有统计学显著性(P<0.01),见图2。结果提示抑制Shp2活性能够减少顺铂诱导的A549细胞凋亡。
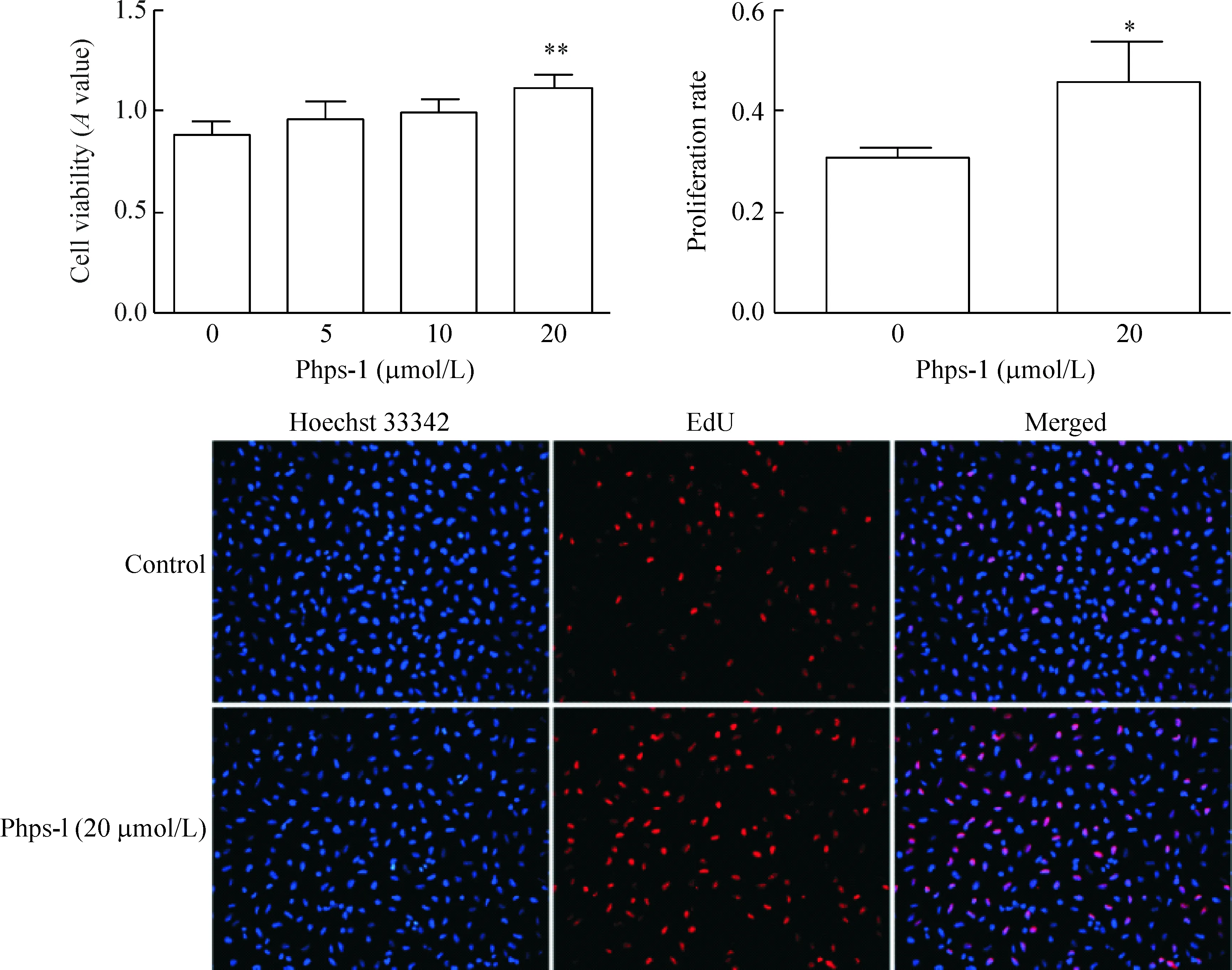
Figure 1. The effects of Phps-1 on viability and proliferation of A549 cells were determined by CCK-8 assay and EdU method after 24 h of treatment. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图1 抑制Shp2活性对A549细胞活力与增殖的影响

Figure 2. Inhibition of Shp2 activity promoted the drug resistance of A549 cells to DDP and decreased the apoptotic rate of A549 cells induced by DDP after 24 h of treatment. Mean±SD.n=3.**P<0.01vscontrol;##P<0.01vsDDP.
图2 Shp2活性抑制促进A549细胞对顺铂耐药,减少顺铂诱导的细胞凋亡
3 各组凋亡相关蛋白水平的变化
Western blot实验结果显示,caspase-3的17 kD裂解片段的蛋白水平在DDP 组上调最明显,而Phps-1+DDP组caspase-3 的17 kD裂解片段的蛋白水平较DDP组明显下调,两组之间差异具有统计学显著性(P<0.05)。DDP组的促凋亡蛋白Bax水平明显上调,而Phps-1+DDP处理组的Bax水平较前者明显下调,两组之间差异有统计学显著性(P<0.05)。此外,抗凋亡蛋白Bcl-2在各组之间差异无统计学显著性,然而Phps-1+DDP处理组的Bax/Bcl-2比值较DDP处理组要低,两者间差异有统计学显著性(P<0.05),见图3。
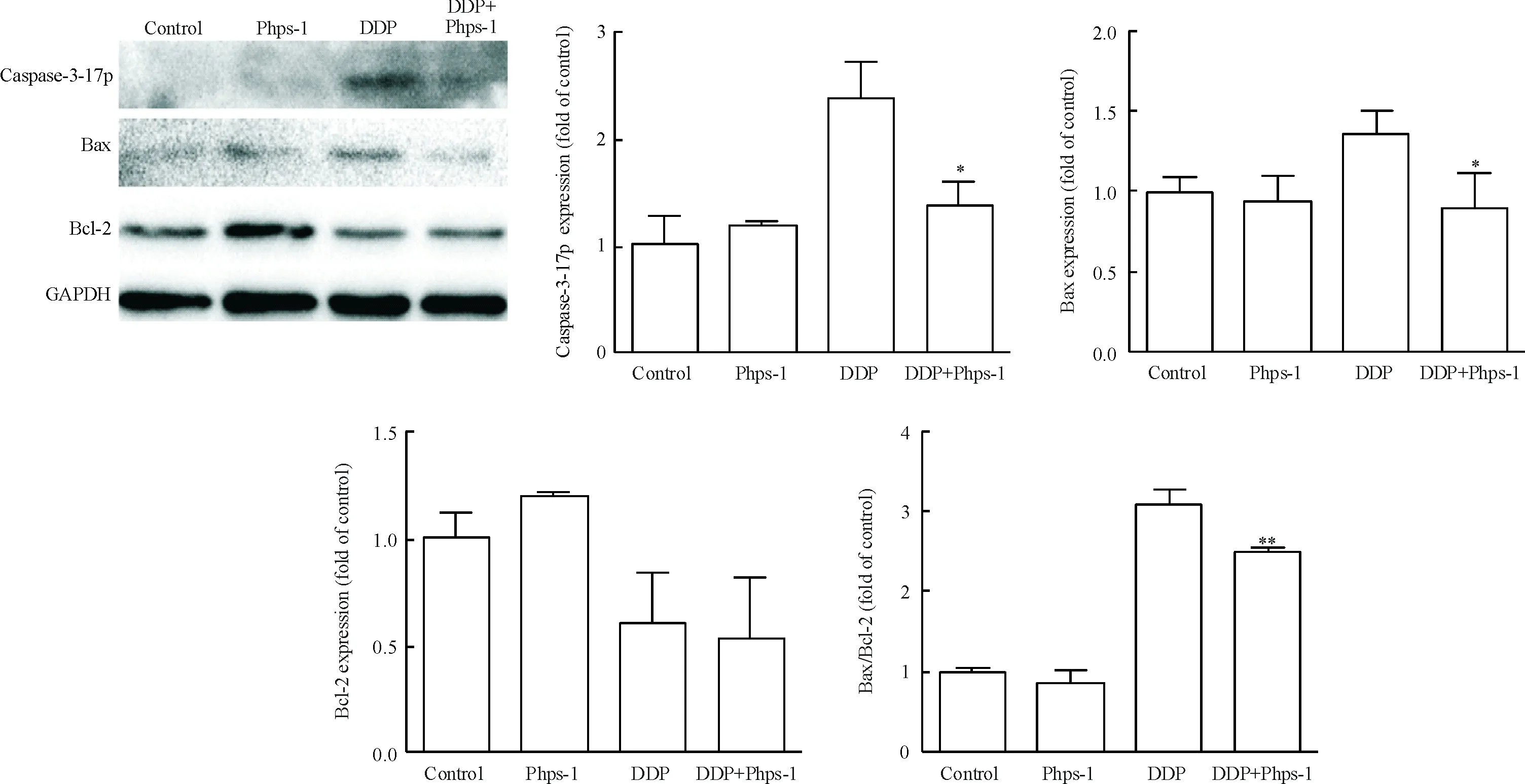
Figure 3. The protein levels of caspase-3-17p, Bax and Bcl-2 in the A549 cells after 24 h of treatment.Mean±SD.n=3.*P<0.05,**P<0.01vscontrol.
图3 Shp2活性抑制对A549细胞caspase-3-17p、Bax和Bcl-2蛋白水平的影响
4 Shp2发挥抑癌作用的可能分子机制
Phps-1 对A549细胞p-ERK蛋白水平的影响呈时间依赖性,在120 min时p-ERK蛋白水平及p-ERK/ERK最低,提示Phps-1对A549细胞Shp2活性的抑制呈时间依赖性。抑制Shp2活性可促进STAT3蛋白的磷酸化水平,提示STAT3信号通路活化可能是Shp2发挥抑癌作用的分子机制之一,见图4。
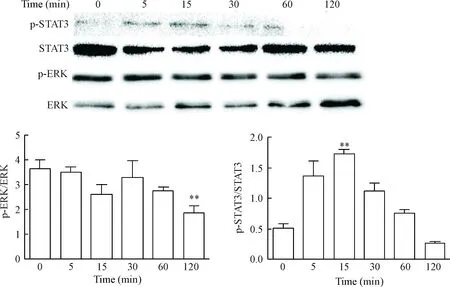
Figure 4.The protein levels of p-STAT3/STAT3 and p-ERK/ERK in the A549 cells treated with Phps-1 (20 μmol/L) at different in-tervals. Mean±SD.n=3.**P<0.01vs0 min.
图4 Phps-1抑制Shp2活性对A549细胞STAT3及 ERK信号通路的影响
讨 论
细胞的正常生长、分化需受到蛋白酪氨酸激酶及磷酸酶的双重调控,两者正常情况下保持平衡,达到稳态。酪氨酸激酶获得性功能突变或过度表达被认为是导致肿瘤发生的重要原因,而酪氨酸磷酸酶则具有相反的作用,常被认为发挥抑癌作用。但Shp2是酪氨酸磷酸酶中比较特殊的一种,它常作为癌症发生信号通路中正调控介质[11]。如目前认为Shp2是生长因子受体(epidermal growth factor receptor,EGFR)信号通路中间关键的正调控介质。获得性突变的EGFR导致肿瘤细胞增殖失控是肺癌发生、发展重要因素之一,抑制Shp2的磷酸酶活性,导致Gab1蛋白磷酸化程度下降,使得EGFR通路信号传导受阻从而抑制肺癌细胞生长[12]。Shp2自身获得性功能突变也可以导致肺癌的发生[8]。对于非小细胞肺癌细胞株LXFA526L,抑制Shp2的活性导致肿瘤细胞增殖减少[13]。因此,Shp2被认为是肺癌发生、发展过程中重要的促癌磷酸酶。
Shp2不仅具有促癌作用,同时也具有抑癌作用。如在二乙基亚硝胺诱导肝癌发生过程中,抑制Shp2可明显促进肿瘤的发生、发展[4]。在肺癌细胞中,Shp2是否具有抑癌作用目前未见研究报道。Phps-1是近年来合成的Shp2特异性抑制剂,对Shp2活化信号通路具有明显抑制作用[14]。我们在本研究发现利用Shp2特异性抑制剂Phps-1抑制Shp2活性,促进肺腺癌细胞A549细胞活性与增殖,减少顺铂诱导的细胞凋亡,下调由顺铂诱导的凋亡蛋白Bax及caspase-3-17p的蛋白水平,提示Shp2在A549细胞中具有抑癌作用。
Shp2在肿瘤中作用的“双面性”与细胞异质性密切相关,在不同细胞类型中发挥的作用截然不同[7]。目前认为Shp2作用的差异取决于Shp2参与的信号通路调控不同。抑制Shp2可以激活IL-6/STAT3信号通路促进肿瘤发生、发展,然而Shp2活性抑制也会抑制Ras/Raf/ERK与PI-3K/AKT/mTOR致癌信号通路活化[5]。此外,ERK信号通路抑制可作为观察Phps-1对Shp2活性抑制的重要指标[14]。本研究中,我们发现在A549细胞中,Phps-1抑制Shp2活性可激活STAT3信号通路,而STAT3信号通路激活对肿瘤细胞发生、进展发挥重要的正调控作用[5],因此我们推测在A549细胞中,Shp2发挥抑癌作用可能与STAT3信号通路有关。
综上所述,Shp2在肺腺癌细胞A549中具有抑癌作用, Shp2抑制STAT3信号通路激活可能是其重要的分子机制。Shp2在肿瘤细胞中的调控机制异常复杂,与肿瘤细胞的异质性密切相关,在未来的研究工作中,我们将探索Shp2在不同类型突变肺癌细胞中的调控机制,为探索肺癌治疗新的靶标奠定新的理论基础。
[1] Zhang J, Zhang F, Niu R. Functions of Shp2 in cancer[J]. J Cell Mol Med, 2015, 19(9):2075-2083.
[2] Chen C, Cao M, Zhu S, et al. Discovery of a novel inhibitor of the protein tyrosine phosphatase Shp2[J]. Sci Rep, 2015, 5:17626.
[3] Matalkah F, Martin E, Zhao H, et al. SHP2 acts both upstream and downstream of multiple receptor tyrosine kinases to promote basal-like and triple-negative breast cancer[J]. Breast Cancer Res, 2016, 18:2.
[4] Bard-Chapeau EA, Li S, Ding J, et al. Ptpn11/Shp2 acts as a tumor suppressor in hepatocellular carcinogenesis[J]. Cancer Cell, 2011, 19(5):629-639.
[5] Han T, Xiang DM, Sun W, et al. PTPN11/Shp2 overexpression enhances liver cancer progression and predicts poor prognosis of patients[J]. J Hepatol, 2015, 63(3):651-660.
[6] Zheng J, Huang S, Huang Y, et al. Expression and prognosis value of SHP2 in patients with pancreatic ductal adenocarcinoma[J]. Tumour Biol, 2016,37(6):7853-7859.
[7] Li S, Hsu DD, Wang H, et al. Dual faces of SH2-containing protein-tyrosine phosphatase Shp2/PTPN11 in tumorigenesis[J]. Front Med, 2012, 6(3):275-279.
[8] Schneeberger VE, Luetteke N, Ren Y, et al. SHP2E76K mutant promotes lung tumorigenesis in transgenic mice[J]. Carcinogenesis, 2014, 35(8):1717-1725.
[9] Xu J, Zeng LF, Shen W, et al. Targeting SHP2 for EGFR inhibitor resistant non-small cell lung carcinoma[J]. Biochem Biophys Res Commun, 2013, 439(4):586-590.
[10] 唐春兰,周向东,杨和平,等. SHP2在非小细胞肺癌中的表达及意义[J]. 中国肺癌杂志, 2010, 13(2):98-101.
[11]Chan G, Kalaitzidis D, Neel BG. The tyrosine phosphatase Shp2 (PTPN11) in cancer[J]. Cancer Metastasis Rev, 2008, 27(2):179-192.
[12]Schneeberger VE, Ren Y, Luetteke N, et al. Inhibition of Shp2 suppresses mutant EGFR-induced lung tumors in transgenic mouse model of lung adenocarcinoma[J]. Oncotarget, 2015, 6(12):6191-6202.
[13]Grosskopf S, Eckert C, Arkona C, et al. Selective inhibitors of the protein tyrosine phosphatase SHP2 block cellular motility and growth of cancer cellsinvitroandinvivo[J]. Chem Med Chem, 2015, 10(5):815-826.
[14]Hellmuth K, Grosskopf S, Lum CT, et al. Specific inhibitors of the protein tyrosine phosphatase Shp2 identified by high-throughput docking[J]. Proc Natl Acad Sci U S A, 2008, 105(20):7275-7280.
(责任编辑: 陈妙玲, 罗 森)
Anticancer function of Shp2 in lung adenocarcinoma A549 cells and rela-ted molecular mechanisms
LU Zhi-wei, CHENG Yu-sheng, ZHAO Chun-yang, WANG Han-li
(DepartmentofRespiratoryMedicine,TheFirstAffiliatedHospitalofWannanMedicalCollege,Wuhu241001,China.E-mail:chengys1222@126.com)
AIM: To explore the anticancer function of Shp2 in lung adenocarcinoma A549 cells and the related molecular mechanisms. METHODS: The viability and proliferation of A549 cells treated with Shp2 specific inhibitor Phps-1 or cisplatin (DDP) were measured by CCK-8 assay and EdU assay. Annexin V-FITC/PI double staining was applied to detect apoptotic rate of A549 cells with different interventions. The protein levels of caspase-3-17p, Bcl-2, Bax, p-STAT3/STAT3 and p-ERK/ERK were determined by Western blot. RESULTS: Compared with control group, Phps-1 at the concentration of 20 μmol/L significantly increased the viability of A549 cells after 24 h of treatment (P<0.05). Meanwhile, the proliferation rate of A549 cells in Phps-1 20 μmol/L group was significant increased compared with control group (P<0.05). The apoptotic rate of A549 cells in DDP treatment group decreased from 13.01%±2.62% to 3.67%±0.93% after adding Phps-1 (P<0.05). Phps-1 down-regulated the protein levels of caspase-3-17p, Bax and p-ERK, but up-regulated p-STAT3. CONCLUSION: Shp2 is a tumor suppressor in A549 cells, which may be associated with the activation of STAT3 signal pathway.
Shp2; Lung cancer; Apoptosis
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1589- 05
2016- 03- 28
2016- 05- 24
皖南医学院引进人才基金资助项目(No. YR201107);皖南医学院中青年基金资助项目(No. WK2014F43)
△通讯作者 Tel: 0553-5739006; E-mail: chengys1222@126.com
R734.2; R730.23
A
10.3969/j.issn.1000- 4718.2016.09.010

