免疫性血小板减少症患者外周血Treg细胞microRNA分析①
曾 艳 韩 红 陈 慧
(华中科技大学同济医学院附属梨园医院,武汉430077)
免疫性血小板减少症患者外周血Treg细胞microRNA分析①
曾艳韩红陈慧
(华中科技大学同济医学院附属梨园医院,武汉430077)
目的:分析ITP患者和健康对照组Treg细胞中miRNA的表达谱的差异,探讨ITP的发病机制。方法:抽取ITP患者组和健康对照组外周静脉血,应用流式细胞仪分选Treg细胞,提取每组患者Treg细胞中的RNA,采用Solexa深度测序法对其miRNA表达谱进行分析。对比ITP组和正常对照组芯片结果,找出差异表达的miRNA,并对其进行富集性分析,找寻异常信号通路。结果:我们筛查到ITP患者组Treg细胞中存在多个miRNA 表达异常,其中有显著差异者为miR-1976, miR-548ae-5p、miR-5096-p3、miR-548am-5p、PC-3p-63471、PC-3p-96627。通过富集性分析发现ErbB和TGF-β两个异常信号通路。结论:ITP患者外周血Treg细胞内miRNA表达谱存在差异表达,这些差异表达的miRNA可能影响了Treg细胞发挥正常的免疫调节功能,是ITP发生的机制之一。
免疫性血小板减少症;Treg细胞;microRNA
原发免疫性血小板减少症(Primary immune thrombocytopenia,ITP)是一种由于机体免疫功能紊乱,导致外周循环血中血小板破坏增加、数量减少的出血性疾病。其发病机制目前尚未完全明确,多数学者认为其主要发生机制是体液免疫异常导致了患者体内产生了针对血小板膜表面糖蛋白的自身抗体。近几年发现细胞免疫异常在ITP发病中也起着重要作用,主要表现在CD4+T细胞亚型漂移,尤其是Th1/Th2及Th17/Treg两对细胞的平衡紊乱[1]。我们通过对比ITP患者和健康对照人群来确定ITP患者外周血Treg细胞中miRNA的表达谱是否发生改变,希望能够为ITP自身免疫异常的发生机制,特别是Treg细胞功能异常的机制提供线索,并揭示miRNA在自身免疫调控中的作用和意义,并为治疗ITP寻找有利的调节免疫应答的靶点。
1 材料与方法
1.1实验材料、试剂红细胞裂解液购自Biolegend公司。流式抗体有PE标记的鼠抗人CD25单抗,FITC标记的鼠抗人CD4单抗(BD PharMingen)。miRNA分析所有试剂如TruSeq Small RNA Sample Prep Kit(Illuminated,San Diego ,USA)试剂盒、RNA质检试剂盒、High Sensitivity DNA Chip Kit(Agilent,CA,USA),均由联川生物技术有限公司提供。流式细胞分析仪(BD FACS AriaMTII),Bioanalyzer 2100(Agilent,CA,USA)。
1.2实验方法
1.2.1研究对象选取2013年5月~2014年8月梨园医院血液科收治的20例初诊成人ITP患者作为病例组(ITP组),年龄15~53岁。正常对照组15人(NC组),为健康成人,年龄19~60岁。每组随机分为3个亚组(ITP1、ITP2、ITP3),其中ITP3组6人,其余两组7人,ITP1、ITP2组各2名男性,ITP3组1名男性;正常对照组(NC组)也随机分为3个亚组(NC1、NC2、NC3),每组5人,女∶男=4∶1。为平衡个体差异,每个亚组内标本混合作为一个样品组,共有六个样品组。每人采集外周静脉血5 ml,EDTA抗凝;诊断依据张之南主编《血液病诊断及疗效标准》(第二版)中ITP的标准。
1.2.2流式抗体标记采得的静脉血,分别加入抗CD4、抗CD25的单抗,室温孵育20~30 min,加入红细胞裂解液,并震荡均匀,室温10 min,洗涤1次后,重新悬浮细胞,通过细胞滤网后放置于冰上,准备进行流式分选。
1.2.3流式细胞分选应用流式细胞仪根据外周血各个成分细胞的大小及颗粒度等特征分群,同时对CD4、CD25抗体标记的细胞进行流式分析,并分离获取。上述分选得到的Treg细胞经1 500 r/min离心5 min后,加入trizol中重悬,置于-80℃冰箱中保存备用。
1.2.4miRNA基因芯片分析提取每个亚组患者Treg细胞的RNA,为平衡个体差异因素对结果的影响,降低结果误差,将同一亚组内提取的RNA混合作为一个样品池,应用Solexa深度测序法对miRNA表达谱对比分析。实验流程按照Illumina公司提供的标准步骤执行,包括制备文库和测序实验。小RNA测序文库制备采用TruSeq Small RNA Sample Prep Kit(Illuminated,San Diego ,USA)试剂盒。样本提取总RNA后,将每个亚组内RNA混合作为一个样品进行下一步实验;应用TruSeq Small RNA Sample Prep Kit试剂盒进行反转录,将总RNA反转录为cDNA,最后进行PCR扩增cDNA序列。140~160 bp碱基长度的PCR产物经过6%polyacrylamide Tris-borate-EDTA胶回收,从而完成整个文库制备工作,构建好的文库用IlluminatedHiseq2000/2500进行测序。操作由联川生物技术有限公司完成。

2 结果
2.1 一般情况比较ITP组和NC组年龄[(31.65±13.05)vs(32.93±12.97),P>0.05]以及各亚组间年龄无明显统计学差异,排除了年龄因素的影响。
2.2 ITP患者与NC组之间的外周血的Treg细胞免疫表型分析ITP患者外周血中CD4+CD25+Treg细胞占CD4+T细胞百分比显著低于NC组[(1.05±0.21)vs(3.4±0.91),P<0.05],差异有统计学意义,见图1、2。
2.3 miRNA芯片结果分析6张芯片共筛查出678个差异性表达的基因,其中268个表达水平上调的基因,410个表达下调的基因。ITP患者的Treg细胞miRNA表达谱与NC组存在明显差异,表明ITP患者的Treg细胞存在特异性miRNA表达谱。
与NC组相比,其中有显著差异者为: ppy-miR-1976、hsa-miR-548ae-5p、hsa-miR-5096-p3、hsa-miR-548am-5p、PC-3p-63471_16、PC-3p-96627。见图3。
对所有差异miRNA的基因功能及信号途径进行富集性分析,表1中列出靶基因主要参与14条KEGG通路条目中,其中代谢途径(Metabolic Pathways)是靶基因的主要参与通路,有22.41%的靶基因参与其通路。而其中可能参与ITP发病机制的信号通路主要是:ErbB signaling pathway和TGF-β signaling pathway。
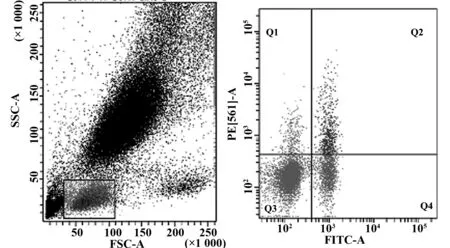
图1 ITP组Treg细胞流式细胞仪分选Fig.1 Treg cells of ITP group by flow cytometry sorting
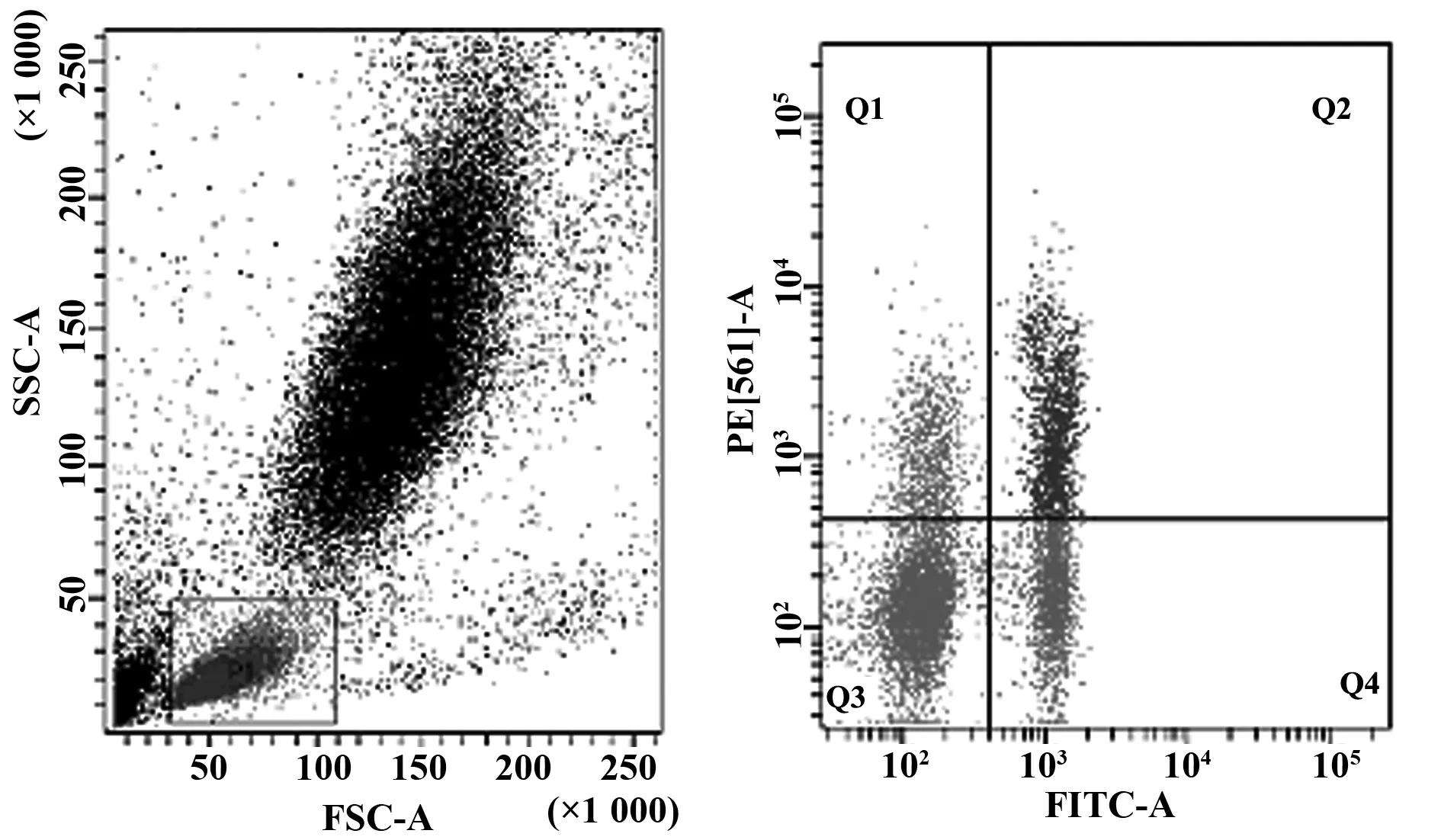
图2 NC组Treg细胞流式细胞仪分选Fig.2 Treg cells of NC group by flow cytometry sorting
表1靶基因主要富集的14个KEGG通路
Tab.1Target genes mainly in 14 KEGG pathways
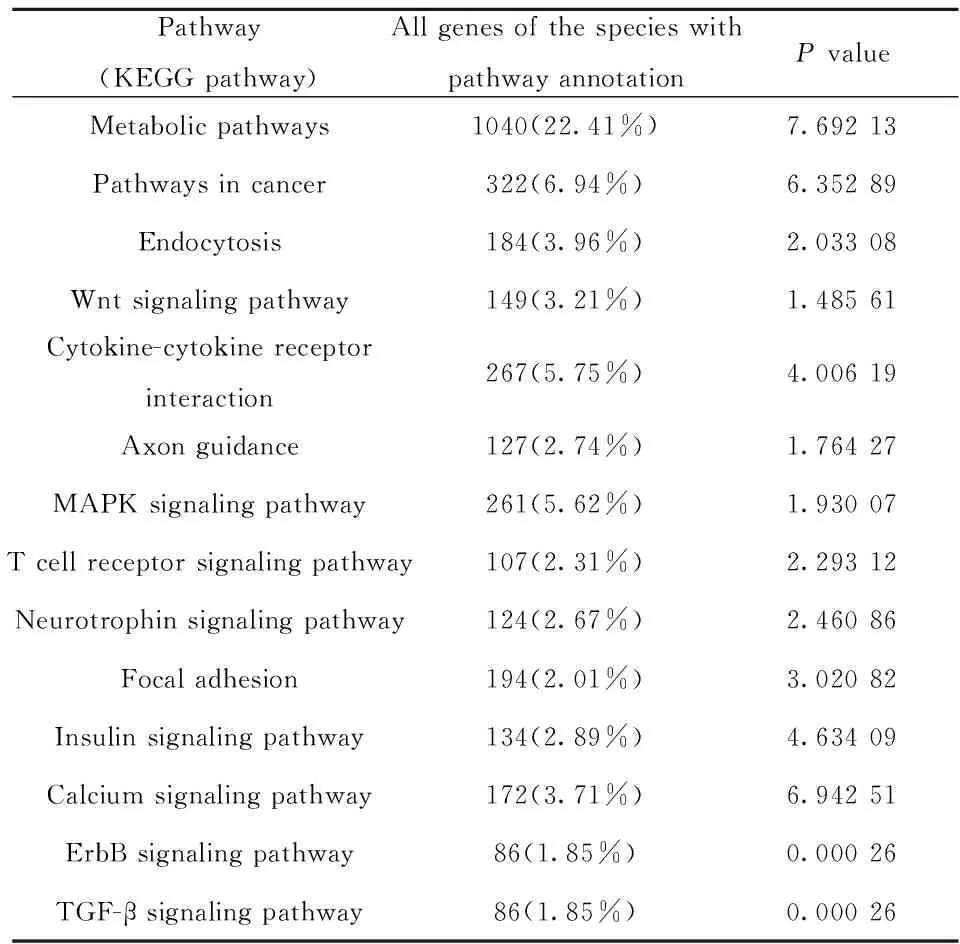
Pathway(KEGGpathway)AllgenesofthespecieswithpathwayannotationPvalueMetabolicpathways1040(22.41%)7.69213Pathwaysincancer322(6.94%)6.35289Endocytosis184(3.96%)2.03308Wntsignalingpathway149(3.21%)1.48561Cytokine-cytokinereceptorinteraction267(5.75%)4.00619Axonguidance127(2.74%)1.76427MAPKsignalingpathway261(5.62%)1.93007Tcellreceptorsignalingpathway107(2.31%)2.29312Neurotrophinsignalingpathway124(2.67%)2.46086Focaladhesion194(2.01%)3.02082Insulinsignalingpathway134(2.89%)4.63409Calciumsignalingpathway172(3.71%)6.94251ErbBsignalingpathway86(1.85%)0.00026TGF-βsignalingpathway86(1.85%)0.00026
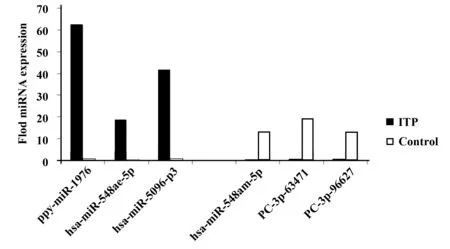
图3 ITP患者Treg细胞内表达有显著差异的miRNAsFig.3 Significant differentially expressed miRNAs within Treg cells in ITP patients
3 讨论
1995年Sakaguchi等[2]首先报道了CD4+CD25+调节细胞(Regulatory T cells,Treg),是一种新型免疫调节细胞,具有免疫无能和免疫抑制两种功能,高表达CD25,主要分泌TGF-β、IL-10等细胞因子,表达特异性转录因子Foxp3,通过抑制自身反应性T细胞的免疫反应,抑制T细胞的活化及促进某些抑制性细胞因子的分泌等在外周免疫耐受的维持中发挥重要作用[3]。既往有文献报道,Treg细胞在自身和外界抗原诱导的外周免疫耐受中发挥重要作用,其数量的减少或功能缺陷可以引起多种自身免疫病(如多发性硬化、类风湿性关节炎、系统性红斑狼疮等)。近年来其在ITP发病机制中的作用也逐渐受到重视。Nishimoto等[4]将去除Treg的CD4+CD25-的BALB/c鼠的脾细胞注射到裸鼠中建立ITP动物模型,并且发现1/3的裸鼠可检测出IgG自身抗体明显增加,导致血小板减少,表明Treg在ITP的发生中发挥重要作用。本实验中ITP患者外周血中Treg细胞比例显著低于健康对照组,说明其体内确实存在Treg细胞的减少,由此推论由于Treg细胞的减少导致免疫抑制功能下降,免疫耐受失衡,在ITP的免疫紊乱中发生重要的生物学作用。Treg细胞异常的原因仍不明确。有研究证明miRNA在Treg细胞中存在高表达,此外它在Treg细胞的发育、免疫功能的维持、抑制炎症反应和自身免疫调控中起着关键作用[5]。
microRNA(miRNA)是一类内源性的进化上保守的微小非编码小分子RNA,全长18~25 bp,能在转录后水平调节mRNA表达。它不仅参与调解多种细胞的增殖、代谢等生理过程还参与组织器官的形成,在多种疾病的发生发展中发挥重要作用。多项研究提出,miRNA的异常表达可能参与了自身免疫性疾病的发生[6]。本实验中大部分差异基因仍未见到国内外报道,可能存在着参与ITP发病的重要因子。miR-548是一个极大的、高度保守的miRNA家族,其几乎位于所有的人类染色体中。该家族在许多生物学过程中发挥重要作用,其中包括信号通路和某些癌症。Xing等[7]研究发现相对于处于慢性乙肝免疫耐受阶段的患者,免疫激活阶段患者体内miR-548ah显著上调,认为miR-548通过IFN-γR1靶点发挥作用。还有研究指出在宫颈癌患者体内大部分miR-548表达是缺失的,而miR-548a和miR-548b过度表达[8]。王芳等[9]研究发现,滤泡树突状细胞通过抑制套细胞淋巴瘤中的miR-548m表达,使细胞周期蛋白依赖激酶6(CDK6)上调,增强MCL的集落形成能力。Shim等[10]对永生化的淋巴细胞系(LCL)进行研究,他们筛选出发育早期的LCLs和分化终末期的LCLs之间的差异基因和miRNA,发现41%以上的基因差异由miRNA调控,并指出miR-548a与差异基因成负相关,主要调节蛋白激酶级联,淋巴细胞的增殖与凋亡。我们对ITP患者的Treg细胞进行研究发现,miR-548ae表达上调,而miR-548am表达下调,其可能作用于不同靶点,对Treg细胞的增殖和凋亡进行调节。有研究发现,miR-1976过度表达并不影响其细胞的凋亡与增殖,可能是通过作用于靶基因CD105,使之下调,从而抑制整合素αVβ6活性,进而影响细胞的功能[11]。整合素αVβ6可以与TGF-β羧基末端的氨基酸序列结合,促使TGF-β活化。显然,本实验中ITP患者miR-1976的过表达,可能导致Treg细胞TGF-β通路缺陷,与通过数据库预测的KEGG通路缺陷是一致的。张亚等[12]研究首次发现了miR-5096等参与调控了脂肪间充质干细胞向血管内皮细胞的分化。我们研究中也发现ITP患者Treg细胞中存在miR-5096的高表达,是否与其细胞的定向分化、细胞增殖、细胞周期等相关仍需进一步研究。显然miRNA调控着人体生长发育等多种生物学进程并在多种自身免疫性疾病、肿瘤性疾病的发病机制中发挥着重要作用。在实验中我们检测到多个miRNA的异常表达,说明ITP患者体内Treg细胞的异常与其密切相关,其可能通过不同靶基因对Treg细胞发挥调节作用,导致ITP的发生。但筛查到的差异性miRNA仍需进行大样本检验以进行证实,并进一步研究其作用的靶基因,才能对疾病的发病机制及治疗起到指导作用。通过对获得的差异基因进行显著性富集分析,我们发现了两条信号途径存在显著异常。Chen等[13]研究发现急性ITP患者外周血中Treg细胞数量降低,IL-10、人转化生长因子-β(TGF-β)等抑制性细胞因子含量也降低,且Treg减少与TGF-β的含量呈正相关。本实验通过对于miRNA进行KEGG的富集性分析后,认为相对于正常对照组,ITP患者组的Treg细胞在TGF-β信号通路上存在缺陷,从而使其分泌减少,有效的免疫抑制功能降低,导致免疫功能紊乱,促进血小板的破坏。另外,Gambarotta等[14]应用腺相关病毒载体(AAV2-ecto-ErbB4)转染带有肌肉血管的神经,并将其用于修复成年雌性Wistar大鼠的正中神经,数据显示,ErbB4对纤维成熟有积极的影响,对细胞的增殖分化起着重要作用。实验中发现ErbB信号途径的缺陷,可能影响Treg细胞的成熟,导致Treg细胞数量的减少。而ErbB-2基因的研究多集中于其在多种肿瘤性疾病中的高表达[15,16],对于自身免疫性疾病中该靶基因表达研究较少,可扩大ITP患者样本数后,进一步进行检测,明确其与疾病发生、发展之间的关系。
综上所述,我们通过初步的研究发现,ITP患者外周血Treg细胞的miRNA表达谱及其相关信号通路存在异常,仍需要扩大样本量,并对不同类型、治疗前后的ITP进行细化研究,探讨miRNA在疾病的诊断、治疗中的价值,为ITP的免疫发病机制和寻找靶向治疗提供新的思路。
[1]刘夫红,吴润晖.Th1/Th2及Th17/Treg细胞平衡在免疫性血小板减少症发病中的意义[J].中国小儿血液与肿瘤杂志,2013,18(2),90-96.
[2]Sakaguchi S,Sakaguchi N,Asano M,etal.Immunologic self-tolenrance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25).Break of a singlemechanism of self-tolenrance causes various autoimmune diseases[J].J immunol,1995,155(3):1151-1164.
[3]Corthay A.How do regulatory T cells work[J].Scand J Immunol,2009,70(4):326-336.
[4]Nishimoto T,Satoh T,Takeuchi T,etal.Critical role of CD4(+)CD25(+) regulatory T cells in preventing murine autoantibody-mediated thrombocytopenia[J].Exp Hematol,2012,40 (4):279-289.
[5]Chong MM,Rasmusen JP,Rudensky AY,etal.The RNAse enzyme Drosha is critical in T cels for preventing lethal inflammatory disease[J].J Exp Med,2008,205(9):2005-2017.
[6]Pauley KM,Cha S,Chan EK .MicroRNA in autoimmunity and autoimmune diseases[J].J Autoimmun,2009,32(3-4):189-194.
[7]Xing TJ,Xu HT,Yu WQ,etal.MiRNA-548ah,a potential molecule associated with transition from immune tolerance to immune activation of chronic hepatitis B[J].Int J Mol Sci,2014,15 (8):14411-14426.
[8]Mandal P,Bhattacharjee B,Das GD,etal.Differential expression of HPV16 L2 gene in cervical cancers harboring episomal HPV16 genomes:influence of synonymous and non-coding region variations[J].PLoS One,2013,8 (6):e65647.
[9]王芳,张新伟,张翼鷟,等.FDCs-miR-548m-CDK6轴在套细胞淋巴瘤集落形成中的研究[J].中国肿瘤临床,2014,41(18):1175-1179.
[10]Shim SM,Junq SY,Nam HY,etal.Network signatures of cellular immortalization in human lymphoblastoid cell lines[J].Biochem Biophys Res Commun,2013,441(2):438-446.
[11]马致南,徐扬,邬姝阳,等.miR-1976在细菌性阴道病中的作用及其机制[J].实用临床医药杂志,2015,19(7):6-10.
[12]张亚,周云,朱璟晶,等.脂肪干细胞分化成血管内皮细胞前后miRNA的差异表达[J].江苏医药,2015,41(8):880-883.
[13]Chen X,Oppenheim JJ,Winkler-Pickett RT,etal.Glucocorticoid amplifies IL-2-dependent expansion of functional FoxP3(+)CD4(+)CD25(+) T regulatory cells in vivo and enhances their capacity to suppress EAE[J].Eur J Immunol,2006,36 (8):2139-2149.
[14]Gambarotta G,Pascal D,Ronchi G,etal.Local delivery of the Neuregulin1 receptor ecto-domain (ecto-ErbB4) has a positive effect on regenerated nerve fiber maturation[J].Gene Ther,2015,22 (11):901-907.
[15]Han MW,Roh JL,Choi SH,etal.Prognostic factors and outcome analysis of salivary duct carcinoma[J].Auris Nasus Larynx,2015,42 (6 ):472-477.
[16]Kato Y,Nakamura H,Tojo H,etal.A proteomic profiling of laser-microdissected lung adenocarcinoma cells of early lepidic-types[J].Clin Transl Med,2015,4 (1):64.
[收稿2016-01-08修回2016-02-22]
(编辑倪鹏)
Analysis of microRNA expression profile of peripheral Treg cells in ITP
ZENG Yan,HAN Hong,CHEN Hui.
Liyuan Hospital of Tongji Medical College of Huazhong University of Science and Technology,Wuhan 430077,China
Objective:To determine whether there were alteration of miRNA expression in peripheral Treg cells,through the contrast between normal people and patients with ITP and to explore the pathogenesis of ITP.Methods: Peripheral blood was obtained from ITP patients and normal people ,and Treg cells were isolated by flow cytometry.RNA was extracted from Tregs in each group,then for miRNA arrays analysis through Solexa sequencing.Compare ITP group and normal control group microarray to identify differentially expressed miRNA.Differentially expressed miRNA were analyzed to find the abnormal signaling pathways.Results: We screened multiple miRNA abnormal expression in Treg cell of ITP patients,which has significant differences were miR-1976,miR-548ae-5p,miR-5096-p3,miR-548am-5p,PC-3p-63471,and PC-3p-96627.By enrichment analysis,we found two abnormal signaling pathways:ErbB signaling pathway and TGF-β signaling pathway.Conclusion: Differentially expressed miRNA were found in peripheral Treg cell of ITP patients,which may be affected the normal functioning immune regulation of Treg cells,and involved in the pathogenesis of ITP.
Immune thrombocytopenia;Treg cells;microRNA
10.3969/j.issn.1000-484X.2016.09.023
曾艳(1980年-),女,硕士,主治医师,主要从事出、凝血疾病方面的研究,E-mail:13986116219@163.com。
及指导教师:韩红(1968年-),女,博士,副主任医师,硕士生导师,主要从事血液系统疾病的研究,E-mail:hanhongy65@163.com。
R558+.2
A
1000-484X(2016)09-1350-04
①本文受华中科技大学校基金资助(No.2014QN073)。

