小鼠B7-1基因RNAi慢病毒载体的构建及其沉默效应研究①
孔 永 沈立军 王 婧 朱 莹 蔡 磊 邱玉华 黄 莉
(苏州大学医学部免疫学系,苏州215123)
小鼠B7-1基因RNAi慢病毒载体的构建及其沉默效应研究①
孔永沈立军②王婧朱莹蔡磊邱玉华黄莉③
(苏州大学医学部免疫学系,苏州215123)
目的:构建介导小鼠B7-1基因RNAi的慢病毒载体,研究其对L929细胞表面B7-1分子表达的沉默效应。方法:从小鼠B7-1基因编码区选择3段RNA干扰靶序列,制备转录双发夹RNA的前体DNA,并克隆至慢病毒穿梭质粒,构建B7-1的RNAi慢病毒穿梭载体,测序鉴定。将重组质粒及辅助质粒共转染293T细胞产生慢病毒,经超速离心获得浓缩慢病毒颗粒。通过测定293T细胞GFP表达水平确定病毒滴度,流式细胞术检测感染效率以及对细胞表面B7-1的干扰效率。病毒感染细胞经嘌呤霉素筛选及克隆培养获得小鼠B7-1基因RNAi慢病毒稳定感染的L929细胞,流式细胞术分析细胞中GFP及B7-1分子表达的状况;将感染细胞与分离的小鼠脾脏T细胞混合培养,分析B7-1稳定沉默细胞刺激T细胞增殖的能力。结果:成功了构建小鼠B7-1基因RNA干扰的重组慢病毒载体;获得了滴度达(3~5)×108TU/ml的浓缩重组慢病毒,重组慢病毒可有效感染L929细胞介导GFP表达以及沉默其表面的B7-1。经筛选获得慢病毒稳定感染的L929细胞,该细胞表面B7-1分子表达受到抑制,刺激T细胞增殖的能力显著下降(P<0.05)。结论:构建了能够高效感染及沉默小鼠B7-1分子的RNAi慢病毒载体,该载体可稳定沉默L929细胞表面B7-1分子表达,抑制B7-1/CD28信号诱导的T细胞增殖效应。
B7-1;RNAi;慢病毒;共刺激信号;L929
B7-1是重要的T细胞共刺激分子,与表达于T细胞表面的CD28/CTLA4结合所转导的细胞信号对T细胞活化反应的维持和免疫应答的扩大具有关键作用[1],也是通过干预共刺激信号对自身免疫性疾病、移植排异反应等进行免疫治疗的有效靶点之一[2]。
RNAi(RNA interference)技术利用21~23 bp的双链RNA(double strand RNA,dsRNA)介导的转录后基因沉默机制,序列特异性的抑制同源基因表达以及诱导相应蛋白缺失表型的产生[3],为从基因水平抑制蛋白表达提供了可靠的手段。RNAi效应的有效发挥与介导途径和载体的选择密不可分。慢病毒载体宿主细胞谱广泛,可有效感染分裂和静止期细胞,能够介导目的基因整合到宿主基因组长期表达,可介导shRNA(short hairpin RNA)表达进而诱导RNAi,从而实现高效稳定的基因沉默效应[4]。
鉴此,本文旨在构建小鼠B7-1基因RNAi慢病毒载体,评价其对B7-1分子表达的沉默效应,为后续通过抑制B7-1介导的共刺激信号诱导免疫耐受的研究提供实验基础。
1 材料与方法
1.1材料293T及L929细胞(ATCC);FBS及RPMI1640培养基(Gibco);大肠埃希菌DH5α及Lipofectamine2000(Invitrogen);慢病毒载体系统(上海吉玛制药);质粒DNA提取及DNA凝胶回收试剂盒(Axygen);限制性内切酶及T4 DNA连接酶(TaKaRa);Polybrene、丝裂霉素C、MTT、DMSO及嘌呤霉素,购自Sigma-Aldrich;抗小鼠CD3抗体及PE标记的抗小鼠B7-1抗体(Biolegend);6~8周龄C57BL/6小鼠(苏州大学实验动物中心);小鼠组织单个核细胞分离液(天津灏洋生物);尼龙毛柱(Polysciences)。
1.2方法
1.2.1RNAi序列选择与shRNA设计根据文献报道的RNAi序列选择和设计原则[5],从小鼠B7-1基因(NM_009855)编码区中选择3段长度为21个核苷酸的片段作为RNAi靶序列,同时选取与B7-1无同源性的无义序列作为检验RNAi特异性的阴性对照。shRNA的模板DNA序列(表1)由正向RNAi靶序列和反向互补序列通过TTCAAGAGA连接,并以6个T作为RNA转录酶Ⅲ的终止信号,同时在序列两端分别添加BamH Ⅰ 和EcoR Ⅰ 黏末端序列以便于后续基因克隆。所设计的寡核苷酸序列经转录产物的二级结构分析(图1)后,由上海吉玛公司合成。
1.2.2RNAi慢病毒穿梭载体的构建与鉴定将合成的DNA寡核苷酸序列退火形成shRNA模板双链DNA,在T4 DNA连接酶作用下与BamHⅠ和EcoRⅠ酶切的慢病毒穿梭质粒进行连接。连接产物热激转化受体DH5α菌,随后于氨苄LB培养平皿中进行克隆培养。每个靶点随机挑取20个重组阳性克隆送Genescript进行DNA测序鉴定。
1.2.3重组慢病毒的包装制备与滴度测定按照质粒DNA提取试剂盒说明制备重组慢病毒穿梭载体及包装辅助质粒,在Lipofectamine2000介导下共转染对数生长期60%~70%汇合的293T细胞12 h后,更换为含10%FBS的RPMI1640培养基继续培养。收集48 h及72 h的培养上清,于4℃下以50 000 g 离心2 h获得浓缩的慢病毒颗粒。将浓缩慢病毒进行10倍梯度稀释后感染293T细胞,培养72 h后于荧光显微镜下观察计数GFP阳性细胞数目,根据公式计算病毒滴度。病毒滴度(TU/ml)=(计数孔GFP+细胞数/感染病毒体积 ml)×稀释倍数。

图1 小鼠B7-1基因shRNA模板转录产物的二级结构Fig.1 Second structure of transcripts derived from shRNA template specific for mouse B7-1 RNAi
表1转录小鼠B7-1基因RNAi双发夹RNA的DNA模板序列
Tab.1Sequences of DNA template transcribing short hairpin RNA for mouse B7-1 RNAi

NameSequenceTarget-15'-GATCCGCAATTGTCAGTTGATGCAGGTTCAAGAGACCTGCATCAACTGACAATTGCTTTTTTG-3'3'-GCGTTAACAGTCAACTACGTCCAAGTTCTCTGGACGTAGTTGACTGTTAAGGAAAAAACTTAA-5'Target-25'-GATCCGCCGTTACAACTCTCCTCATGTTCAAGAGACATGAGGAGAGTTGTAACGGCTTTTTTG-3'3'-GCGGCAATGTTGAGAGGAGTACAAGTTCTCTGTACTCCTCTCAACATTGCCGAAAAAACTTAA-5'Target-35'-GATCCGGAAAGAGGAACGTATGAAGTTTCAAGAGAACTTCATACGTTCCTCTTTCCTTTTTTG-3'3'-GCCTTTCTCCTTGCATACTTCAAAGTTCTCTTGAAGTATGCAAGGAGAAAGGAAAAAACTTAA-5'
1.2.4重组慢病毒感染L929细胞及有效B7-1 RNAi慢病毒的筛选在Polybrene(5 ng/ml)辅助下将阴性对照慢病毒以感染复数(Multiplicity of infection,MOI)为0、20、40、60感染对数期70%汇合的L929细胞,感染12 h后更换新鲜培养基,继续培养60 h后在荧光镜下观察GFP的表达情况,并采用流式细胞术分析病毒的感染效率。根据感染效率测定结果确定的感染条件后,将3靶点RNAi慢病毒感染L929细胞,通过流式术分析细胞表面B7-1的沉默状况以确定具有最佳干扰效果的小鼠B7-1 RNAi重组慢病毒。
1.2.5重组B7-1 RNAi慢病毒稳定感染L929细胞的制备采用具有最佳干扰效果的RNAi重组慢病毒感染L929细胞,感染12 h后消化收集细胞,按1∶10比例稀释后传代于含5 μg/ml嘌呤霉素及10%FBS的RPMI1640培养基中,连续培养10 d以获得抗性生长细胞,在荧光镜下观察GFP的表达情况并挑取GFP表达亮度高的细胞克隆进行扩增培养。
1.2.6重组B7-1 RNAi慢病毒稳定感染对L929细胞表面B7-1表达的沉默效果分析收获B7-1 RNAi慢病毒稳定感染的L929细胞,采用流式细胞术分析细胞中转基因GFP以及细胞表面B7-1的表达情况。
1.2.7重组B7-1 RNAi慢病毒对B7-1介导共刺激信号诱导的T细胞增殖反应的影响将无菌分离的C57BL/6小鼠脾脏组织,进行研磨及100目筛网过滤后,用小鼠组织单个核细胞分离液参照试剂说明分离小鼠单个核细胞,随后采用尼龙毛柱吸附及洗脱获得T细胞悬液作为反应细胞。收获慢病毒稳定感染的L929用25 μg/ml丝裂霉素37℃孵育30 min并用PBS洗涤后作为刺激细胞。将2×104刺激细胞/孔与2×105个反应细胞/孔接种于CD3抗体(0.1 μg/ml)包被的96孔板中混合培养72 h后采用MTT法测定每孔OD490值。
2 结果
2.1重组慢病毒穿梭载体的构建介导小鼠B7-1基因RNAi的shRNA模板寡核苷酸序列经退火形成双链DNA后与线性化的慢病毒穿梭质粒连接,将连接产物转化的受体菌进行克隆培养,挑取阳性克隆经直接DNA测序鉴定,结果显示:重组慢病毒穿梭载体中插入序列的结构及序列组成符合设计预期(图2)。
2.2重组慢病毒的包装与滴度测定将重组慢病毒穿梭载体与包装辅助质粒在脂质体介导下共转染293T细胞,转染后继续培养24 h,即可见GFP的表达。收获48 h及72 h的培养上清进行超高速离心浓缩,浓缩病毒经梯度稀释后感染293T细胞,计数GFP阳性细胞数目确定所制备的重组慢病毒滴度为(3~5)×108TU/ml(图3)。
2.3重组慢病毒感染与有效B7-1 RNAi慢病毒的筛选随着MOI的增加,慢病毒介导GFP表达的效率随之升高,在MOI为60时可高效感染L929细胞及介导GFP表达,其感染效率达88.7%(图4)。针对3个不同位点的小鼠B7-1 RNAi重组慢病毒以MOI为60感染L929细胞,其感染效率分别达68.3%、70.7%及69.0%,低于阴性对照病毒(79.7%), 但对细胞表面B7-1的表达抑制显著,其瞬时沉默效率分别为73.2%、72.4%及61.3%(图5)。根据以上结果确定靶点1重组RNAi慢病毒(LV-T-1)具有更好的B7-1沉默效果。
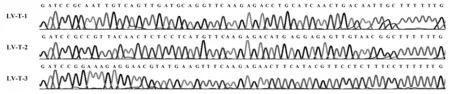
图2 转录小鼠B7-1基因RNAi双发夹RNA的DNA模板序列的测序结果Fig.2 Sequencing of DNA template transcribing short hairpin RNA for mouse B7-1 RNAi

图3 重组慢病毒的滴度测定(×100)Fig.3 Titration of recombinant lentivirus(×100)
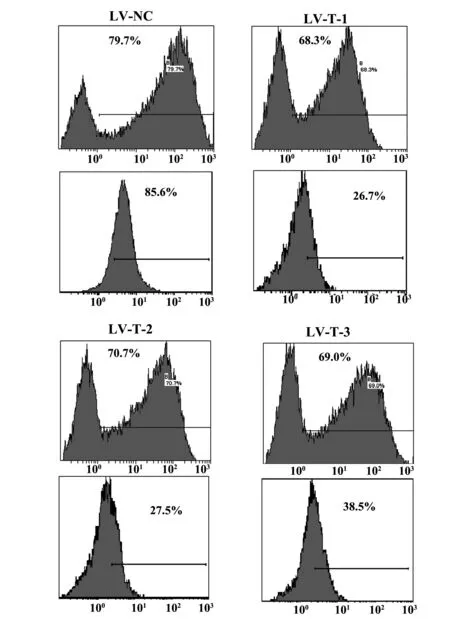
图5 重组B7-1 RNAi慢病毒感染及抑制L929细胞表面B7-1的表达Fig.5 Inhibition of B7-1 expression on L929 cells after transfected by recombinant B7-1 RNAi lentivirus
2.4重组慢病毒稳定感染的L929细胞筛选小鼠B7-1 RNAi重组慢病毒LV-T-1及阴性对照慢病毒LV-NC感染的L929细胞经嘌呤霉素压力筛选并克隆培养,获得了GFP荧光强度明亮均匀的稳定感染细胞克隆(图6)。
2.5重组慢病毒稳定感染对L929细胞表面B7-1分子表达的沉默效应LV-T-1及LV-NC稳转细胞经扩大培养后,收获细胞进行流式细胞术分析,结果显示:GFP表达率分别为98.1%和94.4%,LV-T-1对L929细胞B7-1表达抑制率达98.2%(图7),同时慢病毒稳定沉默B7-1的L929细胞与小鼠脾脏T细胞混合培养的结果显示,慢病毒介导小鼠B7-1 稳定沉默可显著抑制B7-1/CD28介导的共刺激信号及所诱导的T细胞增殖反应,见图8,P<0.05。
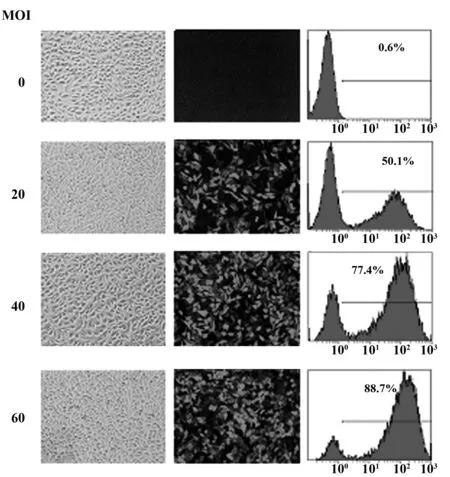
图4 慢病毒感染L929的效率(×100)Fig.4 Transduction efficiency of lentivirus in L929 cells(×100)
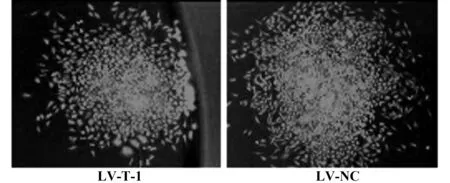
图6 LV-T-1与LV-NC稳定感染的L929细胞(×100)Fig.6 Stable L929 cells transducted by LV-T-1&LV-NC(×100)

图7 重组慢病毒稳定感染的L929细胞中GFP与B7-1的表达Fig.7 Expression of GFP and B7-1 in stable L929 cells transducted by recombinant lentivirusNote: A.L929,negative control;B.L929,PE-B7-1 staining;C.L929-LV-NC,PE-B7-1 staining;D.L929-LV-T-1,PE-B7-1 staining.

图8 LV-T-1稳定感染抑制B7-1/CD28共刺激信号介导的T细胞增殖Fig.8 Inhibition effects on T cells proliferation induced by B7-1/CD28 signal of stable B7-1 silencing mediated by LV-T-1
3 讨论
T细胞的活化需要双信号的刺激[6,7]:第一信号是由TCR(T cell receptor)识别抗原肽-MHC复合体(Major histocompatibility complex)所形成的抗原特异性信号;第二信号(共刺激信号)则由APC(Antigen presenting cell)表面的共刺激分子结合T细胞表面的相应受/配体提供。缺乏共刺激信号导致T细胞不能有效活化,致使其免疫无能、克隆清除进而引发机体免疫耐受,这也使通过干预共刺激分子和信号,调整机体免疫状态成为治疗自身免疫性疾病、移植排异反应的新策略[2]。
B7/CD28信号是经典T细胞共刺激信号,该信号可协同抗原特异性的第一信号促进T细胞活化与增殖,对于启动T细胞初次免疫应答是必须的[1]。B7-1,属于B7家族成员,表达于活化24~48 h后的APC表面,该分子与CD28结合所转导的共刺激信号对于T细胞活化反应的持续和扩大具有重要作用[8]。已有研究表明,采用B7特异性抗体或CD28的负性调控配体CTLA4的融合蛋白从蛋白水平阻断B7/CD28共刺激信号可以有效抑制效应T细胞的活化增殖,从而诱导机体免疫耐受的发生[9]。但蛋白类制剂的高成本局限性,也促使新型特异性共刺激信号干预方式的研究不断进行。
RNAi是由内源或外源dsRNA介导的序列特异性转录后基因沉默机制,RNAi技术为从基因水平沉默共刺激分子表达及抑制其所介导的共刺激信号提供了有力的工具。RNAi效应的发挥主要通过外源导入21~23 bp的siRNA(small interfering RNA)或构建表达载体体内转录成shRNA进而在生物体内被核酸内切酶Dicer切割成siRNA的方式进行[3]。表达载体法介导shRNA表达进而诱导RNAi效应,可以有效避免siRNA通过机体生物屏障时RNA酶的降解作用,从而延长基因沉默的时间,是实现体内基因功能研究、基因治疗等的重要手段[10]。新型慢病毒载体能够感染多种分裂和静止期细胞,可介导目的基因整合到宿主细胞基因组及稳定表达,同时水泡性口炎病毒(Vesicular stomatitis virus,VSV)包膜G蛋白改型的慢病毒稳定性提高,可通过超高速离心获得高的滴度,使其成为介导稳定长时RNAi效应的重要载体[4]。
本研究根据文献报道的原则选择小鼠B7-1 RNAi的靶序列,构建和制备转录shRNA的重组慢病毒,并通过超速离心获得了浓缩的病毒颗粒。采用细胞生物学的方法确定浓缩病毒的滴度,经检测该病毒可高效感染L929细胞(感染效率达88.7%),瞬时感染后B7-1表达的抑制率达73.2%。经筛选获得了慢病毒稳定感染的L929细胞,细胞中GFP表达率达到98.1%,细胞表面B7-1表达的抑制率达98.2%,慢病毒稳定沉默B7-1表达显著抑制了B7-1/CD28信号诱导的T细胞增殖反应。
综上所述,本研究构建了具有高效感染及介导基因沉默能力的小鼠B7-1基因RNAi慢病毒载体,重组RNAi慢病毒可介导对L929细胞表面B7-1的稳定沉默,并抑制B7-1/CD28共刺激信号诱导的T细胞增殖反应。本研究为在基因水平抑制B7/CD28共刺激信号,治疗病理性T细胞活化及免疫应答为特征的自身免疫性疾病及移植排异反应提供了新的手段和研究依据。
[1]Li XL,Sluijter M,Doorduijn EM,etal.Limited density of an antigen presented by RMA-S cells requires B7-1/CD28 signaling to enhance T-cell immunity at the effector phase[J].PLoS One,2014,9(11):1-10.
[2]Huang L,Kong Y,Wang J,etal.Reducing progression of experimental lupus nephritis via inhibition of the B7/CD28 signaling pathway[J].Mol Med Rep,2015,12(3):4187-4195.
[3]Crotty S,Pipkin ME.In vivo RNAi screens: concepts and applications[J].Trends Immunol,2015,36(5):315-322.
[4]Segura MM,Mangion M,Gaillet B,etal.New developments in lentiviral vector design,production and purification[J].Expert Opin Biol Ther,2013,13(7):987-1011.
[5]Reynolds A,Leak D,Boese Q,etal.Rational siRNA design for RNA interference[J].Nat Biotechnol,2004,22(3):326-330.
[6]Chen LD,Flies B.Molecular mechanisms of T cell co-stimulation and co-inhibition[J].Nat Rev Immunol,2013,13(4):227-242.
[7]Coquet JM,Rausch L,Borst J.The importance of co-stimulation in the orchestration of T helper cell differentiation[J].Immunol Cell Biol,2015,93(9):780-788.
[8]黄莉,孙杰,郭静雅,等.siRNA沉默抗原递呈细胞表面CD86的表达对T淋巴细胞激活的影响[J].中国免疫学杂志,2011,27(8):681-685.
[9]Ford ML,Adams AB,Pearson TC.Targeting co-stimulatory pathways:transplant-ation and autoimmunity[J].Nat Rev Nephrol,2014,10(1):14-24.
[10]Wang J,Lu Z,Wientjes MG,etal.Delivery of siRNA therapeutics:barriers and carriers[J].Aaps J,2010,12(4):492-503.
[收稿2015-11-09修回2016-05-16]
(编辑倪鹏)
Construction of lentiviral vector specific for mouse B7-1 gene interference and study on silencing effects induced by lentivirus-mediated B7-1 RNAi
KONG Yong,SHEN Li-Jun,WANG Jing,ZHU Ying,CAI Lei,QIU Yu-Hua,HUANG Li.
Department of Immunology,Medical College,Soochow University,Suzhou 215123,China
Objective:To construct lentiviral vector specific for mouse B7-1 RNA interference and study lentivirus-mediated B7-1 gene silencing effects in L929 fibroblast cells.Methods: Three candidate sequences for B7-1 RNAi selected from coding sequence of mouse B7-1 transcription were used to design short hairpin RNA(shRNA)templates and then cloned into lentiviral expression plasmid followed with correctness identification of inserted sequence by DNA sequencing.Recombinant lentivirus were prepared by co-transfecting lentiviral expression vector and packaging plasmids into 293T cells.Then the resulting culture supernatant containing infectious lentiviral particles was pooled and centrifuged via ultra-centrifugation.Infectious titer of the preparations was determined by detecting the expression of GFP in 293T cells after transfected by lentivirus.Cultured L929 cells were transfected with lentivirus to deter-mine transduction efficiency and silencing efficacy of B7-1 expression by flow cytometry.Transducted L929 cells were then screened using puromycin to generate stable cell clones followed by flow cytometry analysis of GFP and B7-1 expression.A mixed reaction system consisting of stable B7-1 silencing L929 cells and mouse splenic T cells was used to analyze ability of the established cell line to trigger T cells proliferation.Results: Lentiviral expression vector for mouse B7-1 RNAi was correctly constructed with inserted sequences as designed.Recombinant RNAi lentivirus were prepared with titers ranging (3-5)×108TU/ml and efficacy to mediate GFP transgene expression and B7-1 silencing.B7-1 expression and the ability to trigger T cells proliferation of stable L929 cells were suppressed significantly(P<0.05).Conclusion: We generated lentiviral vector specific for mouse B7-1 RNAi with high performance of transduction efficiency as well as B7-1 silencing efficacy and the recombinant RNAi lentivirus can mediated stable B7-1 gene silencing in L929 cells and inhibition of T cells proliferation induced by B7-1/CD28 co-stimulatory signal.
B7-1; RNAi;Lentivirus;Co-stimulatory signal;L929
10.3969/j.issn.1000-484X.2016.09.018
孔永(1983年-),男,在读博士,主要从事免疫分子生物学方面的研究,E-mail:kungyung@126.com。
及指导教师:邱玉华(1957年-),女,医学博士,教授,博士生导师,主要从事共信号分子机制研究,E-mail:qyh820@126.com。
黄莉(1975年-),女,医学博士,副主任医师,硕士生导师,主要从事儿科疾病的临床与基础研究,E-mail:szdalv@163.com。
R392.11
A
1000-484X(2016)09-1327-06
①本文受国家自然科学基金面上项目(81373236)资助。
②苏州大学生物医学研究院,苏州215123。
③苏州大学附属儿童医院呼吸科,苏州215000。

