趋化因子CCL22和CCL20协同皮肤抗原诱导的调节性T淋巴细胞对皮肤移植的影响①
李 伟 宋 云 叶艾竹 安 宇 骆姝琳 刘水和 袁 军
(贵州省人民医院中心实验室, 贵阳550002)
趋化因子CCL22和CCL20协同皮肤抗原诱导的调节性T淋巴细胞对皮肤移植的影响①
李伟宋云②叶艾竹安宇骆姝琳刘水和袁军
(贵州省人民医院中心实验室, 贵阳550002)
目的:研究小鼠皮肤移植模型中趋化因子CCL20和CCL22联合调节性T细胞对移植皮肤存活时间的影响。方法:将皮肤移植小鼠分为四组,每组3只小鼠,分别为Treg组、Treg+CCL20组、Treg+CCL22组与对照组。其中Treg细胞经同种异体皮肤抗原诱导。以C57BL/6小鼠为同种异体供体,BALB/c小鼠为受体行皮肤移植手术。进行皮肤移植后立即于异体皮下注射Treg细胞2×105个细胞/鼠,体积为200 μl。以后每日于异体皮下注射趋化因子CCL20或CCL22,共连续注射10 d,观察并记录皮肤的存活情况。Treg细胞定植实验:首先利用磁珠分选方法分离皮肤抗原诱导Treg细胞,并利用锝99标记分离到的Treg细胞;皮下注射3 h后,处死小鼠,用GC-2016γ放射免疫计数器检测各脏器及移植皮肤的放射性活度。结果:①经Treg进行干预的小鼠,其异体皮肤存活时间均显著长于手术对照组(P<0.05),而且同种异体抗原诱导Treg在趋化因子CCL20或 CCL22存在下异体皮肤存活时间显著高于单纯使用Treg组和对照组(P<0.001)。②注射皮肤抗原诱导的Treg细胞后,自体和异体皮肤移植组Treg细胞主要分布在自体和异体皮肤,分别占注射Treg组细胞的60%和98%;加趋化因子CCL20组和CCL22组的Treg主要分布在肝脏。结论:趋化因子CCL20和CCL22能够协同促进经皮肤抗原诱导的Treg细胞延长异体皮肤的存活时间,这种作用效果可能与趋化因子CCL20和CCL22趋化Treg细胞向肝脏大量定植相关。
Treg;皮肤移植;CCL20;CCL22
治疗大面积皮肤烧伤的主要措施之一就是进行皮肤移植,但是免疫排斥是影响异体皮肤移植效果的关键因素。因此,如何降低同种异体皮肤移植排斥反应,延长移植物的存活,是皮肤移植领域急需解决的问题。临床上通常采用免疫抑制剂来进行抗排异治疗,但是长期服用免疫抑制剂会引起机会性感染,甚至诱发肿瘤等一系列并发症。免疫抑制细胞CD4+CD25+Treg可以有效的抑制机体的免疫状态[1],进而延长移植皮肤的存活时间,为降低皮肤移植排斥反应提供了新的思路,因此受到了越来越多的关注。但是CD4+CD25+Treg比例较少,只占成熟T细胞的5%~10%[2]。Treg细胞表面表达的趋化因子受体主要有CCR4和CCR6,可以在趋化因子CCL20和CCL22的作用下有效的促进免疫细胞向特定部位趋化[3,4]。因此,我们考虑将趋化因子CCL20和CCL22与皮肤抗原诱导的Treg细胞联合应用能否有效地延长移植皮肤的存活时间,并进一步研究Treg细胞在皮肤移植小鼠模型中的分布,这对我们进一步了解免疫抑制细胞Treg过继免疫疗法在皮肤移植中的应用提供依据。
1 材料与方法
1.1材料
1.1.1实验动物清洁级近交系,BALB/c(H-2d)和C57BL/6(H-2b) 雌性小鼠,6~8周龄,体重18~20 g,均购于重庆滕鑫生物技术有限公司。
1.1.2主要试剂PerCP-AntiCD4(货号:553052,BD公司)、FITC-AntiCD25(货号:553071,BD 公司);CCL20和CCL22(购于PeproTech公司);小鼠淋巴细胞分离液购于天津灏洋生物制品科技有限责任公司;免疫磁珠分选抗体 MACS CD4+CD25+Regulatory T Cell Isolation Kit mouse(Miltenyi Biotec);99Tcm(北京原子高科有限公司);氯化亚锡(成都金山化学试剂有限公司)。
1.2方法
1.2.1皮肤移植小鼠模型的建立以C57BL/6小鼠为同种异体供体,BALB/c小鼠为受体行皮肤移植手术。颈椎脱臼处死供体小鼠,备皮后用眼科剪和眼科镊取其背部皮片2 cm×2 cm,轻轻刮去皮下组织,然后放在加入无菌生理盐水的培养皿中冲洗3~5次备用。麻醉受体BALB/c小鼠,剪去其背部皮片2 cm×2 cm,放在加有生理盐水的培养皿中备用。用组织剪修剪皮片,采用间断缝合法缝到BALB/c小鼠背部,用3%碘酒消毒。将手术后小鼠单独饲养,观察其精神及活动状态。每天观察自体与异体皮肤的存活情况(包括移植物色泽、面积、硬度、有无充血、坏死、结痂脱落、毛发色泽及生长等),并记录排斥发生的时间。
1.2.2免疫磁珠分选Treg细胞取经皮肤抗原诱导4周 BALB/c(H-2d)小鼠各9只,制备脾脏单个核细胞悬液,计数后按Treg免疫磁珠分选试剂盒说明书分选Treg细胞。并用流式抗体进行荧光染色,标记PerCP-AntiCD4、FITC-AntiCD25、PE-AntiCD127,避光染色30 min后,用流式检测各组Treg细胞的纯度,并计算得率。目标细胞得率=(分选所得目标细胞数/加入总细胞数)×100%。
1.2.399Tcm标记Treg细胞按照参考文献中报道的方法[5],首先取99Tcm 2 MBq,加生理盐水至4 ml(准备液)。同时,配制 5 mmol/L 的 SnCl2(氯化亚锡)作为还原液。然后,取2 ml准备液,1 ml还原液,置混悬器上振动混匀,静置 5 min,制备得到 0.3 MBq/ml的99Tcm标记应用液。再将新鲜分离的Treg 1×105个与99Tcm标记应用液混合,摇匀,置 37℃、5%CO2(V/V)培养箱孵育 20 min,1 000 r/min离心 5 min,去上清。以生理盐水反复洗涤标记细胞3次,调细胞浓度至 1×106ml-1备用。
1.2.4实验分组抗原诱导组接受同种异体皮肤抗原诱导的Treg干预,包括Treg组、Treg+CCL20组、Treg+CCL22组。小鼠移植模型在皮肤植皮前,异体皮片均在趋化因子液中浸泡备用(CCL20 浓度5 ng/ml,CCL22 浓度50 ng/ml)。每组3只模型小鼠,按1.2.1进行皮肤移植后立即于异体皮下注射Treg细胞,剂量同1.2.3。并每日于异体移植皮下注射趋化因子,剂量为CCL20:5 ng/ml,10 μl/只;CCL22:50 ng/ml,10 μl/只,共连续注射10 d。观察并记录皮肤存活情况。
1.2.5检测Treg细胞在各组织中的分布分组方法同1.2.4,将标记好的皮肤抗原诱导Treg注入皮肤移植小鼠体内,剂量为每鼠2×105个细胞,体积为200 μl。3 h后,处死小鼠,取其心脏、肝脏、脾脏、肺、肾脏、异体皮片与自体皮片放入检测管中,用GC-2016γ放射免疫计数器检测各脏器及移植皮肤的放射性活度。以各脏器放射性活度总和为分母,各脏器放射性活度为分子,计算各自放射性活度百分率。

2 结果
2.1Treg分选及鉴定利用流式细胞术鉴定磁珠分选得到的调节性T细胞的纯度为90.3%,细胞得率为66.7%,见图1。
2.2移植皮片的存活情况如图2所示,手术对照组异体皮片平均存活时间分别为11 d,经Treg进行干预的小鼠,其异体皮肤存活时间均显著长于手术对照组(P<0.05)。同种异体抗原诱导Treg在趋化因子CCL20或 CCL22存在下异体皮肤存活时间显著高于单纯使用Treg组和对照组(P<0.001)。CCL20和CCL22两趋化因子干预组之间无显著性差异(P>0.05)。
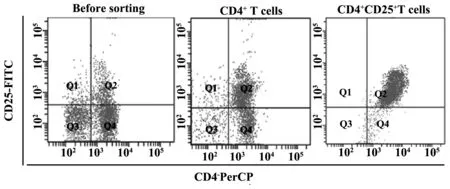
图1 Treg分选及鉴定Fig.1 Sorting and verification of Treg
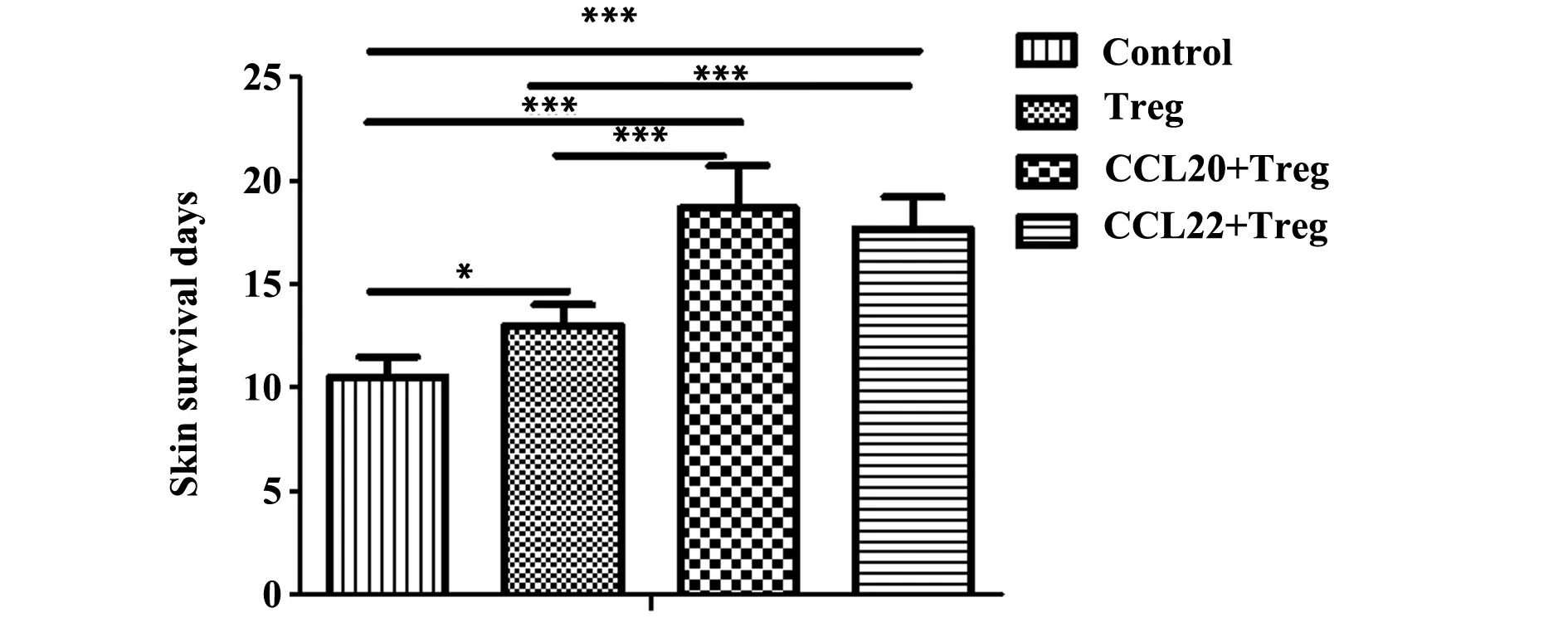
图2 皮肤移植片的存活时间Fig.2 Survival time of skin graftsNote: *.P<0.05;**.P<0.01;***.P<0.001.

图3 皮肤抗原诱导的Treg细胞在各器官的百分率Fig.3 Ratio of skin antigen-induced Treg in organs
2.3皮肤抗原诱导Treg细胞在各器官中的分布注射皮肤抗原诱导的Treg细胞3 h后,自体和异体皮肤移植组Treg细胞主要分布在自体和异体皮肤,分别占注射Treg细胞的60%和98%;加趋化因子CCL20组和CCL22组的Treg主要分布在肝脏;尾静脉注射Treg组的Treg细胞主要分布在脾脏和肝脏,分别占60%和36%,见图3。
3 讨论
目前,CD4+CD25+Treg细胞是一群具有免疫抑制功能的T细胞亚群,在抑制免疫应答中起着重要作用[6],维持机体Treg细胞的数量,特别是皮肤移植部位Treg细胞数量能够显著延长移植皮肤的存活时间。过继Treg细胞可以有效的抑制排斥反应,诱导免疫耐受,从而提高移植物的长期生存率,并能够减少传统药物的毒副作用。皮肤抗原诱导的Treg细胞具有潜在的抑制皮肤抗原特异性的效应T细胞的能力,所以本研究用到的Treg细胞为经皮肤抗原所诱导的。那么联合趋化因子,能否趋化Treg细胞向抑制部位趋化,或者增强机体对移植皮肤的免疫耐受,进而延长移植皮肤的存活时间呢?目前尚不清楚,因此本研究探讨了Treg细胞在抗原诱导下的趋化特性及Treg细胞在体内的趋化与定植特点与移植免疫耐受的关系及其对移植皮肤存活时间的影响。
我们首先用磁珠分选系统得到了纯度达90%以上的Treg,为我们进一步研究Treg细胞在皮肤移植中的功能提供基础。其次我们分析了Treg和趋化因子的联合应用对于移植皮肤生存时间的影响。最后,为了进一步探讨趋化因子的加入后对移植物存活时间的长短是否与Treg在各器官中的分布的变化相关,我们通过用同位素进行标记,利用放射免疫计数器检测了各组皮肤移植后Treg细胞分布的差异。趋化因子可以定向趋化免疫细胞至特定部位,而CCL22和CCL20是趋化因子受体CCR4和CCR6的主要配体之一,主要表达在Treg细胞表面,可以介导Treg的定向趋化[7]。从图2中可以看到无论皮肤诱导组或非诱导组Treg细胞的加入都能够显著延长移植皮肤的存活时间,这和先前的研究结论一致[8],进一步说明了过继的Treg细胞显著增强了对机体的免疫抑制状态。图3结果显示,趋化因子CCL20和CCL22可以显著促进诱导的Treg细胞向肝中的定向趋化。异体皮肤移植组的Treg细胞主要分布在异体皮肤中,当加入趋化因子CCL20和CCL22后,皮肤部位的Treg细胞显著减少,向肝脏和肾脏中迁移,这可能是因为肝脏为免疫耐受环境,当趋化因子加入后,能够特异性的趋化免疫抑制细胞如Treg细胞向肝脏趋化。肝脏和肾脏中Treg数量的增多与延长皮肤移植存活时间的相关性仍然需要我们做进一步的研究。本研究发现皮肤诱导组的Treg与趋化因子CCL20或CCL22联合使用能够使Treg细胞由皮肤移植向肝脏和肾脏迁移,但是却可以显著延长移植皮肤的存活时间,可见在移植皮肤部位注射趋化因子并不能够显著诱导Treg细胞向该部位定植。这说明了皮肤移植存活时间的长短与移植皮肤部位的Treg细胞的数量无显著相关性,而可能与机体的整体免疫抑制状态相关。那么,Treg细胞在趋化因子的作用下向肝脏和肾脏迁移,提示我们在肝脏移植和肾脏移植中可以利用趋化因子CCL20或CCL22联合Treg细胞更有助于延长移植肝脏和肾脏的存活时间。
本研究发现趋化因子CCL20或CCL22能够有效促进皮肤抗原诱导的Treg细胞的定向趋化,并显著延长移植皮肤的存活时间,为今后在皮肤移植中合理利用Treg细胞提供依据。
[1]Piccirillo CA,Shevach EM.Naturally-occurring CD4+CD25+immunoregulatory T cells:central players in the arena of peripheral tolerance[J].Semin Immunol,2004,16(2):81-88.
[2]Itoh M,Takahashi T,Sakaguchi N,etal.Thymus and autoimmunity:production of CD25+CD4+naturally anergic and suppressive T cells as a key function of the thymus in maintaining immunologic self-tolerance[J].J Immunol,1999,162(9):5317-5326.
[3]Gobert M,Treilleux I,Bendriss-Vermare N,etal.Regulatory T cells recruited through CCL22/CCR4 are selectively activated in lymphoid infiltrates surrounding primary breast tumors and lead to an adverse clinical outcome[J].Cancer Res,2009,69(5):2000-2009.
[4]Cook KW,Letley DP,Ingram RJ,etal.CCL20/CCR6-mediated migration of regulatory T cells to the Helicobacter pylori-infected human gastric mucosa[J].Gut,2014,63(10):1550-1559.
[5]张金赫,徐海峰,邵秋菊.99Tcm直接法标记血管抑素[J].第四军医大学学报,2003,24(23):2189-2192.
[6]Piccirillo CA,Shevach EM.Cutting edge:control of CD8+T cell activation by CD4+CD25+immunoregulatory cells[J].J Immunol,2001,167(3):1137-1140.
[7]Ahern D,Lloyd CM,Robinson DS.Chemokine responsiveness of CD4+CD25+regulatory and CD4+CD25-T cells from atopic and nonatopic donors[J].Allergy,2009,64(8):1121-1129.
[8]Issa F,Hester J,Goto R,etal.Exvivo-expanded human regulatory T cells prevent the rejection of skin allografts in a humanized mouse model[J].Transplantation,2010,90(12):1321-1327.
[收稿2015-11-30修回2016-02-05]
(编辑许四平)
Effect of chemokine CCL20 and CCL22 combined with skin antigen-induced Treg on survival time of grafted skin
LI Wei,SONG Yun,YE Ai-Zhu,AN Yu,LUO Shu-Lin,LIU Shui-He,YUAN Jun.
Guizhou Provincial People′s Hospital,Guiyang 550002,China
Objective:To study the effect of chemokines CCL20 and CCL22 combined with skin-induced Treg on survival time of grafted skin.Methods: Skin grafting mice were divided into four groups,three mice per group,namely Treg group,Treg+CCL20 group,Treg+CCL22 group and control group.C57BL/6 mice were used as donor and BALB/c as acceptor,and the Treg cells were isolated from the mice induced by skin allograft.After skin grafted,CCL20 and CCL22 were subcutaneous injection every day,which lasted for 10 day.Survival time of skin in each group were observed and recorded.The Treg colonzation experiments were performed as follows.We firstly isolated Treg with Magnetic cell sorting system(MACS) and then labled them with99Tcm .After that we intravenously injected them into the mice.3 hours later,the mice were sacrifced and the radioactivity of organs were detected by GC-2016γ radioimmunoassay counter.Results: ①After Treg treated the survival time of skin grafted in antigen-induced Treg group was signifiantly longer than control group,when treg were cooperated with CCL20 and CCL22,the skin grafted showed more longer survival time than Treg and control groups(P<0.001).②After injection of induced Treg,Treg in autologous and allogeneic skin grafts goups were mainly distributed in autologous and allogeneic skin,accounting for 60% and 98% respectively.When cooperated with CCL20 or CCL22,the Treg were mainly distributed in liver.Conclusion: Chemokines CCL20 and CCL22 synergistically improved the effects of skin antigen induced Treg on survival time of skin graft,which probably related with the Treg colonization into the liver .
Treg;Skin grafting;CCL20;CCL22
10.3969/j.issn.1000-484X.2016.09.015
李伟(1983年-),男,博士,初级检验师,主要从事免疫耐受方面的研究,E-mail: lwcy2010@yeah.net。
及指导教师:袁军(1970年-),女,博士,教授,主要从事器官移植免疫及抗感染免疫方面的研究,E-mail: junyuan99430@163.com。
R392
A
1000-484X(2016)09-1315-04
①本文受贵州省优秀科技教育人才省长专项基金[黔省专合字(2005)144号]资助。
②贵州省贵阳医学院免疫学教研室,贵阳550004。

