脑胶质瘤IDH-1突变的影像学研究进展
王汝佳,沈桂权,高波
脑胶质瘤IDH-1突变的影像学研究进展
王汝佳1,2,沈桂权2,高波1*
异柠檬酸脱氢酶-1 (isocitrate dehydrogenase 1,IDH-1)作为分子标志物在确定脑胶质瘤的分子亚型和进行个体化治疗及判断临床预后方面具有重要作用。IDH-1基因突变与胶质瘤的发生密切相关。作者主要对近年来IDH-1基因突变与脑胶质瘤的影像基因组学的关系作一综述,期望能对脑胶质瘤的早期诊断、治疗和预后有所帮助。
异柠檬酸脱氢酶;基因突变;胶质瘤;磁共振成像
ACKNOWLEDGMENTS The project is supported by the Natural Science Foundation of Shandong Province (No. ZR2014HL084).
王汝佳, 沈桂权, 高波. 脑胶质瘤IDH-1突变的影像学研究进展. 磁共振成像, 2016, 7(9): 711-715.
1 IDH-1概述
IDH-1/2基因突变首次被Parons等[5]报道,在组织学分型中的继发性胶质母细胞瘤、少突胶质细胞瘤和混合少突胶质细胞瘤中将近存在50%~80%的IDH-1/2基因突变。有研究发现:IDH-1在Ⅱ、Ⅲ级星形细胞瘤和少突胶质细胞瘤发生突变的几率约为50%~90%,但是在原发性胶质瘤和毛细胞型星形细胞瘤中很少发生此现象。此外,在胶质瘤中IDH-1突变和IDH-2的突变是同时发生的,只是IDH-1突变比较常见。在2008年,研究者们在癌症基因组测序计划中发现了IDH-1基因突变与脑胶质瘤的联系[5]。在2010年,Verhaak等[6]做了一个具有重大意义的对癌症基因组图谱(TCGA)的分析报告,以血小板源性受体(PDGFRA)、异柠檬酸脱氢酶-1 (IDH-1)、表皮生长因子受体(EGFR)和Ⅰ型神经纤维瘤(NF1)为根据,把脑胶质瘤分成了四个清晰的分子亚型,将其中与IDH-1基因有关的肿瘤命名为神经元前型胶质瘤。这些发现对胶质瘤,尤其是恶性胶质瘤的治疗和预后具有重要的意义。IDH-1异柠檬酸脱氢酶的体细胞突变在低级别胶质瘤(WHOⅡ~Ⅲ级)和继发性胶质瘤被发现,IDH-1突变是胶质瘤发生过程中重要的基因突变事件[7],在肿瘤生长的分子学、遗传学和临床预后方面有着深远的影响[8-9]。
IDH-1基因突变同时也在其他的疾病中被发现,包括髓性白血病、T细胞淋巴瘤[10]、内生软骨肉瘤、内生软骨瘤和胆管细胞癌[11]。在多种癌症中对IDH-1基因突变的识别表明了这种突变在肿瘤的形成过程中是存在的。
2 IDH-1基因在脑胶质瘤中的突变机制
恶性脑胶质瘤最原始的基因突变是IDH-1基因突变,即大部分癌变组织中的恶变细胞内发生了IDH-1基因突变。IDH-1突变破坏了异柠檬酸脱氢酶的亲和力,使该酶与底物结合的能力急剧下降,并且突变型IDH-1能够与野生型IDH-1相互激烈地竞争底物,突变型IDHl-1与底物结合形成二聚体,进而使得 IDHl-1的活性降低,最终α-酮戊二酸(α-ketoglutarate,α-KG)生成量大幅度下降。一系列的改变使得脯氨酸羟基化酶活力被降低,增加了细胞缺氧诱导因子(hypoxia-mducible factor,HIF) 的稳定活性,HIF信号通路被激活,最后导致了肿瘤的生长。当IDH-1突变时,NADPH依赖性的还原反应被催化,使得α-KG变成2-羟基戊二酸(2-bydroxyglutarate,2-HG)。研究发现:精氨酸发生突变成为组氨酸时,活性基团的残基的结构就会产生明显的改变,这个反应与异柠檬酸氧化脱羧反应极为相似,进而使得α-KG转化生成了2-HG。如果2-HG积累过多,就会增加在代谢异常的人群中患脑部恶性肿瘤的几率。异柠檬酸脱氢酶突变后生成代谢废物2-HG,通常情况下2-HG在人体正常细胞中的含量并不高,但是累积过量的话就会使得正常细胞转化为恶性细胞,进而促进肿瘤的发生(图1)。
哈佛大学麻省总医院Flavalan等[12]的最新研究表明,IDH突变能干扰染色体拓扑结构,促进促癌基因表达。
3 IDH-1突变与影像学特征的联系
有研究表明,2-羟基戊二酸可以作为IDH-1是否突变的最佳的生物标志物。2-羟基戊二酸作为监测IDH-1是否突变的中间代谢产物,可以通过二维关联能谱法(2D correlation spectroscopy,COSY)在体内直接测出,同时二维关联能谱法利用二次正交化学位移维度解决了在波谱中重叠的各种代谢产物的信号,避免了常规波谱中拟合算法所导致的假阳性结果,从而能更有利于通过检测2-羟基戊二酸来判断IDH-1基因突变与否[13]。
最近有研究分析了IDH-1表型和肿瘤的位置以及MRI特征的关系。尤其发生于颅内不同的部位,比如功能性或非功能性的脑叶,还有大脑皮层或者深部脑组织,这些因素可能给外科手术带来不同程度的影响,而且相应地影响患者的预后。术前MRI特征包括肿块的边界清楚或者模糊、信号强度均匀或者不均匀以及强化的不同程度等情况,导致了肿块的不同程度地切除和残余肿块的大小,产生了不同的预后。
IDH-1表型和脑胶质瘤位置关系:有数据清楚的表明IDH-1表型(IDH-1突变型和IDH-1野生型)和脑胶质瘤之间的位置存在联系。此外,在分析患者发生肿瘤的脑叶分布中,发现IDH-1突变型脑胶质瘤通常情况下位于一侧脑叶,比如额叶、颞叶或者小脑,然而IDH-1野生型脑胶质瘤好发于脑叶结合部位,比如间脑或者脑干。同时通过对外科手术风险的研究,IDH-1突变型脑胶质瘤几乎不位于外科手术术中和术后所显示出的高死亡率的脑部区域,比如间脑和脑干,而是位于肿块能被容易切除的非功能性和功能性的区域。
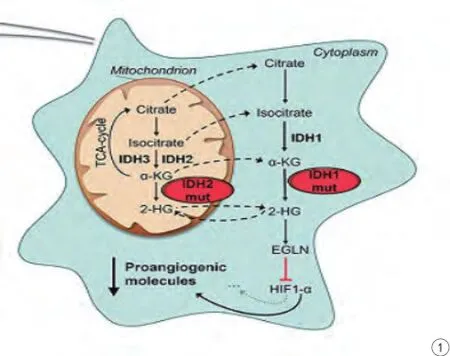
图1 IDH-1突变机制(Kickingereder P, Sahm F, Radbruch A, et al. IDH mutation status is associated with a distinct hypoxia/angiogenesis transcriptome signature which is non-invasively predictable with rCBV imaging in human glioma. Sci Rep, 2015, 5: 16238.)在与IDH突变相联系的癌症中获得神经性的行为所生产的2-羟基戊二酸(2-HG)。2-HG增强EgLN活动性使得标记缺氧诱导因子HIF1A长链和蛋白酶体降解,与野生型相比,IDH-1突变型使得HIF1A活动减少。Fig. 1 The mechanism of IDH-1 mutation (Kickingereder P, Sahm F, Radbruch A, et al. IDH mutation status is associated with a distinct hypoxia/angiogenesis transcriptome signature which is non-invasively predictable with rCBV imaging in human glioma. Sci Rep, 2015, 5: 16238). Mutations in cancer associated with IDH acquire neoactivity producing 2-hydroxyglutarate (2HG). 2HG potentiates EglN activity that mark the hypoxia inducible factor HIF1A for polyubiquitylation and proteasomal degradation, leadingto decreased HIF1A activation in IDH mutant tumors, compared with their wild-type counterparts.
IDH-1表型和MRI特点的联系:具有IDH-1突变的胶质瘤在MRI上更加倾向于单侧的生长方式,病灶的边缘比较锐利,信号强度较均匀,几乎没有强化。这些研究结果表明了具有IDH-1突变的胶质瘤患者生存期的延长主要是与肿瘤的位置和MRI特点所对应的其低度侵略性的生物学行为有关[14]。脑胶质瘤的位置和MRI特点是重要的预后因素并且肿瘤的位置决定了肿瘤的可切除性。最近,Ellingson等[15]报道了IDH野生型Ⅱ级胶质瘤优先位于额叶、颞叶、岛叶区域并且肿块体积较大,因此,肿瘤在MRI上显示的浸润生长方式,需要减少外科手术的切除范围。还有研究发现,IDH-1突变的肿瘤好发于额叶而且肿瘤细胞临近脑室下区。用标准的MRI特征可以预测IDH-1的表达状态。在DTI中,利用各向异性分数FA和表观弥散系数ADC可以在星形细胞胶质瘤中监测IDH-1 R132H的突变情况[16]。在胶质瘤患者中,由于肿瘤区域的白质遭到巨大的破坏,进一步导致了神经元细胞以及神经纤维的数量减少,从而使得 FA值降低[17]。随着年龄上升,IDH-1突变减少,肿瘤更容易长在岛叶并且 1p/19q均表现为阴性。此外,Naeini等[18]发现由间质细胞构成的胶质母细胞瘤的分子亚型,是在所有的四种分型中预后最不好的。他们回顾性分析了46例脑胶质瘤患者的数据,通过比较微阵列的信息和确定的对比增强的体积,中央的坏死体积,T2/FLAIR的高信号, T2/FLAIR体积的比值,发现在间质和非间质细胞构成的胶质母细胞瘤中对比增强的体积和坏死体积显著不同。这项研究强调了体积比可以作为由间质细胞构成的胶质母细胞瘤亚型的生物标记物。
4 IDH-1靶向治疗及预后
通过研究证实IDH-1在恶性胶质瘤中是广泛存在的,所以IDH-1突变可以作为潜在的治疗靶点。在对20661个编码蛋白基因测序分析中发现大约12%的GBM患者发生IDH-1突变,IDH-1野生型的生存期明显短于IDH-1突变型的生存期[5]。已经有研究发现:使用小干扰RNA(small interfering RNA,siRNA)基因沉默可以提高GBM的治疗效果。通过使用siRNA和小分子抑制剂,可以抑制α-KG的生成,使得IDH-1突变胶质瘤细胞的生长率下降。还有研究发现,IDH-1基因突变使得α-KG降低,进而使HIF信号通路被激活,最终阻碍了肿瘤细胞的生成。所以α-KG衍生物将可以促进治疗IDH-1突变型胶质瘤药物的研究。由此可见在胶质瘤的治疗方面,IDH-1突变能够提供潜在的治疗靶点[19]。Pope等[20]是研究非侵入性的IDH-1基因突变者之一。他们选取了27个脑胶质母细胞瘤的患者,利用层析法和大量的光谱学进行分析,对患者已经切除的组织进行了2-HG水平的检测发现通过MRS在患者体内检测到的突变型IDH-1要比野生型IDH-1的2-HG水平高很多。由此得出结论:通过MRS对2-HG水平的检测可以提供一种方法,在IDH-1突变型患者中可以使用分子抑制剂来对患者进行相应的治疗。
大量回顾性研究和前瞻性研究表明,IDH-1突变和胶质瘤患者较长的生存期是有联系的[21]。IDH-1基因突变是预后评估的重要参考指标,已经被国内外研究证实并被Cochrance数据库引用[22]。Jain等[23]将肿瘤血容量和患者的生存率联系起来,并且和脑胶质细胞瘤的分子亚型相关联。他们从癌症基因存档的TGCA-GBM中选取了50例患者,这些患者已经进行了动态磁敏感T2加权灌注检查。研究者直接利用了患者的基因组数据,同时,研究者还测量了对比增强和没有强化区域的相对脑血容量(relative cerebral blood volume,rCBV),以患者的基因组数据为基础将患者进行了详细的分类。然后把每一个患者的rCBV的数值和分子的亚型结合起来,对患者的总体生存率(overall survival,OS)格外的感兴趣。尽管发现rCBV的价值在脑胶质瘤的分子水平的分类上没有显著的统计差异,但是无论脑胶质瘤分子的亚型如何,rCBV可以作为强烈的患者的整体生存率的生物标记物。同时,通过利用rCBV可以进一步区分脑肿瘤的复发和放射性坏死[24]。
最近有研究表明,IDH-1基因突变在区分脑胶质瘤的术后复发和假性进展(psudoprogression,PsP)方面有重要的临床意义。PsP并不是肿瘤的进一步发展的结果,而是指通过治疗后的神经组织的反应,特别是在经过一系列的放、化疗后,由于肿瘤组织的坏死和血脑屏障的破坏,在影像上所产生的不真实的现象。其具有以下临床特征:(1) PsP属于影像学诊断;(2) PsP属于治疗相关的反应,与肿瘤的进展无关;(3) PsP在临床方面的症状和体征几乎没有。研究发现,PsP与脑胶质瘤术后复发相比较,PsP的IDH-1基因突变率更高一些[25]。因此,IDH-1突变很可能可以作为判断脑胶质瘤患者PsP的较为可靠的指标。同时,胶质瘤的治疗需要神经外科、放射治疗科、神经肿瘤科、病理科和神经康复科等多学科合作,遵循循证医学原则,采取个体化综合治疗,优化和规范治疗方案,为患者提供精准医疗方案,使患者获得最佳的总生存期(OS)和无进展生存期(PFS),达到提高患者生存质量的目的。
5 展望
影像学的进步提供了必要的探索肿瘤生物形成机制的工具。随着技术的进步,比如不是以Sanger方法为基础的下一代新产品测序,而是以基因组DNA或是RNA作为模板,使得对个体脑胶质瘤的更深入的研究成为可能[26]。比如,这些研究推动了个体化患者的临床管理中的系统性组织活检的发展。此外,这些多元化反应的可能性使得患者在治疗上的选择更加多样化。影像学作为一个飞速发展的学科,帮助我们开启了一个在临床医学和神经科学新的领域。随着“大数据”和“精准医疗”等概念的提出,影像学将会为胶质瘤患者的治疗提供更加个体化方案,同时随着时间的推移影像学将会得到更多的关注[27-30]。
[References]
[1] Ostrom QT, Gittleman H, Fulop J, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2008-2012. Neuro Oncol, 2015, 17(Suppl 4): iv1-iv62.
[2] Elbana MG, Amer AM, Zinn PO, et al. Imaging genomics of Glioblastoma:state of the artbridge between genomics and neuroradiology. Neuroimaging Clin N Am, 2015, 25(1): 141-153.
[3] Zinn PO, Colen RR. Imaging genomics mapping in glioblastoma. Neurosurgery, 2013, 60(suppl 1): 126-130.
[4] Grant R, Kolb L, Moliterno J. Molecular and genetic pathways in glioma: the future of personalized therapeutics. CNS Oncol, 2014, 3(2): 123-136.
[5] Parsons DW, Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma multiforme. Science, 2008, 321(5897): 1807-1812.
[6] Verhaak RG, Hoadley KA, Purdom E, et al. Integrated genomic analysis identifies clinically relevant subtypes of gliomastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1. Cancer Cell, 2010, 17(1): 98-110.
[7] Albert L, Samir K, Pope WB, et al. Evidence for sequenced molecular evolution of IDH1 mutant glioblastoma from a distinct cell of origin. J Clin Oncol, 2011, 29(34): 4482-4490.
[8] Sevin T, Daniel R, Anuj G, et al. IDH1 mutation is sufficient to establish the glioma hypermethylator phenotype. Nature, 2012, 483(7390): 479-483.
[9] Leu S, Felten SV, Frank S, et al. IDH/MGMT-driven molecular classifcation of low-grade glioma is a strong predictor for long-term survival. Neuro Oncol, 2013, 15(4): 469-479.
[10] Cairns RA, Javeed I, Can K, et al. IDH2 mutations are frequent in angioimmunoblastic T-cell lymphoma. Blood, 2012, 119(8): 1901-1903.
[11] Wang P, Dong Q, Zhang C, et al. Mutations in isocitrate dehydrogenase 1 and 2 occur frequently in intrahepatic cholangiocarcinomas and share hypermethylation targets with glioblastomas. Oncogene, 2013, 32(25): 3091-3100.
[12] Flavalan WA, Drier Y, Liau BB, et al. Insulator dysfunction and oncogene activation in IDH mutant gliomas. Nature, 2016, 529(7584): 110-114.
[13] Andronesi OC, Otto R, Elizabeth G, et al. Detection of oncogenic IDH1 mutations using magnetic resonance spectroscopy of 2-hydroxyglutarate. J Clin Invest, 2013, 123(9): 3659-3663.
[14] Song T, Lei Y, He Z, et al. Isocitrate dehydrogense mutation is associated with tumor location and magnetic resonance imaging characteristics in astrocytic neoplasms. Oncology Letters, 2014, 7(6): 1895-1902.
[15] Ellingson BM, Lai A, Harris RJ, et al. Probabilistic radiographic atlas of glioblastoma phenotypes. Am J Neuroradiol, 2013, 34(3): 533-540.
[16] Tan WL, Huang WY, Yin B, et al. Can diffusion tensor imaging noninvasively detect IDH1 gene mutations in astrogliomas? A retrospective study of 112 cases. Am J Neuroradiol, 2014, 35(5): 920-927.
[17] Hu HB, Liu PF. Application of magnetic resonance diffusion tensor imaging and fiber tractography to evaluate the value of diagnostic classifcation of cerebral gliomas. Chin J Magn Reson Imaging, 2011,2(2): 118-122.胡鸿博, 刘鹏飞. 磁共振弥散张量成像及纤维束成像对脑胶质瘤分级的诊断价值. 磁共振成像, 2011, 2(2): 118-122.
[18] Naeini Km, Pope WB, Cloughesy TF, et al. Identifing the mesenchymal moclecular subtype of glioblastoma using quantitative volumetric analysis of anatomic magnetic resonance images. Neuro Oncol, 2013, 15(5): 626-634.
[19] Yang F, Wen WH, Zhang JN. Mutation of isocitrate dehydrogense 1/2 and glioma. Chin J Neurosurg Dis Res, 2013, 12(5): 478-480.杨帆, 温伟红, 张剑宁. 异柠檬酸脱氢酶1/2突变与胶质细胞瘤的发生.中华神经外科疾病研究杂志, 2013, 12(5): 478-480.
[20] Pope WB. Genomics of brain tumor imaging. Neuroimaging Clin N Am, 2015, 25(1): 105-119.
[21] Zou P, Xu HT, Chen P, et al. IDH1/IDH2 mutation defne the prognosis and molecular profle of patients with glioma: a meta-analysis. PLoS One, 2013, 8(7): 1-7.
[22] Zhou LF, Mao Y, Wang RZ, et al. The diagnosis and treatment guide in glioma of central nervous system. Natl Med J China, 2016, 96(7): 485-509.周良辅, 毛颖, 王任直, 等. 中国中枢神经系统胶质瘤诊断和治疗指南. 中华医学杂志, 2016, 96(7): 485-509.
[23] Jain R, Possion L, Narang J, et al. Genomic mapping and survival prediction in glioblastoma :molecular subclassifcation strengthened by hemodynamic imaging biomarker. Radiology, 2013, 267(1): 212-220.
[24] Cheng JL, Yang T. Application and development of magnetic resonance imaging. Chin J Magn Reson Imaging, 2014, 5(增刊): 62-67.程敬亮, 杨涛. 磁共振成像在脑胶质瘤中的应用及进展. 磁共振成像, 2014, 5(Suppl): 62-67.
[25] Li H, Lu YT, Qi ST, et al. The association of pathological type、IDH-1 mutation and MGMT promoter methylation status on “pseudoprogress” of anaplastic gliomas. J Jinan University (Med Edit), 2013, 34(2): 154-159.李宏, 陆云涛, 漆松涛, 等. 病理类型、IDH-1突变和MGMT启动子甲基化状态与间变性胶质瘤假性进展的相关性. 暨南大学学报(医学版), 2013, 34(2): 154-159.
[26] Zinn PO, Mahmood Z, Elbanan MG, et al. Imaging genetics in gliomas. Cancer J, 2015, 21(3): 225-234.
[27] Gutaman DA, Cooper LA, Hwang SN, et al. MR imaging predictors of mocecular profle and survial:multi-institutional study of the TGCA glioblastoma data set. Radiology, 2013, 267(2): 560-569.
[28] Colen RR, Vangel M, Wang J, et al. Imaging genomic mapping of an invasive MRI phenotype predicts patient outcome and metablic dysfunction: a TCGA glioma phenotype research group project. BMC Med Genomics, 2014, 7(1): 1-27.
[29] Colen RR, Wang J, Singh SK, et al. Glioblastoma: imaging genomic mapping reveals sex-specific oncogenic associations of cell death. Radiology, 2015, 275(1): 215-227.
[30] Nicolasjilwan M, Hu Y, Yan C, et al. Addition of MR imaging feature and genetic biomarlers strengthens glioblastoma survival prediction in TGCA patients. J Neuroradiology, 2015, 42(4): 212-221.
The advanced imaging of IDH-1 mutation in gliomas
WANG Ru-jia1,2, SHEN Gui-quan2, GAO Bo1*
1Department of Radiology, Yantai Yuhuangding Hospital, Yantai 264000, China
2Department of Radiology, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China
*Correspondence to: Gao B, E-mail: gygb2004@163.com
Isocitrate dehydrogenase 1 (IDH-1) would act as a biomarker which plays a key role in determining the molecular subtypes of gliomas and individualized treatment and prognosis. More and more studies show that IDH-1 mutation is closely associated with gliomas. This paper will review the relationship between IDH-1 mutationand imaging genomics ingliomas, Hopefully it is useful to the early diagnosis, therapy 5 and outcome of gliomas.
Isocitrate Dehydrogenase; Genetic mutation; Glioma; Magnetic resonance imaging
25 Mar 2016, Accepted 30 May 2016
山东省自然科学基金 (编号:ZR2014HL084)
1.烟台毓璜顶医院影像科,烟台264000
2.贵州医科大学附属医院放射科,贵阳 550004
高波,E-mail:gygb2004@163.com
2016-03-25
接受日期:2016-05-30
R445.2;R730.264
A
10.12015/issn.1674-8034.2016.09.016
胶质瘤是中枢神经系统(central nervous system,CNS)最常见的肿瘤,以恶性胶质瘤更为常见。通过美国脑肿瘤注册中心(Central Brain Tumor Registry of the United States,CBTRUS)研究发现,在中枢神经系统肿瘤中胶质瘤的比例大约为27%,约占恶性肿瘤的80%;在原发恶性中枢神经系统肿瘤中,胶质母细胞瘤(glioblsatoma multiform,GBM)(WHO Ⅳ级)的发病率最高,占46.1%,约为3.20/10万,男性多于女性;其次是弥漫性星形细胞瘤,发病率为0.53/10万[1]。国内对大范围的胶质瘤流行病学的研究相对较少;个体的遗传特征和外在环境的影响导致了胶质瘤的发生。目前对于胶质瘤的发病机理仍在探讨中,众所周知的是大量外在的电离辐射和基因的突变。由于胶质瘤具有高度的侵袭及增殖能力,预后常表现为高复发率和低生存率的特征,仅仅依赖WHO的分型已经不能满足临床上对胶质瘤的治疗需求。近年来,随着功能影像学的发展,对脑胶质瘤的研究已经深入到影像基因组学和遗传学方面。影像基因组学(imaging genomics)是临床科学中的一个全新的领域,它能够建立起放射影像学特征和脑胶质瘤的基因表型之间的具体的双向联系[2-3]。通过大量的研究,人们发现了一系列与胶质瘤发生、发展有密切联系的基因,包括:异柠檬酸脱氢酶-1 (isocitrate dehydrogenase1,IDH-1)、06-甲基鸟嘌呤-DNA-甲基转移酶(06-methylguanine-DNA methyhransferase,MGMT)、微小RNA (MicroRNA,miRNA)、染色体lp/19q、表皮生长因子受体(epidermal growth factor receptor,EGFR)等[4]。而影像学检查结果整合基因型信息能帮助识别脑肿瘤发病相关的候选基因功能,将影像学表现作为内在表型探讨脑胶质瘤基因突变已被大量研究证明是可行的。其中以IDH-1基因突变较为显著,笔者就IDH-1基因突变与脑胶质瘤影像基因组之间的联系作一综述。

