缺血性卒中氯吡格雷治疗后病情进展与CYP2C19基因多态性的关系
翟万庆,杨丽娟,宋丽艳,周亦
(太仓市第一人民医院,江苏太仓215400)
缺血性卒中氯吡格雷治疗后病情进展与CYP2C19基因多态性的关系
翟万庆,杨丽娟,宋丽艳,周亦
(太仓市第一人民医院,江苏太仓215400)
目的探讨缺血性卒中患者服用氯吡格雷短期内卒中进展与CYP2C19基因多态性的关系。方法 对280例缺血性卒中患者24 h内予以氯吡格雷联合阿司匹林治疗(首日氯吡格雷给予负荷量),根据卒中是否进展分为非进展组及进展组,同时通过基因芯片对两组患者的CYP2C19基因型进行检测。结果非进展组232例,进展组48例;两组生活方式、病史及血脂水平比较无统计学差异(P均>0.05)。非进展组CYP2C19*1等位基因频率及*1/*1基因型频率高于进展组(P均<0.05),CYP2C19*2等位基因频率及*2/*3基因型频率低于进展组(P均<0.05) 。两组CYP2C19基因代谢类型比较亦有统计学差异(P<0.05)。结论 缺血性卒中患者服用氯吡格雷短期内卒中进展与CYP2C19基因多态性有关。
CYP2C19基因;氯吡格雷;基因多态性;进展性缺血性卒中
临床普遍认为,缺血性卒中急性期患者的有效治疗方法是抗血小板治疗[1],其常用的治疗药物包括阿司匹林、氯吡格雷和西洛他唑。研究发现,双联抗血小板治疗优于单药治疗[2,3],但具体机制依然不够清晰。作为主要治疗药物之一的氯吡格雷,临床应用中存在一个显著缺陷是氯吡格雷抵抗[4,5],部分患者在长时间使用氯吡格雷后仍存在着卒中复发的风险。目前研究发现,氯吡格雷抵抗现象的发生与患者CYP2C19基因多态性有关。为此,本研究通过对非心源性缺血性脑卒中短期内进展患者与非进展的患者CYP2C19基因型检测,探讨该类患者服用氯吡格雷后短期内复发与CYP2C19基因多态性的关系。
1 资料与方法
1.1 临床资料 收集2015 年7 ~12 月太仓市第一人民医院神经内科被诊断为缺血性卒中患者280例,男148例、132例,年龄(68.6±8.68)岁。入选标准:①经颅脑CT或MRI被诊断为缺血性脑血管病的患者,脑出血患者除外;②发病时间在24 h以内;③ TOAST分型示大动脉粥样硬化型。排除标准:①TIA患者;②进入昏迷期或存在生命体征不稳定者;③心、肾、肝功能存在严重障碍患者;④血小板计数<100×109/L或>450×109/L患者;⑤存在凝血功能障碍的患者;⑥对阿司匹林等药物过敏及存在哮喘过敏史者;⑦存在脑卒中并发症患者;⑧近期进行过支架手术患者、非Q波型心肌梗死患者以及不稳定型心绞痛患者。
1.2治疗及分组发病24 h内,首先给予氯吡格雷联合阿司匹林连续用药治疗14 d(首日氯吡格雷使用最大剂量为300 mg,随后给予75 mg/d,同时联合阿司匹林100 g/d,治疗一周后,给予氯吡格雷单药治疗75 mg/d)。治疗期间患者不得抽烟喝酒,不得使用任何镇静催眠类药物、质子泵抑制剂、抗真菌药物、抗抑郁药物、抗癫痫药物及其他抗血小板药物。采用美国国立卫生研究所卒中量表(NIHSS)对缺血性卒中患者入院第7天进行NIHSS评分,根据患者病情是否进展分为进展组与非进展组。
1.3CYP2C19基因型测定采用CYP2C19基因芯片检测系统(苏州旷远生物分子技术有限公司)进行CYP2C19基因型测定。提取患者全血DNA,PCR扩增目的基因,芯片杂交显色,放大芯片上的色斑显色信号;利用基因芯片图像分析软件Array Doctor V2.0对其结果进行扫描,自动判断给出CYP2C19的基因型信息,同时通过设立阳性和阴性对照控制其检测质量。以上步骤严格按照仪器操作规范及试剂盒说明书执行。

2 结果
2.1两组生活方式、病史及血脂水平比较 280例患者中,有48例入院后7 d内病情加重,NIHSS评分增加≥1分,确定为病情进展(为进展组),余232例为非进展组。两组生活方式、病史及血脂水平比较无统计学差异(P均>0.05)。见表1、表2。

表1 两组生活方式及病史情况比较[例(%)]
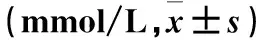
表2 两组血脂水平比较
2.2两组CYP2C19基因型分布及等位基因频率比较见表3。
2.3两组CYP2C19基因代谢类型的比较 280例患者根据CYP2C19基因类型进行代谢分型。仅携

表3 两组CYP2C19基因型分布及等位基因频率比较
带野生型等位基因的CYP2C19*1/*1称为快代谢型(EM)136例(占48.6%),携带一种无功能等位基因的CYP2C19*1/*2或 CYP2C19*1/*3称为中代谢型(IM)123例(占43.9%),携带2个无功能等位基因的称为慢代谢型(PM)21例(占7.5%)。两组代谢类型构成比较见表4。
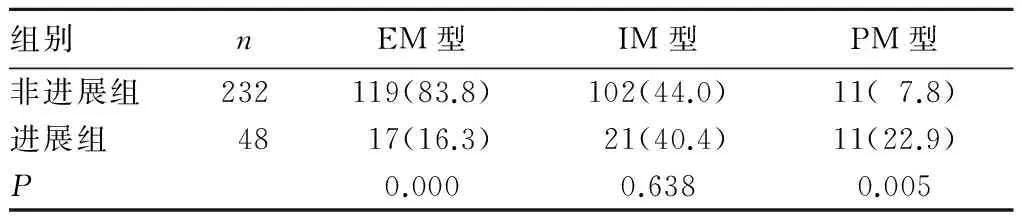
表4 两组CYP2C19基因代谢类型构成比较[例(%)]
3 讨论
目前,对进展性缺血性卒中的定义,医学界尚无统一标准[6]。本文对于缺血性卒中进展的评估采用NIHSS评分标准,即入院后7 d内患者病情加重,NIHSS评分增加≥1分。非心源性缺血性卒中的二级预防中,抗血栓治疗的主要药物是阿司匹林[7]。在发病48 h内对急性卒中患者进行阿司匹林治疗,可以降低卒中的复发率和病死率[8]。但是,该方法只能使1/5的卒中患者避免复发。近年来,氯吡格雷已经被广泛用于急性缺血性卒中的二级预防,但其治疗效果在不同个体之间存在较大差异。进一步研究发现,阿司匹林、氯吡格雷联合抗血小板治疗可显著降低心脏缺血的风险[8,9]。但是,以上联合用药治疗及预防卒中的疗效究竟如何尚不明确[10]。本文采用氯吡格雷联合阿司匹林治疗的方法(氯吡格雷首日最大剂量为300 mg,从第2天开始改为75 mg/d+阿司匹林100 g/d)观察预防缺血性卒中进展发生的疗效,结果显示280例缺血性脑卒中有48例发生了进展,发生率为17.1%;而82.9%的患者未发生缺血性脑卒中病情进展。这就说明较早使用阿司匹林、氯吡格雷联合抗血小板治疗可降低卒中进展的发生率。
近期研究发现,不同个体之间氯吡格雷的抗血小板作用存在差异。虽然有些患者遵照医嘱,长期服用常规剂量的氯吡格雷,但临床观察发现该治疗方案预防动脉粥样硬化血栓的效果仍然十分有限,不少学者将这一状况称之为氯吡格雷抵抗[11],即采用氯吡格雷常规治疗(最大负荷量300 mg,之后维持量为75 mg/d)并不能有效地抑制血小板的聚集能力,对避免卒中缺血性事件的发生效果甚微。近年研究显示,氯吡格雷抵抗与患者CYP2C19基因多态性有关[12]。本研究中,卒中未进展组CYP2C19*1等位基因频率及*1/*1基因型频率高于进展组,YP2C19*2等位基因频率及*2/*3的基因型频率低于进展组,提示编码CYP2C19*1的基因由野生型突变为CYP2C19*2和CYP2C19*3是导致缺血性脑卒中复发的原因之一。CYP2C19*1等位基因在患者对氯吡格雷代谢过程中起着重要作用,而CYP2C19*2和CYP2C19*3则是无功能的等位基因,这与氯吡格雷抵抗有关。CYP2C19*2型为CYP2C19基因第5外显子681G>A点突变,导致剪接缺陷;CYP2C19*3型为第4外显子636G>A点突变,提前产生终止密码子。这些点的突变导致CYP2C19基因编码的酶活性丧失,从而减弱处理代谢底物的能力。氯吡格雷可以在EM型的带动下很好地转化为活性代谢产物,从而更好地发挥抗血小板作用,而PM型则相反。本研究表明,卒中未进展组EM型患者明显多于进展组,PM型明显少于进展组。由于CYP2C19基因多态性的客观存在,即使患者在发生首次卒中后能够遵医嘱服用相同剂量和相同疗程的氯吡格雷,也仍然会造成缺血性脑卒中患者对氯吡格雷的代谢强度的差异,进而使得缺血性脑卒中短期内进展发生率存在差异。因此缺血性脑卒中患者服用氯吡格雷的同时,进行CYP2C19等位基因的检测显得尤为重要。根据不同的代谢类型合理使用氯吡格雷,可以大大提升缺血性脑卒中二级预防的效果。
[1] Harbison JW.Clinical considerations in selecting antiplatelet therapy in cerebrovascular disease[J].Am Health Syst Pharm,1998,55(19):17-20.
[2] Wong KS,Chen C,Fu J,et al.Clopidogrel plus aspirinversus aspirin alone for reducing embolisation in patients with acute symptomatic cerebral or carotid artery stenosis(CLAIR study):randomised,open-label,blinded-endpoint trial[J].Lancet Neurol, 2010,9(5):489-497.
[3] Markus HS,Droste DW,Kaps M,et al.Dual antiplatelet therapy with clopidogrel and aspirin in symptomatic carotid stenosis evaluated using doppler embolic signal detection:the clopidogrel and aspirin for reduction of emboli in symptomatic carotid stenosis(CARESS) trial[J].Circulation, 2005,111(17):2233-2240.
[4] Hochholzer W,Trenk D, Frundi D, et al.Time dependence of platelet inhibition after a 600-mg loading dose of clopidogrel in a large,unselected cohort of candidates for percutaneous coronary intervention[J].Circulation, 2010,56(18):2560.
[5] Buonamici P, Marcucci R, Migliorini A, et al.Impact of platelet reactivity after clopidogrel administration on drug-eluting stent thrombosis[J]. J Am Coll Cardiol, 2007,49(24):2312-2317.
[6] Delaney JT, Ramirez AH, Bowton E,et al.Predicting ciopidogrel response using DNA samples linked to an electronic health record [J].Clin Pharmacol Ther,2012,91(2):257-263.
[7] Antithrombotic TC.Collaborative meta-analysis of randomized trials of antiplatelet therapy for prevention of death,myocardial infarction,and stroke in high risk patients[J]. BMJ,2004,324(7329):71-86.
[8] Yusuf S,Zhao F,Mehta SR,et a1.Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation[J].N Engl J Med, 2001,345(7):180.
[9] Diener HC,Bogousslavsky J,Brass LM,et al.Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients(MATCH):randomised,double-blind,placebo-controlled trial[J].Lancet,2004,364(9431):331-337.
[10] Kennedy J,Hill MD,Ryckborst KJ,et a1.Fast assessment of stroke and transient ischaemic attack to prevent early recurrence (FASTER):a randomized controlled pilot trial[J].Lancet Neurol, 2007,6(11):961-969.
[11] Hochholzer W,Trenk D,Frundi D,et al.Time dependence of platelet inhibition after a 600 mg loading dose of clopidogrel in a large,unselected cohort of candidates for percutaneous coronary intervention[J].Circulation, 2010, 56(18):2560.
[12] Laine M,Armero S,Peyrol M, et al.Clinical impact of genetically determined platelet reactivity[J].J Cardiovasc Transl Res, 2013,6(3):398-403.
10.3969/j.issn.1002-266X.2016.33.030
R743.32
B
1002-266X(2016)33-0083-03
2016-04-23)

