慢性B淋巴细胞增殖性疾病的病理学及免疫表型特征分析
张会超,何芳,贾晓云,陈砚凝,李宏,丁雅雯,张红,王芃堉, 高社军
(1河北医科大学第四医院,石家庄050011;2邢台市威县中医院)
慢性B淋巴细胞增殖性疾病的病理学及免疫表型特征分析
张会超1,何芳2,贾晓云1,陈砚凝1,李宏1,丁雅雯1,张红1,王芃堉1, 高社军1
(1河北医科大学第四医院,石家庄050011;2邢台市威县中医院)
目的探讨慢性B淋巴细胞增殖性疾病(B-CLPD)的病理学和免疫表型特征,提高对此类疾病的认识。方法 回顾性分析61例B-CLPD患者的临床资料,包括慢性淋巴细胞白血病(CLL)43例、套细胞淋巴瘤(MCL)9例、淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(LPL/WM)4例、脾边缘区淋巴瘤(SMZL)3例、毛细胞白血病(HCL)2例。61例B-CLPD患者均进行了骨髓细胞形态学及流式细胞免疫表型检测,分析其特征。结果 细胞形态学表现:CLL与MCL均以异常成熟的小淋巴细胞或中等大小的淋巴细胞为主;SMZL为细胞胞核偏位,胞质一侧具有短小的绒毛;LPL/WM的胞核染色质类似淋巴细胞核,其他方面具有浆细胞特征;HCL为胞质丰富,具有纤细和不规则的“毛发样”突起。免疫表型表现:43例CLL患者CD5、CD19、CD23的阳性率分别为97.6%、100%、95.3%;9例MCL患者CD5、CD19、CD20、CD22、FMC7均呈强阳性;4例LPL/WM患者CD19、CD20、CD79a、SIgM阳性率为100%,CD79b阳性率为75.0%,且CD19免疫表型轻链呈限制性表达;2例HCL患者CD19、CD20、CD22、CD79a、CD25、CD11c及CD103均为强阳性,CD5、CD23、CD79b均为阴性;3例SMZL患者CD19、CD20、CD22、CD24、CD79a均为强阳性,而CD5及CD23均为阴性。CLL患者CD23强表达,CD22、CD79b、FMC7弱表达的特征可与MCL患者鉴别。CLL患者淋巴结组织中CD23阳性率较高,MCL患者淋巴结组织中CyclinD1阳性率较高。结论 骨髓细胞形态学及免疫表型对B-CLPD的诊断具有重要意义,对不同类型B-CLPD的精确诊断需要结合细胞形态学、免疫表型和(或)分子遗传学检测综合诊断。
慢性B淋巴细胞增殖性疾病;慢性淋巴细胞白血病;淋巴瘤;骨髓穿刺;免疫表型;流式细胞术
慢性B淋巴细胞增殖性疾病(B-CLPD)是一组以外周血和骨髓中的成熟B淋巴细胞增多为特点的疾病,包括多种生物学特征不同的血液系统肿瘤,如慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤(MCL)、淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(LPL/WM)、毛细胞白血病(HCL)、脾边缘区淋巴瘤(SMZL)等。以往大多将上述各类B-CLPD均诊断为CLL,但由于肿瘤细胞起源不同,各类B-CLPD的治疗方法及预后与CLL存在很大差异,因此进一步明确各类B-CLPD的病理特征及免疫表型,对于B-CLPD的诊断及治疗具有重要意义。我们对2012~2015年收治的61例B-CLPD患者的临床资料进行了回顾性分析,探讨各类B-CLPD的病理学及免疫表型特征。现报告如下。
1 资料分析
1.1临床资料选择2013年1月~2015年12月河北医科大学第四医院收治的有完整骨髓细胞形态学及流式免疫表型资料和部分淋巴结组织病理学及分子生物学资料的B-CLPD患者61例,男37例、女24例,年龄35~95岁、中位年龄63岁。其中CLL 43例、MCL 9例、LPL/WM 4例、HCL 2例、SMZL 3例。61例患者的实验室检查主要指标及临床特征资料见表1、2。

表1 61例不同类型B-CLPD患者实验室检查主要指标
1.2骨髓细胞形态学特点分析对61例B-CLPD患者均行骨髓穿刺涂片检查,采用瑞氏染色法观察各类B-CLPD的骨髓细胞形态学特点。①CLL与MCL:均以异常成熟的小淋巴细胞或中等大小的淋巴细胞为主,核形规则或肾形,染色质呈块状,胞质少,无核仁;另有少量带有明显核仁的幼稚淋巴细胞(副免疫母细胞),核分裂象少见。见插页Ⅱ图3A、B。②SMZL:为细胞胞核偏位,核质比高,可见明显的核仁,胞质一侧具有短小的绒毛为此类细胞的形态学特征。见插页Ⅱ图3C。③LPL/WM:细胞核的染色质结构类似淋巴细胞的核,而其他方面仍具有浆细胞的原有特征(如核偏位、胞质呈泡沫样、核旁淡染区等)。见插页Ⅱ图3D。④HCL:细胞胞质丰富或较丰富,核质比例低,大部分细胞有长短不一、纤细和不规则的“毛发样”突起或油煎蛋样胞核,伴模糊的灰蓝色胞质,无颗粒,胞核比成熟淋巴细胞大,圆形、卵圆形或肾形,多不见核仁或有单个小核仁,染色质比正常淋巴细胞疏松,呈均质性、细致,毛玻璃样,细胞缺乏明显的幼稚性。见插页Ⅱ图3E。
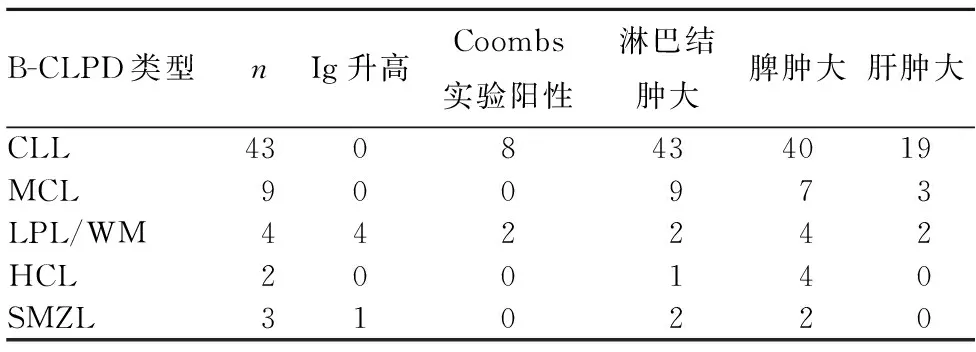
表2 61例不同类型B-CLPD患者主要临床特征(例)
注:LPL/WM中Ig升高的4例均为IgM;SMZL中Ig升高的1例为IgG。
1.3骨髓活检病理特点分析取2例HCL的骨髓活检组织标本行HE染色,光镜下示瘤细胞呈弥漫性片状浸润,高倍镜下瘤细胞形态单一、圆形,胞质丰富、透明,核位于中央,圆形或卵圆形,可见到核折叠,外光呈“荷包蛋”样。银染示骨髓呈弥漫性网状纤维化。
1.4骨髓肿瘤细胞免疫表型分析61例B-CLPD患者均行骨髓流式细胞免疫表型检测, CD20、CD19、CD79a的阳性率均为100%。各类型B-CLPD免疫表型阳性率见表3。根据WHO分型B-CLPD免疫表型积分系统[1],积分4~5分为典型的CLL,积分0~2分为其他类型的B-CLPD。依据61例患者的免疫表型结果,B-CLPD积分4~5分者25例,均符合典型CLL的免疫表型确诊CLL;3分者27例,其中6例具有典型的MCL免疫表型,其余病例不易区分CLL与MCL,后经淋巴结活检病理及其免疫组化和IgH-CCND1融合基因检测,确诊CLL 18例、MCL 3例;0~2分者9例,为其他类型的B-CLPD,其中4例根据骨髓细胞形态学、免疫表型及血清免疫固定电泳确诊LPL/WM,2例根据骨髓细胞形态学、骨髓活检及免疫表型确诊HCL,3例根据骨髓细胞形态学、免疫表型及临床表现确诊SMZL。
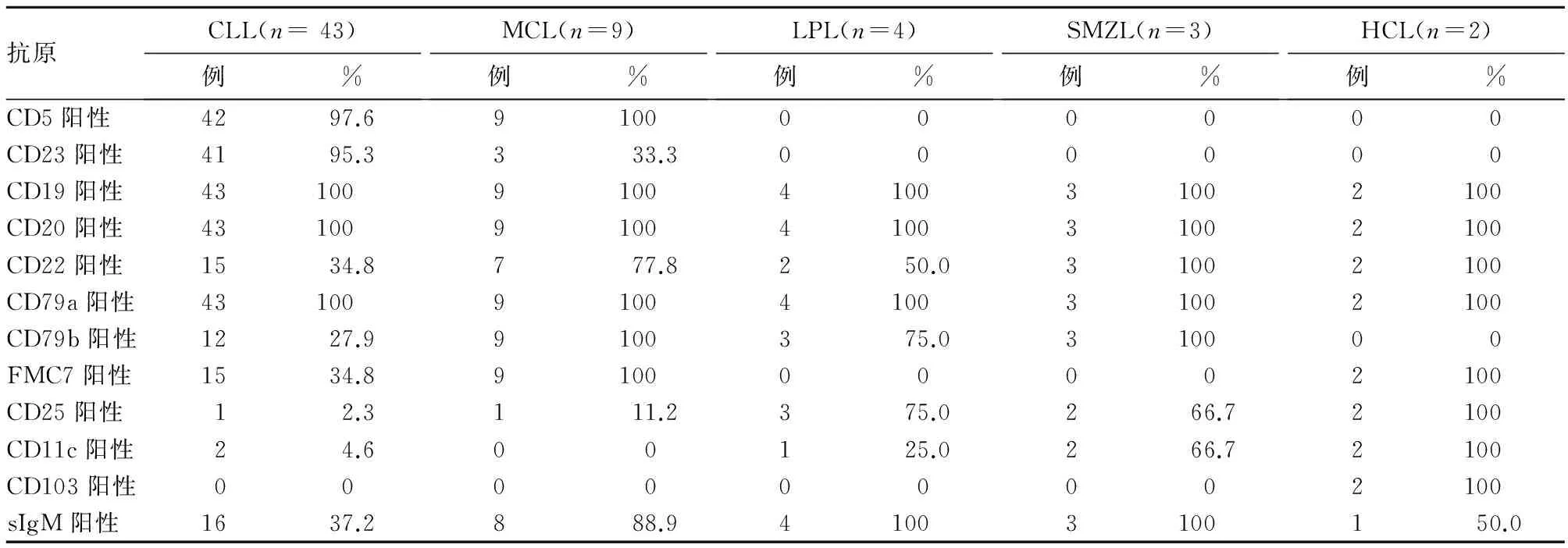
表3 61例B-CLPD患者肿瘤细胞免疫表型阳性率
1.5淋巴结组织病理免疫表型特点对骨髓肿瘤细胞免疫表型积分为3分、不易区分CLL及MCL的27例患者,取肿大淋巴结行HE染色,采用EnVision方法行免疫表型的免疫组化染色,结果示27例患者的CD20、PAX5均为阳性,CD5阳性率较高;CLL及MCL两个类型的患者间CD23、Cyclin D1表达情况存在明显不同,CLL患者CD23阳性率较高,而MCL患者Cyclin D1阳性率较高。见表4。
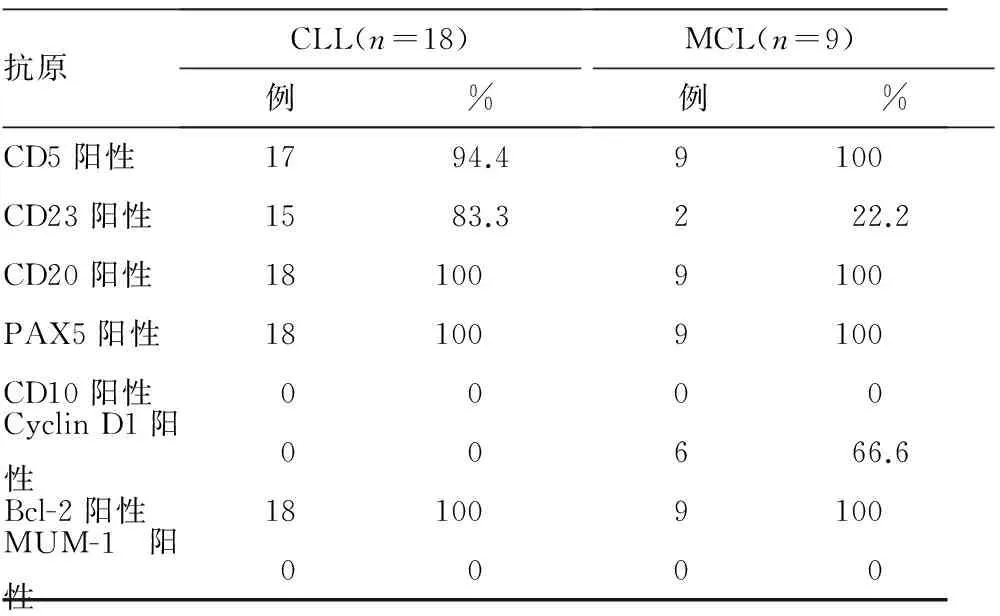
表4 18例CLL及9例MCL患者淋巴结组织病理免疫表型阳性率
1.6 IgH-CCND1融合基因检测 3例因Cyclin D1阴性未确诊者,通过FISH行IgH-CCND1融合基因检测,结果均为阳性,最终确诊为MCL。
1.7血清免疫固定电泳对免疫球蛋白增高的4例LPL/WM及1例SMZL检测血清免疫固定电泳,结果4例LPL /WM显示血清IgM κ型单克隆免疫球蛋白,1例SMZL显示IgG κ型单克隆免疫球蛋白。
2 讨论
B-CLPD是以成熟淋巴细胞克隆性增殖为特征的一组恶性疾病,肿瘤性淋巴细胞除了浸润淋巴组织造成淋巴结、脾脏肿大外,还常累及骨髓和外周血,出现骨髓和外周血中淋巴细胞计数增多,是一组累及骨髓及外周血的B细胞克隆增殖性疾病。除MCL患者外,其它类型的B-CLPD病情进展缓慢,长期无明显症状,部分患者甚至不需要治疗。因此对B-CLPD亚型的正确诊断对治疗有重要意义。
2.1 CLLCLL是B-CLPD中最多见的类型。多数CLL患者无症状或仅有轻微症状,各种指标异常是在进行血液常规检查时偶然发现的。有的患者表现为明显的贫血,这是继发免疫介导的自身免疫性溶血性贫血造成的,是CLL较为常见的并发症[2]。CLL免疫表型的特征为B细胞CD5阳性,同时伴有CD19、CD23的表达,弱表达CD20,膜表面免疫球蛋白(sIg)及CD22弱表达或不表达,不表达CD10,呈Κ轻链或λ轻链型限制性表达[3]。其中CD5、CD19、CD23的共表达是CLL最具特征性的免疫表型,可作为诊断CLL的依据。国外文献报道,CLL患者的CD5阳性表达率超过90%[4],国内报道为78.6%[5]。本组中CLL患者CD5、CD19、CD23的阳性率分别为97.6%、100%、95.3%。
由于CLL与MCL没有绝对特异性标志,两者间的鉴别诊断较困难,依据单一免疫表型难以确诊。研究发现,CD20、CD22强表达是MCL与CLL的主要鉴别点[6,7]。本组中,43例CLL和9例MCL患者的CD19、CD79a、CD20阳性率均为100%,对CLL和MCL的诊断特异性较差,而CLL患者CD23阳性率明显高于MCL患者,CD22、CD79b、FMC7阳性率明显低于MCL患者,尤其是MCL中CD79b、FMC7阳性率均为100%,提示CLL与MCL之间在CD23、CD22、CD79b、FMC7阳性率方面存在较大差异,有助于对CLL及MCL的鉴别诊断。
2.2 MCL MCL的典型免疫表型是CD5阳性、CD19阳性、CD23阴性、FMC7阳性或弱表达,膜表面免疫球蛋白(SIg)限制性强表达,同时CD20、CD22强表达。Gao等[8]报道了21例MCL免疫表型的变异,发现MCL的免疫表型除传统的CD5阳性、CD10阴性、CD23阴性和FMC-7阳性外,还可表现为CD5阴性、CD10阳性、CD23阳性和FMC-7阴性的变异性表达。本组9例MCL患者中,CD5、CD19、CD20、CD22、FMC7均呈强表达,未出现CD5、FMC-7阴性的变异性表达病例。
由于本组9例MCL患者均为免疫表型积分3分者,单纯根据免疫表型仍难以区分CLL与MCL。根据2015年中国慢性淋巴细胞白血病诊断与治疗专家共识[9]建议,对免疫表型积分<4分的患者需要结合淋巴结、脾脏、骨髓组织细胞学及遗传学等进行鉴别诊断。t(11;14)是MCL的特异性遗传学异常,可形成IgH-CCND1融合基因,导致Cyclin D1的高表达,因此t(11;14)及Cyclin D1是对MCL最具鉴别诊断价值的指标[9]。本组中,CLL及MCL患者淋巴结CD23、Cyclin D1表达情况存在明显不同,MCL患者Cyclin D1阳性率较高66.6%,而CLL患者Cyclin D1为阴性,提示淋巴结Cyclin D1表达情况可作为鉴别CLL与MCL的重要参考。本组中,经骨髓细胞免疫表型确定积分为3分的27例患者中,为区分CLL及MCL,我们进一步行淋巴结活检病理学及其免疫表型检测,发现6例Cyclin D1呈阳性表达,确诊为MCL;21例无Cyclin D1阳性表达,对其中18例结合免疫表型确诊为CLL;对剩余的3例Cyclin D1阴性表达未能确诊者,我们又进行了IgH-CCND1融合基因检测,结果均为阳性,从而将该3例患者确诊为MCL,因而最终共确诊9例MCL。
2.3 LPL/WM LPL/WM是一种弥散性B淋巴细胞增殖性疾病,多于老年发病,尽管可累及淋巴结、脾脏和其他部位,但主要累及骨髓,且伴有不同水平的相关性单克隆IgM副蛋白,其细胞成分包括小淋巴细胞、浆样淋巴细胞及浆细胞。典型的LPL/WM骨髓细胞免疫表型表达sIg、CD19、CD20、CD79a、CD79b,不表达CD5、CD10、CD23,且与LPL/WM相关的浆细胞CD19呈阳性,这与多发骨髓瘤的浆细胞表达不同[10]。本组中4例LPL/WM免疫表型CD19、CD20、CD79a、SIgM表达率为100%,CD79b表达率75.0%,且CD19免疫表型轻链呈限制性表达,说明该群浆细胞群属于肿瘤性细胞。
以往LPL/WM是一种排除性诊断,2012年Treon等[11]发现90%的WM患者髓样分子基因MYD88发生了单碱基突变,使其编码的265号氨基酸从亮氨酸变为脯氨酸(L265P),而WM患者的正常组织标本、健康人的外周血B细胞、骨髓瘤标本包括IgM型骨髓瘤中均未检到该突变,边缘区淋巴瘤标本中只有少数检测到该突变。虽然MYD88 L265P突变不是LPL特异性的分子标记,但对LPL的诊断价值具有重要价值。因此,MYD88 L265P突变可为WM的诊断和鉴别诊断提供更准确的依据,使LPL/WM不再是一种排除性的诊断。
2.4 HCL HCL是一种罕见的慢性B-CLPD,临床以全血细胞减少、脾大及周围血和(或)骨髓、脾脏中见毛细胞白血病细胞为特征。典型的细胞形态学特征为胞质周围有绒毛状突起,尤其是当制片良好时,可在细胞膜周围看到毛样突起。但若涂片制作不佳时或骨髓涂片较厚时,其他类型的细胞亦可出现因涂片因素所致的毛发样突起,与真正的毛细胞相似,较难以鉴别。骨髓活检切片在高倍镜下可呈现特征性“荷包蛋”样外观常伴有骨髓纤维化。其流式细胞免疫表型可表达 CD19、CD20、CD22、CD79a、FMC-7。HCL典型的流式免疫表型表达CD11c、CD25和CD103,不表达CD5、CD10和CD79b[12,13],高表达单型性表面Ig。国外文献报道,17%的HCL患者表达CD23,不到5%的病例表达CD5[14,15]。HCL无绝对特异的免疫标记物,需要在形态学检查的基础上综合判断免疫标记物(如CD11c、CD25、CD103等),而其他类型的B-CLPD很少具有这一特征[16~18]。若出现某些不典型免疫表型特点的病例,如表达CD5、CD10,或不表达CD103及CD25的病例,应结合临床特征、骨髓浸润方式以及典型的细胞形态,方可进一步诊断为HCL。本组中,2例HCL患者的流式免疫表型为CD19、CD20、CD22、CD79a、CD25、CD11c及CD103阳性,CD5、CD23、CD79b均为阴性,符合典型HCL的表现。
2.5SMZL SMZL起病隐袭,进展缓慢,通常表现为外周血淋巴细胞计数和(或)比例增高、脾大,而外周浅表淋巴结不大。对该病进行诊断时,因无法行外周淋巴结活检,通常需要做脾脏病理检查得以确诊。但脾脏穿刺活检存在出血风险,患者多不愿意接受诊断性脾脏切除,因此早期诊断较困难,患者就诊时多已为晚期,累及脾、血液和骨髓。确诊时80%以上的SMZL患者可发生白血病转化[19],失去了最佳治疗时机。外周血中出现绒毛细胞亦可见于其它小B细胞淋巴瘤,因此,SMZL与其它小B细胞类淋巴瘤的鉴别诊断需联合临床、形态学、免疫表型,尤其是免疫表型,从而做出正确诊断。SMZL的免疫表型为表达B细胞相关抗原 CD19、CD20、CD22、CD24、CD79a,而CD5及CD23阴性。本组中,3例SMZL患者的免疫表型为CD19、CD20、CD22、CD24、CD79a均阳性,2例CD25及CD11c阳性,而CD5及CD23均为阴性。尽管CD103 抗原表达被视为HCL较为特异的抗体,但有文献报道15%~40%的SMZL患者可存在CD103阳性[20,21]。由此可见,SMZL不具备特异性的免疫表型,但SMZL细胞CD23、CD5、Cyclin D1均为阴性,有助于除外CLL及MCL。
SMZL与LPL/WM的鉴别诊断较困难。研究显示[22],28%的SMZL可出现不同程度的浆细胞分化,并出现单克隆副免疫球蛋白。本组3例SMZL中有1例伴有单克隆副免疫球蛋白,容易与LPL/WM混淆。骨髓穿刺检查细胞形态学对LPL/WM的鉴别诊断有一定的帮助,LPL/WM通常会有相当数量的淋巴样浆细胞浸润骨髓,而SMZL很少出现大量浆样淋巴细胞浸润。因此联合典型的临床表现、细胞形态学特征及免疫表型可对SMZL做出鉴别诊断[23]。
综上所述,流式细胞免疫分型对典型B-CLPD亚型的诊断及鉴别诊断具有重要的意义,对于不典型的B-CLPD可结合病理学、遗传学、分子生物学检查进行诊断与鉴别诊断,从而指导临床治疗及判断预后。
[1] Swerdlow S, Campo E, Harris N, et al.WHO classification of tumor of haematopoietic and lymphoid tissues in 2008:an overview[J]. Pathologica, 2010,102(3):83-87.
[2] Kroft SH, Finn WG, Peterson LC. The pathology of the chronic lymphoid leukaemia[J]. Blood Rev,1995,9(4):234-250.
[3] Moreu EJ, Matutes E, A′Hern RP,et al. Improvement of thechronic lymphocytic leukemia scoring system with the monoclonnalantiboby SN6(CD79b)[J]. Am J Clin Pathol,1997,208 (4):378.
[4] Geisler CH, Larsen JK, Hansen NE, et al. Prognostic importance of flow cytometric imm -unophentyping of 540 consecutive patients with B-cell chronic lymphocytic leukemia[J]. Blood,1991,78(7):1795.
[5] 易莎, 张小斌, 陈燕. 10例慢性淋巴细胞白血病患者免疫表型的研究[J]. 临床血液学杂志, 2010,23(2):86.
[6] Prevodnik VK, Lavrencak J, Horvat M, et al. The predictive significance of CD20 expression in B-cell lymphomas[J]. Diagn Pathol, 2011,6(2):33-39.
[7] Huang J, Fan G, Zhong Y, et al. Diagnostic usefulness of aberrant CD22 expression in differentiating neoplastic cells of B-cell chronic lymphoproliferative disordem from admixed benign B cells in four- color multiparameter flow cytometry[J]. Am J Clin Pathol, 2005,123(6): 826-823.
[8] Gong JZ, Lagoo AS, Peters D, et al. Value of CD23 determination by cytomertry in differenting mantle cell lymphoma from chronic lymphocytic leukemia/small lymphocytic lymphoma[J]. Am J Clin Pathol, 2001,116(6):893-897.
[9] 李建勇,邱录贵. 中国慢性淋巴细胞白血病诊断与治疗专家共识[J].中华血液学杂志, 2016,36(10):809-813.
[10] Morice WG, Chen D, Kurtin PJ, et al. Novel immuophenotypic leatures of marrow lymphoplasmacytic lymphoma and correlation with Waldenstroms macroglobulimemia[J]. Mod Pathol, 2009,22(6):807-816.
[11] Foucar K. Chronic lymphoid leukemias and lymphoproliferative disorders[J]. Mod Pathol, 199,12(2):141-150.
[12] Caruli G, Cannizzo E, Zucca A, et al. CD45 expression in low-grade B-cell non Hodgkin′s lymphomas[J]. Leuk Res, 2008,32(2):263-267.
[13] Jasionowski TM, Hartung L, Greenwood JH, et al. Analysis of CD10+hairy cell leukemia[J]. Am J Clin Pathol, 2003,120(2):228-235.
[14] Treon SP, Xu L, Yang G, et al. MYD88 L265P somatic mutation in waldenstr macroglobulinemia [J]. N Engl J Med, 2012,367(9):826-833.
[15] Chen YH, Tallman MS, Coolsby C, et al. Immunophenotypic variations in hairy cell leukemia[J]. Am J Clin Pthol, 2006,125(2):251-259.
[16] Del Giudice L, Matutes E, Monlla R, et al. The diagnostic value of CD123 in B-cell disorders with hairy or villous lymphocytes[J]. Haemat Ologica, 2004,89(3):303-308.
[17] Matutes E. Contribution of in the diagnosis and classification of haemopoietic malignancies[J]. J Clin Pathol,1995,48(3):194-197.
[18] Matutes E. Immunophenotype and differential diagnosis of hairy cell leukemia[J]. Hematol Oncol Clin North Am, 2006,20(5):1051-1063.
[19] Jaffe ES, Harris NL, Stein H, et al. WHO classification of tumours,pathology and genetics of tumours of haematopoietic and lympoid tissue[M]. Lyon: IARC Press, 2001:135-137.
[20] Ocio EM, Hernández JM, Mateo G, et al. Immunophenotypic and cytogenetic comparison of waldenstroms macroglobulinemia with splenic marginal zone lymphoma[J]. Clin Lymph,2005,5(4):241-245.
[21] Baseggio L, Traverse GA, Petinataud F, et al. CD5 expression identifies:a clinicopath-ologica,cytogenetic and molecular study of 24 case[J]. Haematologica,2010,95(4):604-612.
[22] 杨申淼,江倩,江滨,等.伴血象异常的脾边缘区淋巴瘤的临床特点[J].中国实验血液学杂志,2013,21(1):87-94.
[23] 陈琳,李文生.脾脏非霍奇金B细胞边缘区淋巴瘤1例报告[J].山东医药,2015,55(23):107-108.
Pathological features and immuonphenotyping of chronic B-cell lymphoproliferative disorders
ZhangHuichao1,HEFang,JIAXiaoyun,CHENYanning,LIHong,DINGYawen,ZHANGHong,WANGPengyu,GAOShejun
(1FourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China)
Objective To invesitagte the pathological features and immuonphenotyping of chronic B-cell lymphoproliferative disorders (B-CLPD) and to deepen the understanding of these kinds of diseases. MethodsRetrospective analysis was conducted on the clinical data from 61 cases of B-CLPD patients including 43 cases of chronic lymphocytic leukemia (CLL), 9 cases of mantle cell lymphomas (MCL), 4 cases of lymphoplasmacytic lymphoma/Waldenstrom Macroglobulinemia (LPL/WM), 3 cases of splenic marginal zone lymphoma (SMZL) and 2 cases of hairy cell leukemia (HCL). Bone marrow cell morphology and immunophenotyping were detected in all 61 B-CLPD patients, and their characteristics were analyzed. ResultsMorphology of cells: there were many abnormally mature small lymphocytes or medium size lymphocytes in CLL and MCL; in SMZL, cell nuclei deviation was found and the cytoplasmic side had short fluff; in LPL/WM, chromatin of nucleus was similar to cell nucleus and other aspects had plasmacytoid features; HCl were projections with abundant cytoplasm, slender and irregular hair-like things. Immunophenotype: in 43 cases of CLL, the positive rates of CD5, CD19 and CD23 were 97.6%, 100% and 95.3%; in 9 cases of MCL, the positive rates of CD5, CD19, CD20, CD22 and FMC7 all showed strong expression; in 4 cases of LPL/WM, the positive rates of CD19, CD20, CD79a and SIgM were all 100%, CD79b was 75.0%, Ig light chain showed restricted expression; in 2 cases of HCL, the positive rates of CD19, CD20, CD22, CD79a, CD25, CD11c and CD103 all showed strong expression, while CD5, CD23 and CD79b were negative; in 3 cases of SMZL, CD19, CD20, CD22, CD24 and CD79a all showed strong expression, while CD5 and CD23 were negative. Strong expression of CD23 and weak expression of CD22 and CD79b in CLL patients could be used for the identification of CLL and MCL. The positive expression of CD23 was higher in lymph node tissues of CLL patients, while CyclinD1 expression was higher in MCL patients. ConclusionsBone marrow cell morphology and immunophenotype plays an important role in diagnosis of B-CLPD. As for different kinds of B-CLPD, we should combine the cell morphology, immunophenotype and (or) molecular genetics detection for accurate diagnosis.
chronic B-cell lymphoproliferative disorder; chronic lymphocytic leukemia; lymphoma; bone marrow puncture; immunophenotype; flow cytometry
河北省医学科学研究重点课题(ZD20140082)。
张会超(1976-),男,硕士,主管检验师,研究方向为造血与淋巴组织肿瘤细胞学诊断。E-mail: zhanghuichao050108@163.com
简介:高社军(1969-),男,本科,主任技师,研究方向为生物化学及分子生物学。E-mail: gaoshe@sina.com.cn
10.3969/j.issn.1002-266X.2016.30.006
R551.2
A
1002-266X(2016)30-0020-05
2016-05-08)

