CT灌注成像在缺血性脑血管病诊断及治疗中应用的研究进展
李昂,丁里
(1大理大学,云南大理671000;2云南省第一人民医院)
CT灌注成像在缺血性脑血管病诊断及治疗中应用的研究进展
李昂1,丁里2
(1大理大学,云南大理671000;2云南省第一人民医院)
CT灌注成像(CTP)是基于CT扫描技术发展而来的一项脑功能成像技术。近年来,随着CT设备及影像后处理技术的不断改进,CTP在评估缺血性脑血管病的脑供血状态及指导治疗方面发挥了越来越大的作用,可用于诊断急性脑梗死、TIA及评估缺血半暗带范围,评估梗死后脑组织的代偿能力,判断溶栓治疗后血管再通的效果等。
缺血性脑血管病;脑梗死;CT灌注成像;脑血流量;脑血容量
CT灌注成像(CTP)是基于CT扫描技术延伸出的一项脑功能成像技术,经静脉团注对比剂,通过CT机对定位感兴趣层面进行连续多次扫描,得到示踪剂经过感兴趣层面脑组织的时间-密度曲线(TDC),形成数字模型后,采用后处理软件计算脑血容量(CBV)、脑血流量(CBF)、对比剂的平均通过时间(MTT)、血流到达峰值时间(TTP)、流空时间(TTD)等参数,经图像重建及伪彩染色处理得到伪彩图,从而评价脑组织的灌注状态。相比于弥散加权成像(DWI)、增强灌注成像(PWI),CTP在缺血性脑血管病诊断中的检查时间短,便于实施。随着CT设备及后处理技术的不断改进,CTP在评估缺血性脑血管病的脑供血状态及指导治疗方面发挥了越来越大的作用。本文对有关CTP在缺血性脑血管病诊断及治疗方面的研究现状进行综述,以更好地利用此技术对缺血性脑血管病进行诊断及治疗。
1 CTP在缺血性脑血管病诊断中的应用
1.1在急性脑梗死诊断中的应用 发生急性脑梗死时,CTP表现为CBF、CBV低于正常范围,而MTT、TTP长于正常范围。Koenig等研究发现,rCBF和rCBV参数区分梗死组织与非梗死组织均有效,两者的阈值分别为0.48和0.60,即当病灶侧脑组织的CBF低于对侧镜像区脑组织CBF的48%、病灶侧脑组织CBV低于对侧镜像区域脑组织CBV的60%时,可以确定该病灶区域组织为梗死组织[1]。Bruce等[2]研究发现,rCBF为判断梗死组织最佳参数,当rCBF<31%时,应考虑该组织为梗死组织。另有研究表明,相比于DWI,CTP的CBV值下降严重程度对核心梗死区范围的诊断更具敏感性和特异性,是预测梗死区的良好指标[3]。
此外,近年来CTP参数中的TTD在缺血性脑血管疾病中的诊断价值也引起了一定的重视。TTD是指对比剂流出的时间,即从动脉造影剂增强到组织造影剂增强以及平均通过时间的总和时间。Kolja等[4]研究发现,TTD较其他的血流灌注参数表现出了更好的可依赖性和可重复性。而且TTD图像的色彩差异度更高、敏感性更强,能够更好地用于评估脑缺血异常灌注的范围[4]。
1.2在脑梗死缺血半暗带评估中的应用近年来,CTP在脑梗死缺血半暗带诊断方面的作用受到关注。缺血半暗带是指梗死周边区可逆性损伤的脑组织,超过一定时间会发展为不可逆的坏死脑组织。在脑梗死早期进行溶栓治疗,半暗带缺血状态可能被挽救。因此,在急性脑缺血早期评估半暗带范围,对于治疗方法的选择及预后判断具有重要意义。
CTP图像不仅可为脑梗死核心区提供可靠的评估,确定脑梗死的区域,也可以确定核心梗死区与缺血半暗带的范围。目前,CTP判断缺血半暗带的方法主要有两种:①不匹配区域法,通常认为CBF较正常下降,而CBV正常或轻度高于正常的不匹配区域是缺血半暗带[5]。也有研究将MTT延长而CBV正常或轻度升高的不匹配区域定为半暗带[6]。但近年对猪脑缺血模型实验表明,在急性卒中事件中,采用CBF与CBV的不匹配方法来计算缺血半暗带范围的方法不够准确[7],在临床中单独使用CBV预测缺血半暗带也不够准确[8]。因此,CTP不匹配区域法对于缺血半暗带的评估价值尚待进一步研究。②阈值对比法,即将急诊CTP图像与复查的CT、MRI图像对比,确定半暗带区域并评估敏感性、特异性参数,计算阈值,用阈值来判定缺血半暗带区域。Pan等[9]研究认为,rMTT受心功能、对比剂质量等干扰因素的影响相对较小,对缺血半暗带的敏感性、特异性最高,其阈值为150%,即当病灶侧脑组织的MTT超过对侧镜像脑组织MTT的150%时,可认为该组织为梗死组织,否则为缺血半暗带。d′Esterre等[7]研究发现,rCBF<0.75时为缺血半暗带,<0.55时为核心梗死区。
1.3在TIA诊断中的应用TIA具有高度卒中风险,如不及时干预,其发作后2 d内的脑卒中风险超过5%,3个月内为8.3%~10.7%,1年内为12.8%~16.2%[10]。因此,早期诊断TIA及评估TIA患者的脑血流灌注状态,对于治疗措施的确定及病情转归具有重要意义。随着现代影像学技术的发展,TIA的诊断由对临床表现的回顾性诊断逐渐发展为临床表现与影像学客观证据相结合的诊断方法,而CTP作为一种血流灌注学手段,可以评估TIA患者的脑血流灌注状态,评估病情严重程度,为治疗提供相关依据[11]。
TIA是发展为脑梗死的一个阶段,通过观察CTP各个参数值可以评估其病情进展的严重性。Heiss等[12]研究证实,rCBF减少至正常值的30%(即达到电衰竭阈值)时,首先出现脑电功能障碍,随着rCBF进一步减少,至正常值的15%~20%(即达到膜衰竭阈值)以下时,rCBF为6~8 mL/(100 g·min)并持续一段时间,则出现代谢改变甚至膜结构改变,发生不可逆的神经元死亡,即脑梗死。因此,TIA发展为脑梗死是一个从量变到质变的过程,通过分析CTP各参数值,可以判断TIA的缺血程度及发展为脑梗死的风险性。
1.4在梗死后脑组织代偿能力评估中的应用当脑动脉发生严重的狭窄甚至闭塞时,脑组织因缺血、缺氧而发生梗死,但脑动脉狭窄程度与脑梗死面积之间不是绝对的平行关系,有时虽脑动脉严重狭窄或闭塞,但该动脉供应脑组织区域却表现为正常或仅为腔隙性梗死,而有时脑动脉虽中度狭窄,该动脉供血区域却发生与狭窄程度不匹配的大面积脑梗死,因此缺血脑组织的最终演进不仅取决于缺血程度,也取决于其代偿能力。脑缺血时,其代偿能力包括脑循环储备力和脑代谢储备力。当CBF在一定程度内降低时,脑血管可通过代偿性扩张小动脉和毛细血管平滑肌维持脑血流稳定,这种能力被称为脑循环储备力(CCR)[13]。当CBF下降到一定程度时,神经元对氧和葡萄糖的摄取率增高以维持正常代谢及细胞内外膜稳定,这种能力即为脑代谢储备力(CMR)[14]。脑灌注不足情况下,通常是先开启脑循环储备,若脑灌注继续下降,CCR达到极限时,CMR则被迫发挥作用[14]。Heiss等[10]研究认为,CBV是反映脑循环代偿能力的较好参数,CBV升高提示代偿能力好,CBV下降代表代偿能力差,易发生大面积脑梗死。Joseph等[15]认为,可以通过评估急慢性脑缺血状态侧支血管网的功能状态,来预测血管的代偿能力。Satoshi等[16]研究表明,CTP中的TTP是评估脑血管病患者血管代偿能力的有效参数。
2 CTP在缺血性脑血管病溶栓治疗中的应用
评估梗死后脑组织的代偿能力溶栓治疗是治疗急性脑梗死的有效手段。Strbian等[17]研究显示,缺血性卒中早期溶栓治疗能有效降低致残率和病死率,越早接受该治疗,神经功能恢复越早,预后越好。对于接受溶栓治疗的患者,评估其血流是否再通对于疗效判断十分必要。目前,接受静脉溶栓的急性缺血性卒中患者仅占3%~5%,许多患者因发病时间不确定或超过溶栓治疗时间窗而失去溶栓机会[18]。国际上对静脉溶栓治疗的时间窗定为3.0~4.5 h,但目前研究发现,发病时间在9 h内的卒中患者,经影像学分析存在半暗带组织后接受溶栓治疗仍有效[19]。因此仅以治疗时间窗来决定是否溶栓是片面的。近年研究认为,根据是否存在缺血半暗带来对于是否行溶栓治疗的决策判断更有意义。CTP可根据脑灌注区别梗死区域及半暗带区域,进而指导溶栓治疗。
CTP可通过对比溶栓前后脑组织的血流灌注情况评价溶栓治疗效果。Gasparotti等[20]研究表明,溶栓治疗有较好临床疗效的患者其CTP表现为:梗死中心区域缩小、不匹配区域扩大、最终梗死面积缩小、再通比例增加及进展性梗死比例减少。近期研究证实,MTT可以作为一种精确的评估技术,确定急性脑卒中患者接受早期血管介入治疗的获益情况[21]。因此,CTP不仅是确定不可逆损害脑组织区域的有效方法,也是预测接受动脉溶栓治疗患者预后的可靠影像学工具[22]。
综上所述,CTP在评估缺血性脑血管病的脑供血状态及指导治疗方面发挥了越来越大的作用,尤其是在诊断急性脑梗死、TIA及评估缺血半暗带范围,评估梗死后脑组织的代偿能力,判断溶栓治疗后血管再通的效果等方面的作用越来越突出。
[1] Dorn F, Muenzel D, Meier R, et al. Brain perfusion CT for acute stroke using a 256-slice CT:improvement of diagnostic information by large volume coverage[J]. Eur Radiol,2011, 21(9):1803-1810.
[2] Bruce CV, Camp B, Sren C, et al. Cerebral blood flow is the optimal CT perfusion parameter for assessing infarct core[J]. Stroke,2011,42(12):3435-3440.
[3] Shankar JJ, Langlands G, Doucette S, et al. CT perfusion in acute stroke predicts final infarct volume-inter-observer study[J]. Can J Neurol Sci, 2016,43(1):93-97.
[4] Thierfelder KM, Sommer UH, Bauann AB, et al.Whole-brain CT perfusion: reliability and reproducibility of volumetric perfusion deficit assessment in patients with acute ischemic stroke[J]. Neuroradiology, 2013,55(7):827-835.
[5] Kanekar SG, Zacharia TZ, Roller R. Imaging of stroke. Part 2. Pathophysiology at the molecular and cellular levels and corresponding imaging changes[J]. AJR Am J Roentgenol, 2012,198(1):63-74.
[6] Allmendinger AM, Tang ER, Lui YW, et al. Imaging of stroke. Part 1. Perfusion CT-overview of imaging technique, interpretation pearls, and common pitfalls[J]. AJR Am J Roentgenol, 2012,198(1):52-62.
[7] d′Esterre CD,Aviv RI. Acute multi-modal neuroimaging in a porcine model of endothelin-1-induced cerebral ischemia: defining the acute infarct core[J]. Transl Stroke Res, 2015,6(3):234-241.
[8] d′Esterre CD, Roversi G. CT perfusion cerebral blood volume does not always predict infarct core in acute ischemic stroke[J]. Neurol Sci, 2015,36(10):1777-1783.
[9] Pan J, Zhang J,Huang W, et al. Value of perfusion computed tomography in acute ischemic stroke:diagnosis of infarct core and penumbra[J]. J Comput Assist Tomogr, 2013,37(5):645-649.
[10] Hill MD, Yiannakoulias N, Jeerakathil T, et aL. The high risk of stroke immediateIy after transient ischemic attack:a population-based study[J]. Neurology, 2004,62(11):2015-2020.
[11] Shyam P, Sohal K, Patel J, et al. Perfusion computed tomography in transient ischemic attack[J]. Arch Neurol, 2011,68(1):85-89.
[12] Heiss WD. Ischemic penumbra:evidence from funct ional imaging in man[J].J Cereb Blood Flow Metab, 2000,20(9):1276-1293.
[13] Li Q, Lu Y, Sun L, et al.Plasma adiponectin levels in relation to prognosis in patients with angiographic coronary artery disease[J]. Metabolism, 2012,61(2):1803-1808.
[14] Joshi B, Brady K, Lee J, et al. Impaired autoregulation of cerebral blood flow during rewarming from hypothermic cardiopulmonary bypass and its potential association with stroke[J]. Anesth Analg, 20l0,110(2):321-328.
[15] Joseph D, Suna S, Max W. Assessment of collateral flow in patients with cerebrovascular disorders[J]. J Neuroradiology, 2014,41(4):234-242.
[16] Satoshi T, Yoshio T. Prediction of cerebrovascular reserve capacity by computed tomography perfusion using 320-row computed tomography[J]. J Stroke Cerebro Dis, 2015,24(5):939-945.
[17] Strbian D, Soinne L, Sairanen T, et al. Ultraearly thrombolysis in acute ischemic stroke is associated with better outcome and lower mortality[J]. Stroke, 2010,41(4):712-716.
[18] Kim JT, Park MS, Nam TS, et al. Thrombolysis as a factor associated with favorable outcomes in patients with unclear-onset stroke[J]. Eur J Neurol, 2011,18(7):994-998.
[19] Hacke W, Furlan AJ, AlRawi Y, et al. Intravenous desmoteplase in patients with acute ischaemic stroke selected by MRI perfusion-diffusion weigted imaging or perfusion CT(DIAS-2):a prospective,randomized,doubIe-blind,placebo-controlled study[J]. Lancet Neurol, 2009,8(2):14l-150.
[20] Gasparotti R, Grassi D, Mardighian M, et al. Perfusion CT in patients with acute ischemic stroke treated with intra-arterial thrombolysis:predictive value of infarct core size on clinical outcome[J]. AJNR Am J Neuroradiol, 2009,30(4):722-727.
[21] Dababneh H, Bashir A. Mean transit time on aquilion ONE and its utilization in patients undergoing acute stroke intervention[J]. J Vasc Interv Neurol, 2014,7(5):73-81.
[22] Heit JJ, Wintermark M. Imaging selection for reperfusion therapy in acute ischemic stroke[J]. Curr Treat Options Neurol,2015,17(2):332.
原发性肾病综合征患者血清异常代谢通路的代谢组学分析
(见正文2页)
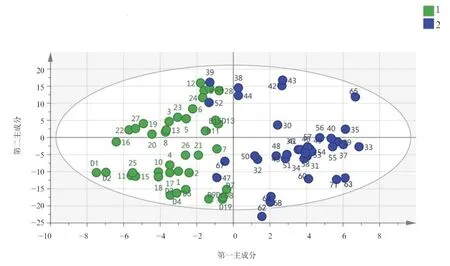
注:绿色为观察组,蓝色为对照组。
图1两组空腹血清样本LC-MS检测结果OPLS-DA得分图
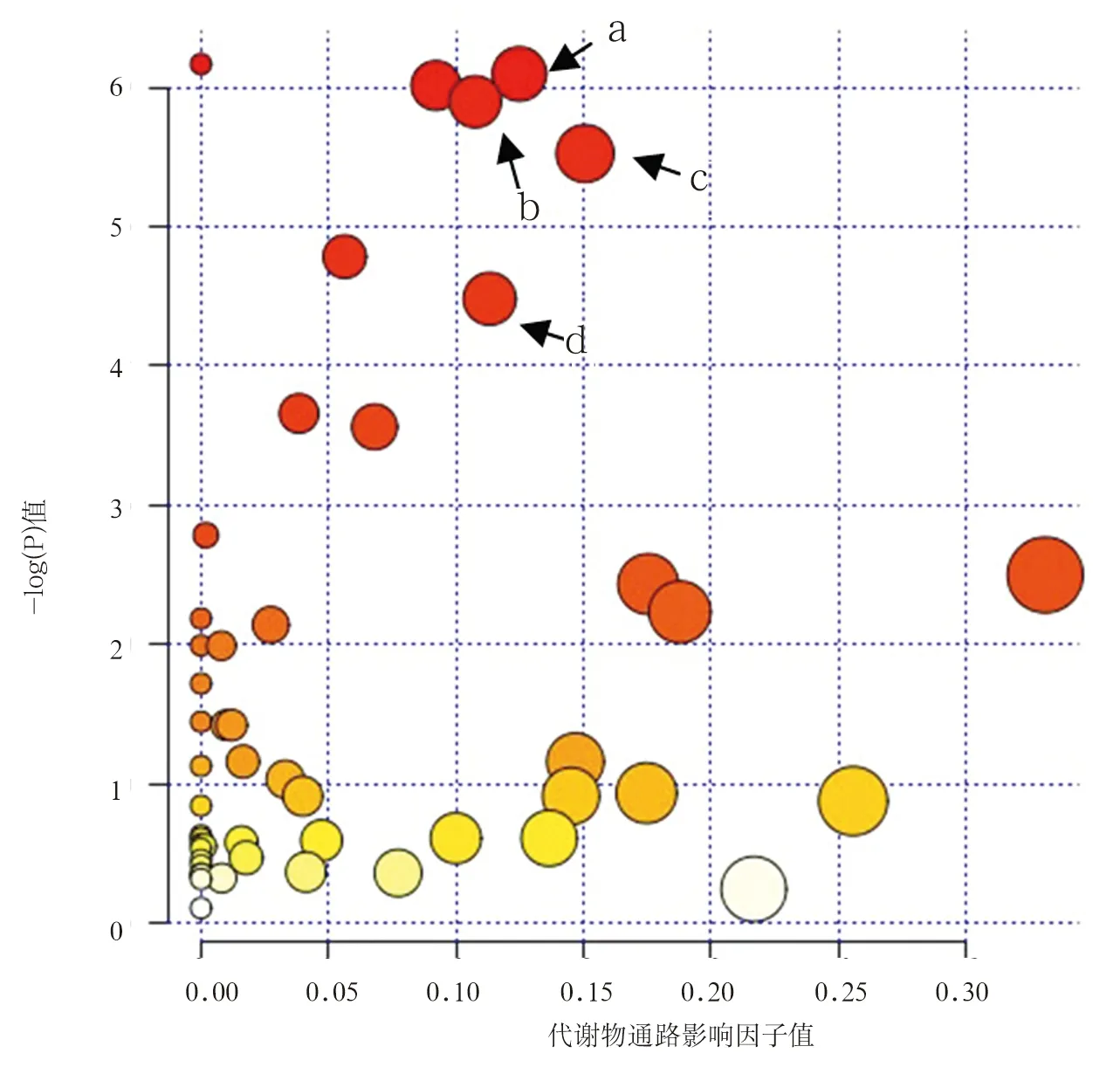
注:a为硫胺素代谢;b为嘧啶代谢;c为苯基丙氨酸代谢;d为柠檬酸代谢。圆圈大小代表通路影响因子值,圆圈颜色深浅表示-log(P)值。
图2差异代谢物相关通路示意图
白血病期慢性B淋巴细胞增殖性疾病的病理学及免疫表型特征分析
(见正文21页)
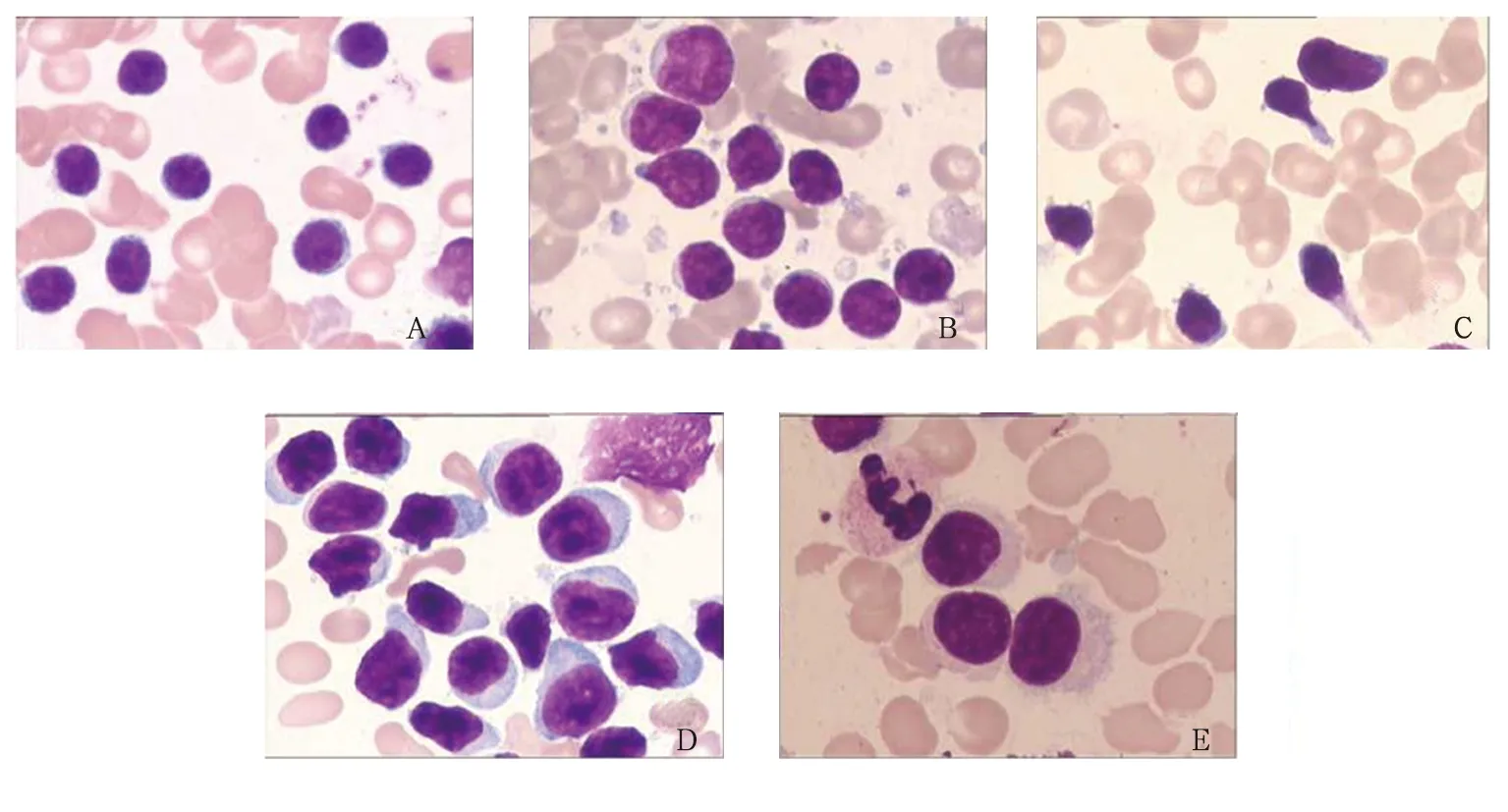
注:A 为CLL;B为MC;C为SMZL;D为LPL/WM;E为HCL。
图3各类B-CLPD患者骨髓细胞形态学表现(1 000×,瑞氏染色法)
参芍口服液对糖尿病肾病大鼠肾脏NLRP3炎症复合体相关蛋白表达的影响
(见正文35页)
注:A1为对照组NLRP3表达;A2为模型组NLRP3表达;A3为治疗组NLRP3表达。B1为对照组Caspase-1表达;B2为模型组Caspase-1表达;B3为治疗组Caspase-1表达。C1为对照组IL-1β表达;C2为模型组IL-1β表达;C3为治疗组IL-1β表达。
图4各组肾脏组织NLRP3、Caspase-1、IL-1β蛋白表达(免疫组化法,×400)
10.3969/j.issn.1002-266X.2016.30.039
R743.3;R814.43
A
1002-266X(2016)30-0110-03
2016-01-06)

