基于BOLD-fMRI技术的创伤后应激障碍患者大脑功能局部一致性观察
张跃奇,陆可可,张玉梅,薛辰霞,董原君,张桂青
(1 石河子大学医学院第一附属医院,新疆石河子 832002;2 石河子大学医学院)
基于BOLD-fMRI技术的创伤后应激障碍患者大脑功能局部一致性观察
张跃奇1,陆可可1,张玉梅1,薛辰霞2,董原君2,张桂青1
(1 石河子大学医学院第一附属医院,新疆石河子 832002;2 石河子大学医学院)
目的探讨创伤后应激障碍(PTSD)患者大脑局部一致性(ReHo)的变化。方法 收集初次诊断的PTSD患者8例(PTSD组),经历创伤事件未发生PTSD者7例(非PTSD组),经历创伤事件第2周及3个月时进行血氧水平依赖性功能磁共振成像(BOLD-fMRI)检查,分析两组大脑不同功能区域的ReHo。结果 与非PTSD组相比,PTSD组创伤事件后第2周ReHo降低的脑区有右侧舌回,未发现明显ReHo升高的脑区;第3个月ReHo降低的脑区有右侧颞中回、右侧枕叶、左侧颞下回,ReHo升高的脑区有左侧小脑、左侧额下回、左侧颞上回、左侧丘脑、右侧额上回(P均<0.05)。PTSD组创伤事件后第3个月较第2周左侧扣带回ReHo降低,右侧额叶眶回、右侧额下回、左侧额上回ReHo升高。结论 PTSD患者大脑皮质区存在ReHo变化,可能与局部功能连接改变有关。
创伤后应激障碍;功能核磁成像;局部一致性;血氧水平依赖
由于突发性、威胁性或灾难性的生活事件导致个体延迟出现和长期持续存在的精神障碍称为创伤后应激障碍(PTSD)[1,2],其核心症状是创伤性记忆的不断闯入造成恐惧、逃避和过度生理唤起等。然而,PTSD的发病机制仍不十分清楚。
近年来,血氧水平依赖性功能磁共振成像(BOLD-fMRI)技术被用于精神及心理疾病的脑结构和功能研究。局部一致性(ReHo)是通过计算某一给定体素簇中相邻体素同一时间序列中BOLD信号波动的相似性评估被试者自发性神经元活动状况,提供了用fMRI研究大脑局部连接性的方法。ReHo异常可能反映局部脑区神经元自发性活动的瞬间改变情况,并可能是大脑局部功能受损的线索。因此,我们应用BOLD-fMRI技术观察PTSD患者大脑功能ReHo变化,为PTSD的早期诊断、干预提供客观有效的影像学指标。
1 资料与方法
1.1临床资料研究对象为2014年10月~2015年12月就诊于新疆石河子大学医学院第一附属医院经历严重精神创伤事件(丧亲、车祸、工伤等)的人群。纳入标准:年龄18~60岁,右利手,创伤事件前无明显躯体疾病,过去半年内未接受过任何精神镇静类药物,愿意接受访谈、问卷调查并符合fMRI检查的相关条件者(如体内没有金属植入物等)。排除标准:患有其他类型精神疾病者(如抑郁障碍、精神分裂症、阿尔茨海默病等),创伤后有昏迷病史及不能回忆创伤情景者,有吗啡、酒精类物质滥用史者。退出标准:主动要求退出研究者。本研究最终得到初次诊断的PTSD患者8例(PTSD组),经历创伤事件未发生PTSD者7例(非PTSD组)。PTSD经2~3名经验丰富的临床精神科主治医师及心理治疗师确诊,均符合美国精神疾病诊断与统计手册第5版(DSM-Ⅴ)诊断标准。本研究获得医院医学伦理委员会批准,患者或家属签署知情同意书。
1.2数据采集分别于创伤事件后第2周、3个月使用美国GE公司生产的3.0 T超导磁共振全身扫描仪和标准头线圈检查。成像时,首先扫描3D T1结构像。序列参数:TR/TE=8.2/3.2 ms,翻转角=12°,FOV=240 mm×240 mm,矩阵=256×256,层厚1 mm,无间隔。全脑在轴位由32层组成,每个被试者均采集245个时间点,扫描时间500 s。被试者使用泡沫垫和耳塞以减少头动和隔离环境噪音,扫描时保持清醒、放松、平静呼吸,不要刻意思考问题,闭目尽量保持身体不动,数据采集完毕后全部传送到工作站进行后台处理。
1.3数据处理基于Matlab2010b平台,使用SPM-8及DPARSF和REST软件对静息态数据进行系统处理,考虑到磁场稳定及被试者对环境的适应,首先剔除前10个时相的采集图像,对剩余235个时相的数据进行时间校正、头动校正、空间标准化、去线性漂移、低频滤波等处理。
1.4统计学方法基于Kendall和谐系数(KCC)即ReHo值,取值范围为0~1,来测量局部脑区内的时间序列相似性。本研究定义每相邻27个体素为1个体素团,将KCC值赋于此正方体体素团的中心体素。使用REST软件对以ReHo方法得到的两组KCC图像中相应位置的体素逐个进行统计学分析。当每个体素的P<0.001(未校正)并且该区域体素数≥1个时认为差异具有统计学意义(相当于alphasim多重比较校正后的P<0.05)。
2 结果
2.1创伤事件后的第2周PTSD组与非PTSD组ReHo变化的脑区见表1。

表1 创伤事件后第2周PTSD与非PTSD组ReHo变化的脑区
注:最大差异点为对两组ReHo图像进行两样本t检验得到差异有统计学意义的脑区中t值最大的部位。
2.2创伤事件后第3个月PTSD组与非PTSD组ReHo变化的脑区见表2。
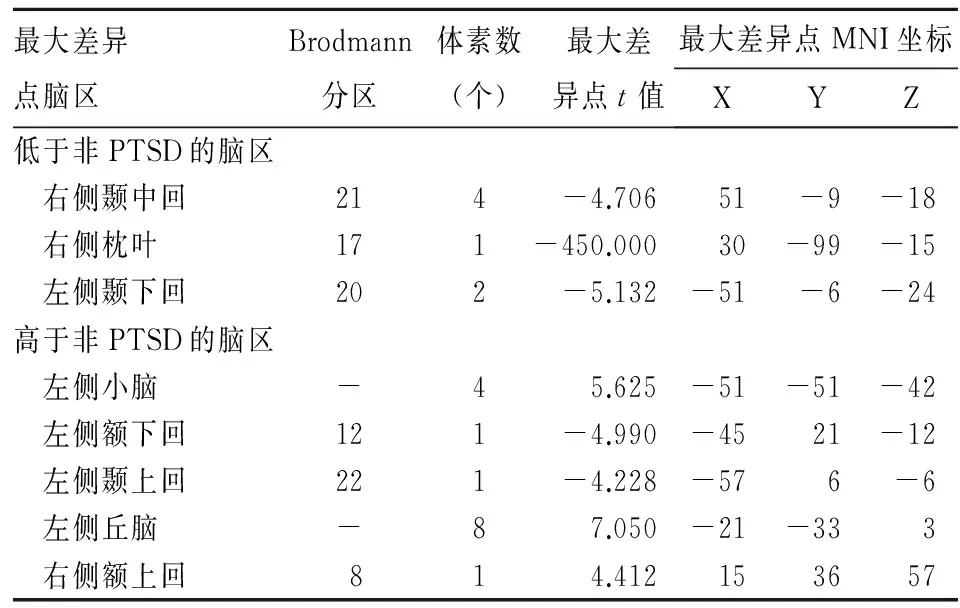
表2 创伤事件后第3个月PTSD与非PTSD组ReHo变化的脑区
2.3创伤事件后第2周、3个月PTSD组ReHo变化的脑区见表3。

表3 创伤事件后第2周、3个月PTSD组ReHo变化的脑区
3 讨论
本研究发现,与非PTSD组比较,PTSD组患者在创伤事件后第2周,ReHo降低的脑区有右侧舌回。舌回是视觉联想皮层的一个组成部分,负责视觉联想和视觉图像相关的处理与自传记忆的形成,并与口头陈述记忆有关。以往有研究报道,PTSD患者视觉皮层功能下降[3]。舌回ReHo降低与PTSD患者对于记忆功能减退相一致[4]。
创伤发生后第3个月PTSD患者右侧颞中回、右侧枕叶、左侧颞下回脑区ReHo降低,而左侧小脑、左侧额下回、左侧颞上回、左侧丘脑、右侧额上回脑区ReHo升高,提示这些脑区异常的神经活动可能参与PTSD患者症状的形成与持续。右额叶区域的激活增加,与Jatzko等[5]的研究结果类似,表明右额叶区域参与了PTSD的情绪变化过程。此外,以往的脑电图和fMRI研究表明,右额叶的激活参与了消极情绪状态、高警觉、焦虑和退缩行为的过程[6,7]。枕叶被认为是视觉处理的中枢。有研究发现,枕叶不仅参与视觉处理,同时还参与抑制的控制过程[8]。PTSD患者枕叶的ReHo升高,可能与PTSD患者典型的再度创伤体验症状有关。Bremner等[9]研究也发现,PTSD患者颞中回ReHo降低。颞中回可以抑制杏仁核的功能,增加恐惧反应,并与情节记忆及语言处理相关[10]。本研究结果发现,PTSD患者小脑静息状态下ReHo升高,与Bonne等[11]研究结果一致。考虑该脑区的自发活动增强可能导致PTSD患者认知调节出现偏差,对一些事情表现的较敏感、警觉性增高症状。Patel等[12]发现,丘脑的激活下降可能引起感觉信息加工功能的损害,导致PTSD患者的分离或闪回症状。本研究发现,左侧丘脑ReHo升高,与Patel等研究结果一致。PTSD患者自身前后对比发现,左侧扣带回脑区ReHo降低,右侧额叶眶回、右侧额下回、左侧额上回脑区ReHo升高,反映了这些脑区的自反神经活动异常。这与Bluhm等[13]的研究结果不同,有几种可能的解释这些不同的结果。首先,研究年龄、性别分布、惯用手、样本大小、创伤类型和疾病的持续时间等不同。例如,不同创伤的类型已被证明对脑血流量分布[14,15]有不同的影响。其次,Bluhm等用种子区域分析,不同的分析方法可能带来不同的结果。
总之,我们检测发现PTSD相关脑区的ReHo变化,表明大脑皮质区局部功能连接的改变可能是PTSD的神经机制之一,以这些脑区改变为目标可能会对PTSD的早期诊断、治疗及预后产生积极的意义。但本研究也存在一些不足,如样本量较小,缺乏充分的校正,需大样本继续进行验证。
[1] 董原君,张跃奇,胡敏,等.催产素对大鼠创伤后应激障碍的预防作用[J].山东医药,2015,55(41):20-22.
[2] 薛辰霞,张志强,祁鸣,等.创伤后应激障碍患者症状与焦虑、抑郁情绪的关系[J].山东医药,2015,55(34):78-80.
[3] Bremner JD, Vermetten E, Vythilingam M, et al. Neural correlates of the classic color and emotional stroop in women with abuse-related posttraumatic stress disorder[J]. Biol Psychiatry, 2004,55(6):612-620.
[4] Segovia DA, Strange D, Takarangi MKT. Encoding disorganized memories for an analogue trauma does not increase memory distortion or analogue symptoms of PTSD[J]. J Behav Ther Exp Psychiatry, 2016,50(3):127-134.
[5] Jatzko A, Schmitt A, Demirakca T, et al. Disturbance in the neural circuitry underlying positive emotional processing in post-traumatic stress disorder (PTSD): An fMRI study[J]. Eur Arch Psychiatry Clin Neurosci, 2006,256(2):112-114.
[6] Stoodley CJ. The cerebellum and cognition: evidence from functional imaging studies[J]. The Cerebellum, 2012,11(2):352-365.
[7] MacNamara A, Rabinak CA, Kennedy AE, et al. Emotion regulatory brain function and SSRI treatment in PTSD: neural correlates and predictors of change[J]. Neuropsychopharmacology, 2016,41(2):611-618.
[8] Fears SC, Schür R, Sjouwerman R, et al. Brain structure-function associations in multi-generational families genetically enriched for bipolar disorder[J]. Brain, 2015,138(7):2087-2102.
[9] Bremner JD, Staib LH, Kaloupek D, et al. Neural correlates of exposure to traumatic pictures and sound in Vietnam combat veterans with and without posttraumatic stress disorder: a positron emission tomography study[J]. Biol Psychiatry,1999,45(7):806-816.
[10] Lee CM, Osman AF, Volgushev M, et al. Neural spike-timing patterns vary with sound shape and periodicity in three auditory cortical fields[J]. J Neurophysiol, 2016,115(4):1886-1904.
[11] Bonne O, Gilboa A, Louzoun Y, et al. Resting regional cerebral perfusion in recent posttraumatic stress disorder[J]. Biol Psychiatry, 2003,54(10):1077-1086.
[12] Patel R, Girard TA, Pukay-Martin N, et al. Preferential recruitment of the basolateral amygdala during memory encoding of negative scenes in posttraumatic stress disorder[J]. Neurobiol Learn Mem, 2016,130(4):170-176.
[13] Bluhm RL, Williamson PC, Osuch EA, et al. Alterations in default network connectivity in posttraumatic stress disorder related to early-life trauma[J]. J Psychiatry Neurosci, 2009,34(3):187-194.
[14] Meng Y, Qiu C, Zhu H, et al. Anatomical deficits in adult posttraumatic stress disorder: a meta-analysis of voxel-based morphometry studies[J]. Behav Brain Res, 2014,270(8):307-315.
[14] 陆可可,薛辰霞,董原君,等.创伤后应激障碍患者的自传体记忆损害情况观察[J].山东医药,2016,56(10):70-71.
“十二五”新疆生产建设兵团医药卫生重点领域科技攻关项目(2012BA023)。
董原君(E-mail: ktpdwawj@163.com);张桂青(E-mail: fristli@126.com)
10.3969/j.issn.1002-266X.2016.34.023
R749
B
1002-266X(2016)34-0060-03
2016-04-14)

