电针“曲池”“足三里”穴对缺血再灌注损伤大鼠纹状体DARPP-32磷酸化的影响*
林云娇王露露吴 洁黄 佳宋长明
林冰冰1,2,3柳维林1,2,3陶 静1,2,3陈立典1,2,3,4△
·研究报告·
电针“曲池”“足三里”穴对缺血再灌注损伤大鼠纹状体DARPP-32磷酸化的影响*
林云娇1,2,3王露露1,2,3吴洁1,2,3黄佳1,2,3宋长明1,2,3
林冰冰1,2,3柳维林1,2,3陶静1,2,3陈立典1,2,3,4△
(1.福建中医药大学康复医学院,福建福州350122;2.福建省康复技术重点实验室,福建福州350122;3福建康复产业研究院,福建福州350122;4.国家中医药管理局中医康复研究中心,福建福州350122)
目的观察电针“曲池”“足三里”穴对脑缺血再灌注损伤局灶性大脑中动脉闭塞模型(MCAO)大鼠神经行为学的变化及多巴胺和环磷酸腺苷调节的蛋白(DARPP-32)磷酸化的影响。方法将25只雄性SD大鼠随机分为假手术组(6只)、手术组(19只)。手术组采用Longa线拴法制备左侧左侧大脑中动脉栓塞(MCAO)大鼠模型,将造模后符合纳入标准的12只大鼠随机分为模型组、电针组,各6只。电针组取“曲池”和“足三里”穴,电针干预14 d,假手术组和模型组在同等条件下抓取及固定,不予任何干预。通过神经功能评分判断大鼠的神经功能缺损情况;小动物磁共振仪(MRI)扫描观察脑梗死体积,Western blot检测纹状体DARPP-32、p-Thr75-DARPP-32的表达情况。结果与模型组相比,电针组大鼠神经功能评分降低(P<0.05),脑梗死体积减少(P<0.05),纹状体p-DARPP-32-Thr75/DARPP-32比值增高(P<0.05)。结论电针“曲池”和“足三里”穴可改善MCAO大鼠神经功能缺损症状,其机制可能与促进缺血纹状体的DARPP-32在Thr75位点的磷酸化有关。
脑缺血电针DARPP-32 p-DARPP-32-Thr75
【Abstract】Objective:To observe the effect of electro-acupuncture at Quchi(LI11)and Zusanli(ST36)on the change of neurological deficit,and the phosphorylation of dopamine and cyclic adenosin 3′,5′-monophosphate regulated phosphoprotein(DARPP-32)in rat after cerebral ischemia reperfusion injury.M ethods:25 male SD ratswere randomly divided into the sham operation group(n=6)and the operation group(n=19).The operation group were under the operation of the leftmiddle cerebral artery occlusion(MCAO)by themodified Longa′methods,and 12 qualified ratswere randomly divided into themodel group(n=6)and the electro-acupuncture group(n=6).The electro-acupuncture group received electro-acupuncture at Quchi(LI11)and Zusanli(ST36)for 14 days.The neurological deficit was assessed;the cerebral infarct volume was scanned with animalmagnetic resonance imaging(MRI)machine.The protein expression of DARPP-32 and p-Thr75-DARPP-32 were detected by Western blotting technique.Results:Compared with themodel group,the neurological deficit score in the electro-acupuncture group was improved(P<0.05).The size of infarct volume was significantly reduced(P<0.05). The radio of p-DARPP-32-Thr75/DARPP-32 in corpus striatum in electro-acupuncture group was higher than that in themodel group(P<0.05).Conclusion:The electro-acupuncture at Quchi(LI11)and Zusanli(ST36)can promote the recovery of neurologic deficit symptom,which may be associated with promoting the phosphorylation of DARPP-32 on Thr75.
【Key words】Cerebral ischemia;Electro-acupuncture;DARPP-32;p-DARPP-32-Thr75在我国,脑卒中后幸存患者中70%~80%遗留不同程度的功能障碍[1],严重响患者的生存质量,同时也带来沉重的经济负担[2]。脑缺血时纹状体神经细胞外兴奋性氨基酸(EAA)和多巴胺(DA)含量明显升高并参与纹状体神经元局部缺血损伤的进展[3-4],而多巴胺和环磷酸腺苷调节的蛋白(DARPP-32)与这两类的神经元递质功能调节有关。有研究证明大鼠脑缺血后纹状体区DARPP-32在Thr34(苏氨酸残基)位点上的磷酸化水平与缺血后神经功能缺损程度相一致[5-6]。进一步研究发现,通过周期性依赖蛋白激酶(Cdk5)磷酸化的DARPP-32(Thr75)是环磷酸腺苷依赖性蛋白激酶(PKA)的抑制剂[7],可产生神经保护作用。前期临床和基础研究表明电针“曲池”和“足三里”穴可以有效改善缺血性脑卒中后运动功能障碍[8-9]。因此本课题组通过观察电针曲池、足三里穴是否通过影响DARPP-32在Thr75(苏氨酸残基)位点的磷酸化水平来治疗脑缺血再灌注损伤,改善大鼠脑缺血后的神经功能缺损症状及运动功能障碍。
1 材料与方法
1.1实验动物雄性SD大鼠25只,体质量200~250 g,由上海斯莱克实验动物有限责任公司提供[生产许可证号:SCXK(沪)2012-002],由福建中医药大学实验动物中心饲养(动物使用许可证号:2014-001)。动物饲养于SPF级动物实验室,随机分笼饲养,维持室温20~22℃,模拟标准日夜系统,所有试验均遵照国际动物保护和使用指南的规定实施。
1.2试剂与仪器DARPP-32(Abacam,England)、Phospho-DARPP-32(Thr75)(Cell Signaling Technology,USA)、β-actin一抗及辣根过氧化物酶二抗(Cell Signaling,Beverly,MA,USA)、BCA蛋白浓度测定试剂盒(赛默飞世尔,美国)、异氟烷(瑞沃德,中国),动物步态分析系统(CatWalk XT 10.0,Noldus,Holland)、疲劳转棒测试仪(Rat Rota-Rod,UGO BASILE,ITALY)、7.0T小动物磁共振仪(Pharmascan,microMRI,Bruker,Germany)、10%水合氯醛。
1.3分组与造模将25只SD大鼠按随机数字表法随机分为假手术组(n=6)和手术组(n=19),所有大鼠术前禁食12 h,称体质量后,用10%水合氯醛3 mL/kg经腹腔注射麻醉。麻醉后,手术组采用Longa[10]法制备左侧大脑中动脉栓塞(MCAO)模型,仰卧固定大鼠,颈部皮肤消毒备皮后,沿前正中线切开颈部皮肤,以此分离左侧颈总动脉、颈外动脉、颈内动脉;用结扎线依次结扎颈动脉近心端,用显微血管夹夹住颈内动脉,在距颈总动脉分叉处约1.0 cm处用显微剪刀剪一切口,将直径为0.2mm的鱼线从切口处缓慢进入颈内动脉,松开血管夹,当鱼线头端到达大脑中动脉起始端处(从颈
外动脉与颈内动脉分叉处起计算插入约18~22 mm)即可。固定线栓,缝合切口。手术结束后,动物置于室温环境下苏醒。2 h后缓慢退出鱼线至分叉处,从而形成缺血再灌注模型。假手术只分离左侧颈总、颈内、颈外动脉,不予插线栓。实验全过程和动物苏醒期间注意保暖,保持室温在25℃左右,直至大鼠重新恢复活动。手术后,大鼠予正常进食及饮水。大鼠苏醒后,根据Longa[10]评分法对其进行神经功能缺损评分,用以判断模型是否成功:无神经功能缺损,0分;提尾时右前肢内收,不能完全伸展,1分;自发行走时向右侧转圈,2分;行走时身体向右侧倾倒,3分;不能自发行走,有意识丧失,4分。0分及4分者给予剔除。最终18只大鼠纳入研究,假手术组、模型组、电针组各6只。
1.4干预措施电针组大鼠在造模后第1天即进行电针干预。根据《实验针灸学》[11]的大鼠取穴方法,取大鼠右侧曲池、足三里穴。用0.5寸毫针(华佗牌30号),直刺2~3mm,接电针仪(G6805型),电压峰值为6 V,疏密波,频率1~20 Hz,以大鼠肢体轻微抖动为度,治疗时间为每次30min,每日1次,疗程为14 d。假手术组及模型组于同一时间用同样方法固定30 min,每日1次,固定时程为14 d,但不予电针干预。
1.5观察项目1)Longa评分:缺血再灌注后2 h及造模14 d后,对模型组和电针组大鼠分别进行两次Longa神经功能缺损评分。该个评估由一名对本研究不知情的观察者完成。2)小动物磁共振仪扫描:造模后14 d后,将大鼠用3%的异氟烷在1∶4的氧气和空气混合气体中诱导麻醉5 min后。扫描时将大鼠仰卧于小动物磁共振扫描床上。扫描过程中用混在氧气和空气的0.2%异氟烷经鼻导管来维持麻醉,并维持扫描环境稳定,同时使用动物生理检测仪检测大鼠体温、血氧饱和度及呼吸、心率,并通过温控及通风系统维持整个实验过程中生理状态的稳定。解剖结构像扫描应用RARE技术显示T2WI图像,扫描参数如下:TE/TR=60 ms/ 1200 ms,FOV 32 mm×32 mm,层间距0,层厚=1 mm,层数=21,矩阵256×256,翻转角90°。T2WI所获得的原始数据通过Image J软件进行脑梗死体积的计算。方法为:计算每层脑梗死的体积(每层脑梗死的面积× 1mm),每个脑组织的脑梗死总体积即所有层面脑梗死体积之和,脑梗死百分比为脑梗死体积与全脑体积之比。
1.6标本采集与检测造模14 d后,在行Longa评分及采集T2WI图像后,立即将各组大鼠用10%的水合氯醛经腹腔注射麻醉后,快速断头取脑,于冰上剥离出左侧(正常组大鼠)或缺血侧(模型组及电针组大鼠)纹状体,置于EP管中,-80℃冰箱保存准备进行Western blot检测。严格按照组织总蛋白的提取和浓度测定说明书操作,取纹状体样本各约100mg放入匀浆器,加入RIPA裂解液1mL,于冰上充分研磨后,4℃,14000 r/min离心10min,缓慢吸取上清液。采用BCA法测定各样本蛋白浓度。100℃加热5min,使蛋白充分变性后,取50μg样品蛋白经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,转移到聚偏二乙烯膜后,用5%脱脂奶封闭2 h,分别加入抗β-actin(1∶8000)、抗DARPP-32(1∶5000)、P-DARPP-32(1∶1000)一抗,4℃孵育过夜,经TBST洗膜后,用辣根过氧化物标记的二抗(1∶5000)孵育60min。将PVDF膜放在图像扫描仪上,避光配置显色液并覆盖PVDF膜,反应1min,成像;应用Image lab软件设计计算蛋白条带光密度进行分析处理。
1.7统计学处理实验数据采集采用统计软件SPSS 20.0处理,计量资料均以(表示,多组间比较采用单因素方差分析,方差齐时用LSD方法,不齐时用Games-Howell方法。P<0.05为差异有统计学意义。
2 结 果
2.1电针对MCAO大鼠神经行为学的影响见表1。脑缺血再灌注后2 h,与假手术组大鼠相比,模型组及电针组大鼠Longa评分升高(P<0.05),但模型组与电针组之间无显著差异(P>0.05)。电针治疗14 d后,电针组Longa评分低于模型组(P<0.05),说明电针“曲池”和“足三里”穴可改善缺血性脑卒中大鼠的神经缺损症状。
表1 各组大鼠Longa评分、梗死体积百分比、DARPP-32(/β-acting)、p-DARPP-32-Thr75蛋白表达比较(
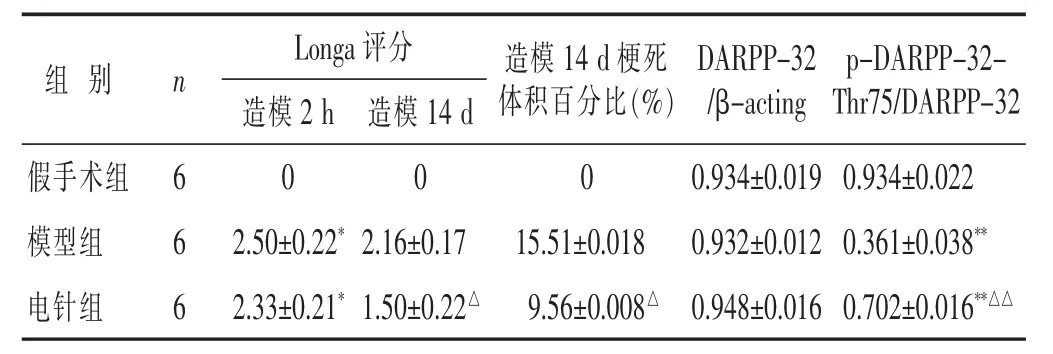
表1 各组大鼠Longa评分、梗死体积百分比、DARPP-32(/β-acting)、p-DARPP-32-Thr75蛋白表达比较(
与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
组别n DARPP-32 /β-acting Longa评分 造模14 d梗死体积百分比(%)p-DARPP-32-Thr75/DARPP-32假手术组6模型组6造模2 h造模14 d 0 0 0 2.50±0.22*2.16±0.17 15.51±0.018 0.934±0.019 0.934±0.022 0.932±0.012 0.361±0.038**电针组6 2.33±0.21*1.50±0.22△9.56±0.008△0.948±0.016 0.702±0.016**△△
2.2电针对MCAO大鼠脑梗死体积的影响见图1,表1。脑缺血再灌注后2 h,模型组与电针组之间Longa评分无显著差异(P>0.05),因此可推测模型组与电针组大鼠之间的梗死体积也无显著差异。电针治疗14 d后,如图1所示,磁共振T2加权成像,模型组、电针组均可看到高信号,即为梗死区域。电针组大鼠比模型组大鼠脑梗死体积明显降低(P<0.05),说明电针“曲池”和“足三里”穴可减少缺血性脑卒中大鼠的脑梗死体积。
2.3电针对MCAO大鼠纹状体DARPP-32、p-DARPP-32-Thr75表达的影响见图2,表1。假手术组、模型组、电针组DARPP-32蛋白的表达均无明显差异(P>0.05);模型组大鼠纹状体区的p-DARPP-32-Thr75蛋白的表达低于假手术组(P<0.05),而电针组大鼠纹状体区的p-DARPP-32-Thr75蛋白的表达高于模型组(P<0.05),说明电针“曲池”和“足三里”穴可促进大鼠脑缺血后纹状体区p-DARPP-32-Thr75的表达。
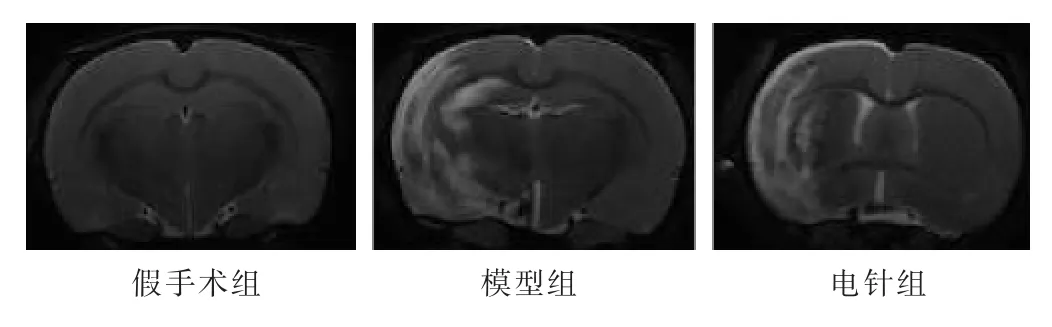
图1 各组大鼠造模14 d后磁共振T2加权成像
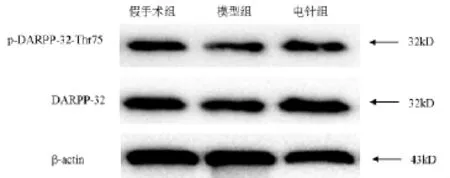
图2 各组大鼠缺血纹状体DARPP-32、p-DARPP-32-Thr75蛋白表达情况
3 讨 论
脑卒中在中医学中属于“中风”范畴,脑卒中发生后会导致气血阴阳失调,经脉闭阻,偏身经气,尤其是阳经经气受阻,经脉失养,而发偏雍。因此治疗脑卒中当以调整气血、平衡阴阳、疏通经脉为主要治疗原则。历代文献已有对中风疗法治疗的记载,《素问·痿论篇》提出了“治痿独取阳明”的基本治则。曲池穴是手阳明大肠经的合土穴,足三里穴是足阳明胃经的合穴和胃经的下穴,因此针刺曲池和足三里穴可通调腹气,使气机条畅,气血调和,进而能达到活血化瘀的功效。两个穴位的临床及基础研究均显示疗效显著[7-9,12-14]。本研究发现,电针“曲池”和“足三里”穴能有效改善脑缺血再灌注损伤后的神经功能缺损症状。
目前研究表明,纹状体是中枢神经系统中对缺血比较敏感的部位[15]。且纹状体的中型多棘神经元是反馈和运动系统以及多巴胺神经支配的重要部分,这些神经元表达高水平的特异性信号蛋白,其中包括DARPP-32以及蛋白磷酸酶-1调节的亚基-1B(PPP1R1B),是多种细胞外信号调节的多种信号通路的枢纽[16-17]。其中DARPP-32是在纹状体中型多极神经元高度密集的胞质蛋白,并且是纹状体处多巴胺激活腺苷环化酶(cAMP)的主要钼靶[18-19]。多巴胺转化,增强或抑制PKA通路的功能,取决于它磷酸化的状态。研究表明,纹状体在静息状态下,Cdk5磷酸化DARPP-32上的Thr75位点来抑制多巴胺信号通路的效应,而多巴胺通过其D1受体诱导cAMP依赖蛋白(PKA)的激活,以此来减小纹状体DARPP-32在Thr75位点上的磷酸化程度来消除这个抑制作用[20]。而脑缺血时,纹状体神经细胞外过量释放的EAA和DA是造成其缺血性损伤的重要因素[21];EAA主要是指谷氨酸(Glu),它的兴奋毒作用可引起细胞损伤,而DARPP-32是Glu和DA发生直接作用的唯一结点。DA作用于D1受体使PKA活性增加,从而磷酸化DARPP-32(Thr34),转化为蛋白磷酸酶1(PP-1)的强效抑制剂,使PP-1的活性受到抑制,造成胞内一些蛋白质磷酸化程度增加[22],从而对细胞造成损伤。有研究表明,脑缺血后DARPP-32在纹状体中的蛋白表达没有差异性[23]。缺血时,释放大量多巴胺,激活PKA,促进纹状体DARPP-32在Thr34的磷酸化水平升高[24-25],且该磷酸化水平与纹状体损伤程度相平行,相反地,DARPP-32在Thr75的磷酸化水平下降。
综上所述,本研究证实电针“曲池”“足三里”穴可改善缺血再灌注损伤鼠行为缺损症状,减小梗死体积,其机制可能与促进DARPP-32在Thr75位点上的磷酸化程度,抑制PKA减弱多巴胺通路效应,减小对细胞的损伤,从而缓解脑缺血再灌注损伤及产生神经保护作用有关。本实验的结果并不能完全阐释电针改善MCAO大鼠的学习记忆功能的具体机制,其效应机制还有待进一步深入研究。
[1]姚滔涛,王宁华,陈卓铭.脑卒中运动功能训练的循证医学研究[J].中国康复医学杂志,2010,25(6):565-570.
[2]费利军.中医药治疗中风后遗症近况[J].云南中医中药杂志,2006,27(2):51-53.
[3]Chang CJ,Ishii H,Yamamoto H,et al.Effect of cerebral ischemia on regional dopamine release and D1 and D2 receptors[J].JNeuronchem,1993,601:1483-1490.
[4]Hirotaka I,MayumiO,Shigenodbu S,etal.Effectsof transient forebrain ischemia on long-term enhancement of dopamine release in ratstriatalslices[J].Brain Res,1995,671:95-99.
[5]Jin H,XiG,Keep RF,etal.DARPP-32 to quantify intracerebralhemorrhage-induced neuronaldeath in basalganglia[J]. TranslationalStroke Research,2013,4(1):130-134.
[6]Hua Y,Schallert T,Keep RF,etal.Behavioral tests after intracerebral hemorrhage in the rat[J].Stroke,2002,33(10):2478-2484.
[7]Gao Y,Lin Z,Tao J,etal.Evidence of timing effects on acupuncture:A functionalmagnetic resonance imaging study[J]. Experimental&Therapeutic Medicine,2015,9(1):59-64.
[8]郑薏,柳维林,上官豪,等.电针对局灶性脑缺血再灌注大鼠缺血周围皮质与纹状体区波形蛋白表达的影响[J].中国康复医学杂志,2016,31(1):14-19.
[9]陶静,柳维林,黄佳,等.基于Notch1信号通路观察电针对脑缺血再灌注损伤大鼠缺血周边皮质与SVZ区神经干细胞增殖的影响[J].康复学报,2015,25(3):23-34.
[10]Longa EZ,Weinstein PR,Carlson S,et al.Reversiblemiddle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[11]李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:242.
[12]Jing T,Xie-Hua X,Li-Dian C,etal.Electroacupuncture improves neurological deficits and enhances proliferation and differentiation of endogenous nerve stem cells in ratswith focal cerebral ischemia[J].Neurological Research,2010,32(2):198-204.
[13]廖少钦,江征,卓丽萍,等.针刺“曲池”“外关”穴位促进脑卒中手功能恢复临床研究[J].亚太传统医药,2014,10(22):60-62.
[14]Chen A,Lin Z,Lan L,etal.Electroacupuncture at the Quchi and Zusanli acupoints exerts neuroprotective role in cerebral ischemia-reperfusion injured rats via activation of the PI3K/ Aktpathway[J].International JournalofMolecularMedicine,2012,30(4):791-796.
[15]Ren Y,Li X,Xu ZC.Asymmetrical protection of neostriatal neurons against transient forebrain ischemia by unilateral dopamine depletion[J].Experimental Neurology,1997,146(1):250-257.
[16]Svenningsson P,NishiA,Fisone G,etal.DARPP-32:an integrator of neurotransmission[J].Annual Review of Pharmacology&Toxicology,2004,44(1):269-296.
[17]Yger M,Girault JA.DARPP-32,Jack of all tradesmaster of which[J].Frontiers in Behavioral Neuroscience,2011,5(1):108-115.
[18]Belkhiri A,Zaika A,Pidkovka N,et al.Darpp-32:a novel antiapoptotic gene in upper gastrointestinal carcinomas[J]. CancerResearch,2005,65(15):6583-6592.
[19]Walaas SI,Aswad DW,Greengard P.A dopamine-and cyclic AMP-regulated phosphoprotein enriched in dopamine-innervated brain regions[J].Nature,1983,301(5895):69-71.
[20]NishiA,Bibb JA,SnyderGL,etal.Amplification ofdopaminergic signaling by a positive feedback loop[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(23):12840-12845.
[21]Hirotaka I,Mayumi O,Shigenobu S,et al.Effect of transient forebrain ischemia on long-term enhancement of dopamine re-lease in rat striatal slices[J].Brain Res,1995,671:95-99.
[22]Wozniak E,OldziejS,Ciarkowski J.Molecularmodelingof the catalytic domain of s erine/threonine phosphatase-1 with the Zn2+and Mn2+nuclear ion centers in the active site[J].ComputChem,2000,24:381-390.
[23]SUNYa-Feng,TANGFang-Ming,DINGYun-Min,etal.Effectof dopamine depletion on DARPP-32 protein in ischemic rat striatum[J].Acta Pharmacologica Sinica,2001,22(3):243-248.
[24]孙亚锋,唐放鸣,王然,等.缺血引起沙土鼠纹状体DARPP-32磷酸化状态的变化[J].生理学报,2001,53(2):108-110.
[25]Jin H,XiG,Keep RF,etal.DARPP-32 toquantify intracerebralhemorrhage-induced neuronal death in basalganglia[J]. TranslationalStroke Research,2013,4(1):130-134.
Effects of Electroacupuncture at Quchi(LI11)and Zusanli(ST36)on DARPP-32 Phosphorylation in Rat Striatum after Cerebral Ischmeia-reperfusion
LIN Yunjiao,WANG Lulu,WU Jie,et al.College of Rehabilitation Medicine,Fujian University of Traditional Chinese Medicine,Fujian,Fuzhou 350122,China.
R245.9+7
A
1004-745X(2016)09-1645-05
10.3969/j.issn.1004-745X.2016.09.001
2016-05-27)
·综述·
国家自然科学基金项目(81273835;81373778);福建省卫生厅青年科研课题(2014-1-70)
(电子邮箱:cld@fjtcm.edu.cn)

