模拟手法压力刺激对颈性眩晕血瘀证患者血清损伤后内皮细胞的影响*
傅品来范志勇张竞之李 黎彭志允田 宁苏碧莹吴 栓
(1.广东省中西医结合医院,广东 佛山528200;2.广东省中医院,广东 广州510120;3.广州医科大学附属第二医院,广东 广州510260)
·研究报告·
模拟手法压力刺激对颈性眩晕血瘀证患者血清损伤后内皮细胞的影响*
傅品来1范志勇2△张竞之3李黎2彭志允1田宁1苏碧莹1吴栓1
(1.广东省中西医结合医院,广东佛山528200;2.广东省中医院,广东广州510120;3.广州医科大学附属第二医院,广东广州510260)
目的观察模拟手法压力刺激对颈性眩晕血瘀证患者血清损伤的人脐静脉内皮细胞的影响及机制。方法将培养的颈性眩晕血瘀证患者血清损伤的人脐静脉内皮细胞(HUVEC-C)分为血瘀证组(DMEM+10%患者血清+0mmHg)、低压组(DMEM+10%患者血清+90mmHg)和高压组(DMEM+10%患者血清+180mmHg),健康对照组(DMEM培养液细胞+10%健康人血清+0mmHg),于相应压力干预实验后,倒置显微镜下观察其形态学变化,MTT法检测其活性,硝酸还原酶法检测一氧化氮(NO)浓度,放射免疫分析技术测定内皮素(ET)。结果经过低压力刺激干预后细胞形态有一定变化,细胞活性有所提高,增加NO释放、抑制细胞ET释放,而高压力刺激则无显著影响。结论颈性眩晕血瘀证患者血清可以损伤血管内皮细胞,适当的压力刺激能增强细胞的活性和维持细胞的形态结构,压力刺激调节血管内皮细胞血管舒缩活性物质ET、NO合成释放,这可能是手法发挥活血化瘀功效的细胞生物学机制之一。
推拿手法压力刺激颈性眩晕内皮细胞
【Abstract】Objective:To study the effect and mechanism of stress stimulation ofmanipulation on endothelial cellswith serum induced injury in patientswith blood stasis syndrome of cervical vertigo.M ethods:The cultivated HUVEC-C of injury induced by the serum of the patient of blood stasis syndrome(BSS)were divided into blood stasis syndrome group(DMEM+10%serum of the patient+0 mmHg),low pressure group(DMEM+10% serum of the patient+90 mmHg),high pressure group(DMEM+10%serum of the patient+180 mmHg)and healthy control group(DMEM cell of nutrient solution+10%healthy human serum+0mmHg).After corresponding stress intervenes in the experiment,the change of its configuration was put upside down under themicroscope and observed,and its activity was tested by MTT assay,nitric reductase assay to measure NO concentration and radioimmunoassay(RIA)tomeasure ET.Results:After intervention of low stress stimulation,the cell configuration had some changes.Cell activity increased.It could increase NO release and inhibit release of ET.However,there was no obvious effectunder the high stress stimulation.Conclusion:The serum of the patientof blood stasis syndrome(BSS)can injure the vascular endothelial cell.Appropriate stress stimulation can increase the cell activity and maintain the cell configuration.Stress stimulation can regulate the synthetic release of ET and NO of vascular active substances in vascular endothelial cell,which may be one ofmechanisms of cell biology through technique effects of activating blood circulation to dissipate blood stasis.
【Key words】Manipulationmaneuver;Stress stimulation;Cervical vertigo;Endothelial cell
血管内皮细胞损伤在颈性眩晕及和血瘀证发病中起到重要作用,中医推拿通过调控血管内皮功能治疗颈性眩晕具有良好效果,推拿起效往往又通过手法操作时产生的活血化瘀效应。从目前研究看,推拿治疗颈性眩晕产生活血化瘀效应的研究多着眼于颈部软组织、骨关节等层面,如松解痉挛的颈部肌群、纠正错缝
关节,增加椎动脉血流量等,这些研究毕竟属于宏观层面的研究,缺少细胞分子等微观层面的探讨,给临床、教学、科研带来了诸多不便,严重制约中医推拿的发展。要想在细胞分子等微观层面探讨推拿活血化瘀效应的细胞力学机制,那么构建推拿对细胞的力学加载模型必不可少[1-2]。本课题利用颈性眩晕血瘀证患者血清损伤培养的正常脐静脉内皮细胞建立血管内皮损伤模型,采用能屏蔽体内各种干扰因素的体外细胞生物学实验为研究手段,实施压力刺激模拟一维推拿力学手法,形成具有病证结合特点的推拿对损伤细胞的力学加载模型,观察血管内皮细胞形态学变化及合成释放血管舒缩活性物质内皮素(ET)和一氧化氮(NO)的变化,为手法机械力学刺激“活血化瘀”理论提供细胞生物力学方面的基础。现报告如下。
1 材料与方法
1.1细胞来源及试剂人脐静脉内皮细胞株(HUVEC-C)购自武汉大学中国典型培养物保藏中心。DMEM培养基为Gibco公司产品;南美胎牛血清为Gibco公司产品;胰蛋白酶、四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)为Sigma公司产品;NO试剂盒(南京建成生物工程研究所);ET放免试剂盒(北京东亚免疫技术研究所),其他试剂如碳酸氢钠、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、葡萄糖均为国产分析纯。1.2病例选择收集2015年8月至2015年11月广东省中西医结合医院康复科门诊及住院确诊,颈性眩晕血瘀证患者20例为患者组。颈性眩晕的诊断标准参照全国第2届颈椎病专题座谈会制定的诊断分型标准[3]及《中药新药临床研究指导原则》[4]制定。1)发病常与颈部体位改变有关;2)头痛,发作性或慢性头痛,头痛位于枕部;3)后颈部触诊检查,患者棘突多有病理性移位,相应的关节囊部位肿胀、压痛;4)仰头或转头试验阳性,作该试验可诱发眩晕,恶心,耳鸣,视力减退,或卒倒;5)可伴发神经根症状;6)X线平片可见正位片双侧钩椎关节变尖,侧方增生,棘突移位偏向一侧;侧位片生理曲度消失、变直,椎间隙狭窄,项韧带钙化;斜位片可见椎间孔变小,钩椎关节骨质增生;7)经颅多普勒超声(TCD),一侧或双侧椎-基底动脉血流速度降低,脑血流量相对减少(一部分为流速加快)。血瘀证诊断参照1986年修订的诊断标准[5]。选择2015年8月至2015年9月广东省中西医结合医院招募健康志愿者20例为对照组。
1.3血清收集患者组及对照组均空腹取血,置入无菌带帽不抗凝干燥试管,自凝后离心(4℃,2000 r/min,15min),取上清液置无菌EP管,冻存于-20℃,备用[6-7]。酶标仪680型为美国Bio-rad公司产品。倒置相差显微镜及摄影装置为德国Leica公司等。
1.4细胞培养取人脐静脉内皮细胞株人脐静脉内皮细胞株(HUVEC-C),所有操作均采用对数生长期细胞。解冻复苏后以含10%胎牛血清的DMEM培养基培养,以0.25%胰酶消化传代。用于共聚焦显微镜观察的细胞种于0.5×0.5 cm2的盖玻片上,所有操作均采用对数生长期细胞。
1.5细胞损伤模型的建立及传代培养静态培养颈性眩晕血瘀证血管内皮细胞:参考相关文献及预实验[7-9]拟定。取颈性眩晕血瘀证患者血清(含体积分数为10%的CV患者血清培养液),干预人脐静脉内皮细胞(取对数生长期),造成颈性眩晕血瘀证引起的血管内皮细胞损伤。传代培养:倒置相差显微镜镜下观察和记录细胞形态变化,细胞成铺路石样,单层生长、多形性、多梭形镶嵌排列,每2~3日更换1次培养基,当细胞长满瓶壁的80%以上时传代。
1.6细胞加力前培养[10-11]取对数生长期细胞,弃培养液,加入0.25%胰酶+0.1%EDTA混合消化液消化细胞,约3~5 min;当瓶底出现针孔样透明时,用含10%小牛血清的DMEM终止消化细胞,调整细胞密度,按2×105/mL接种于6孔培养板;显微镜下见细胞完全贴壁生长后,继续培养72 h;弃含10%小牛血清的DMEM培养液,准确更换含5%小牛血清的DMEM培养液3mL,再培养24 h,使细胞同步化,备用。
1.7分组将实验血管内皮细胞样本随机分组,1)健康组:9000μL DMEM+1000μL健康人血清+0 mmHg压力刺激。2)血瘀组:9000μL DMEM+1000μL血瘀证患者血清+0mmHg压力刺激。3)低压力组:9000μL DMEM+1000μL血瘀证患者血清+90 mmHg压力刺激。4)高压力组:9000μL DMEM+1000μL血瘀证患者血清+180mmHg压力刺激。比较力学刺激对血管内皮细胞生物学状况的影响。
1.8细胞力学加载方法1)低压力组及高压力组:将压力刺激组的血管内皮细胞置于压力装置中,然后移入37℃含5%CO2孵箱中,通过进气阀向高压锅内持续供应气体以调节压力稳定在预定的水平。维持压力装置内的压力分别达到90 mmHg和180 mmHg,每组每次加压时间都为2 h,两次加力间隔24 h,共加力2次,加力完成后取出细胞培养板,观察并提取细胞上清液或固定盖玻片上培养细胞以备检测。2)健康组及血瘀证组:将血管内皮细胞置于37℃含5%CO2孵箱中,不施加压力刺激,于压力组实验开始同步培养,实验结束后取出细胞培养板,提取细胞培养液以备检测。1.9指标检测1)细胞的形态观察:HUVEC-C细胞经过干预后于倒置相差显微镜下观察各组细胞的形态。2)MTT法检测细胞活性:将用不同条件培养基干预的每组8个复孔内皮细胞分别加入20μL MTT(5 mg/mL),孵育4 h,倾去上清液,每孔加二甲基亚砜(DMSO)150μL,振荡10 min,使蓝紫色结晶充分溶解,实验结束后,在全自动酶标仪570 nm波长处测定各孔的OD值。3)对细胞内分泌功能的影响:细胞培养液中NO的测定采用硝酸还原酶法测定各组细胞培养上清液中NO含量,按试剂盒操作步骤进行;细胞培养液中ET的测定采用放射免疫分析技术检测。各组取上清液500μL,用高速冷冻离心机制成干粉,然后稀释成100μL的待测样品进行实验。按ET测定试剂盒所述的均相竞争法和非平衡法处理样品,利用放射免疫γ计数器测定样品中ET含量[12]。
1.10统计学处理应用SPSS13.0统计软件。计量资料以(±s)表示,样本均数间的比较采用t检验;与对照组的比较用单因素方差分析和组间q检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组细胞形态比较倒置相差显微镜下观察如图1。1)健康组:细胞呈扁平状、长梭形、多角形或椭圆形,镶嵌状紧密排列,细胞核居中稍微隆起,部分细胞轮廓亦不清。2)血瘀证组:细胞多呈多角形或椭圆形,部分甚至呈圆形,细胞间隙变宽,部分细胞轮廓不清,大多细胞胞浆中有暗色颗粒,细胞碎片较多。3)低压力组:细胞呈长梭形、多角形或椭圆形,镶嵌状紧密排列,部分细胞胞浆中有暗色颗粒,部分细胞轮廓亦不清。4)高压力组:多数细胞收缩变形,部分呈椭圆形,细胞碎片较多,部分细胞轮廓不清,细胞间隙变宽,大多细胞胞浆中有暗色颗粒。
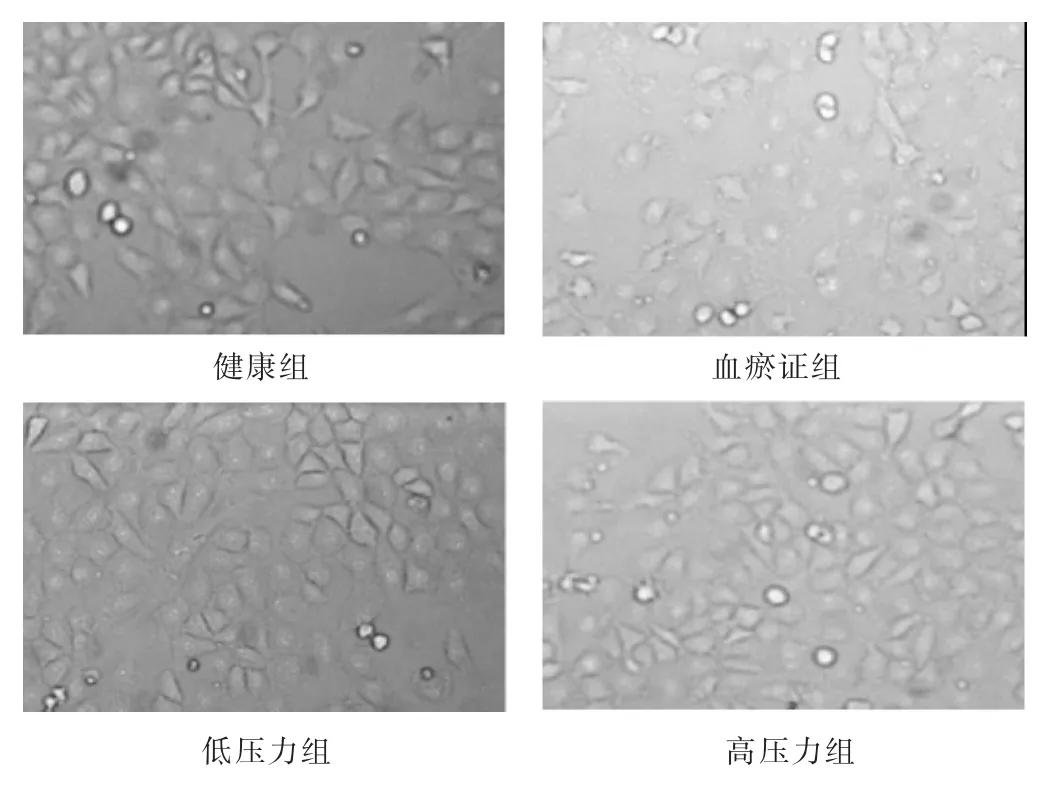
图1 倒置相差显微镜下观察(200倍)
2.2MTT法检测细胞活性见表1。血瘀证组与健康组比较,细胞活性差异有统计学意义(P<0.01),加不同压力刺激干预后,低压力组与血瘀证组相比,细胞活性差异有统计学意义(P<0.01),高压力组和与血瘀证组相比,细胞活性差异无统计学意义(P>0.05)。高低压力组比较细胞活性差异有统计学意义(P<0.01)。
表1 各组患者血清对细胞活性及内分泌功能影响比较(
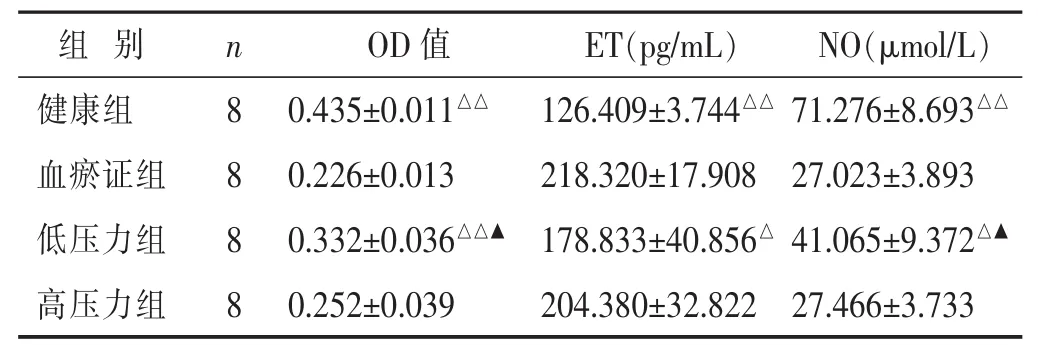
表1 各组患者血清对细胞活性及内分泌功能影响比较(
与血瘀证组比较,△P<0.05,△△P<0.01;与高压力组比较,▲P<0.01。
组别n OD值ET(pg/mL)NO(μmol/L)健康组8血瘀证组8低压力组8 0.435±0.011△△0.226±0.013 0.332±0.036△△▲126.409±3.744△△71.276±8.693△△218.320±17.908 27.023±3.893 178.833±40.856△41.065±9.372△▲高压力组8 0.252±0.039 204.380±32.822 27.466±3.733
2.3对细胞内分泌功能的影响见表1。1)血瘀证组与健康组比较,ET含量差异有统计学意义(P<0.01),加不同压力刺激干预后,低压力组与血瘀证组相比,ET含量差异有统计学意义(P<0.05),高压力组与血瘀证组相比ET含量差异无统计学意义(P>0.05)。高低压力组比较ET含量差异无统计学意义(P>0.05)。2)血瘀证组与健康组比较,NO含量差异有统计学意义(P<0.01),加不同压力刺激干预后,低压力组与血瘀证组相比,NO含量差异有统计学意义(P<0.05)。高压力组和与血瘀证组相比NO含量差异无统计学意义(P>0.05)。高低压力组比较NO含量差异有统计学意义(P<0.01)。
3 讨 论
血瘀证见于临床多科疾病,血管内皮损伤为其共同的病理基础。因此临床同样要重视血管内皮功能损伤在颈性眩晕发病中的作用。目前中药的活血化瘀效应已经得到很好的研究共识,而推拿疗法虽然疗效确切,但许多机制尚未明确,而尤其是推拿活血化瘀效应还缺少微观上的探讨,因此本次研究以推拿对颈性眩晕血瘀证患者血清诱导的血管内皮细胞损伤模型作为研究的突破口,然后运用细胞生物力学技术模拟推拿力学刺激对损伤模型进行干预,因此有可能从微观角度阐明推拿治疗颈性眩晕的活血化瘀效应是由手法机械刺激改变血管内皮细胞功能的调节作用所致[13-15]。
本次研究从血管内皮细胞形态学变化、细胞活性、细胞内分泌功能分析了压力刺激对颈性眩晕血瘀证患者血清诱导的血管内皮细胞损伤模型的机制。从细胞形态学看:颈性眩晕血瘀证患者的血管内皮损伤的程度明显,和健康组、压力刺激组有明显区别;从细胞活性看:和健康组相比,颈性眩晕血瘀证患者血清可以降低血管内皮细胞的活性,而经过低压力刺激后细胞的OD值明显提高,但是和健康组相比还是有较大差异,同时表明适当的力学干预能增强细胞的活性和维持细胞的形态结构;从细胞内分泌功能看:采用了最常用的血管舒缩因子ET及NO进行检测,NO是最主要的血管舒张因子,而ET是迄今所知的最强力的血管收缩因子,ET和NO的平衡对维持正常的血管内皮功能起到至关重要的作用,本次实验也表明低压力刺激在一定程度增加NO释放、而抑制细胞ET释放,这些均表明一定的低压力刺激对损伤的血管内皮细胞具有一定的修复作用。
当然推拿作为机械力刺激的一种,不仅仅表现为压力刺激,手法在作用时往往还包括了牵张力、剪切力的多种形式,而且还存在不同力学动力学参数的组合,如力学刺激的力量、频率、时间,不同的发力形式、不同手法力学参数的组合势必对损伤的血管内皮细胞模型产生不同的影响结果,这些均值得我们作进一步探讨。
[1]范志勇,查和萍,陈利国,等.病证结合思维对细胞推拿模型构建的启示[J].按摩与康复医学杂志,2012,3(11):69-70.
[2]范志勇,查和萍,陈利国,等.细胞推拿模型的构建及作用机制研究进展[J].上海中医药大学学报,2011,34(5):42-43.
[3]孙宇,陈琪福.第二届颈椎病专题座谈会纪要[J].中华外科杂志,1993,31(8):472-474.
[4]中华人民共和国卫生部.中药新药临床研究指导原则[M].北京:中国医药科技出版社,2002:349.
[5]第二届全国活血化瘀研究学术会议.血瘀证诊断标准[J].中国中西医结合杂志,1987,7(3):129.
[6]张竞之,陈利国,贾会欣,等.高血压病血瘀证患者血清对HUVEC-C形态、活性的影响[J].辽宁中医杂志,2011,38(2):206-208.
[7]张竞之,陈小忆,金伟孝,等.丹皮酚对高血压病血瘀证患者血清损伤的HUVEC-C形态学、活性的影响[J].辽宁中医药大学学报,2012,14(6):29-31.
[8]陈利国,胡小勤.论病证结合血瘀证血管内皮细胞损伤模型的建立[J].中国中西医结合杂志,2007,27(3):267-269.
[9]彭志允,陈利国,范志勇,等.丹参酮ⅡA对血管内皮细胞损伤后vWF和TMmRNA的表达的影响[J].中华中医药杂志,2014,29(3):708-710.
[10]江瑜,陈波,李程,等.体外压力刺激对血管内皮细胞ET-1、PGI2、IFN-β和TNF-α合成释放影响的研究[J].按摩与康复医学,2015,6(18):134-136.
[11]李程,江瑜,陈磊,等.动态力学刺激对血管内皮细胞血管舒缩活性物质ET-1和PGI-2合成释放影响的研究[J].时珍国医国药,2014,1(1):封2.
[12]李眺,陈利国,李权,等.川芎嗪配伍黄芪多糖对血管内皮细胞的保护作用[J].中华中医药杂志,2011,26(11):2672-2674.
[13]范志勇,陈利国,张志坚,等.从细胞力学的角度探讨手法力学刺激所致细胞应力效应[J].中国康复,2013,28(3):216-218.
[14]范志勇,吴山,林应强,等.基于微观血瘀探讨血管内皮细胞损伤在颈性眩晕中的发病机制[J].成都中医药大学学报,2014,37(3):124-126.
[15]陈波,江瑜,张小珊,等.机体非神经组织力学敏感细胞的研究与针推治疗作用机理的新思考[J].贵阳中医学院学报,2012,34(1):9-12
Effect of Stress Stimulation of M anipulation on Endothelial Cells w ith Serum Induced Injury in Patients w ith Blood Stasis Syndrome of Cervical Vertigo
FU Pinlai,FAN Zhiyong,ZHANG Jingzhi,et al.Integrated Chinese and Western Medicine Hospital of Guangdong Provincial,Guangdong,Foshan 528200,China.
R255.3
A
1004-745X(2016)09-1656-04
10.3969/j.issn.1004-745X.2016.09.004
2016-06-20)
国家自然科学基金项目(81373520);广东省自然科学基金(2015A030313345);广东省建设中医药强省科研立项(20141038);广东省佛山市科技局医学类科技攻关项目(201308177)
(电子邮箱:fzystrong@163.com)

