慢性乙型肝炎患者HBV基因耐药突变分析
郝建宏,胡忆玲,林爱清
慢性乙型肝炎患者HBV基因耐药突变分析
郝建宏,胡忆玲,林爱清
目的探讨慢性乙型肝炎患者HBV基因耐药突变情况。方法收集2010年12月至2014年12月我院感染病科诊治的慢性乙型肝炎患者60例,均为使用拉米夫定或阿德福韦酯后出现病毒学突变的患者,采用荧光定量PCR法检测HBV DNA,采用ELISA法检测HBeAg和HBeAb定量,对血清HBV DNA直接进行基因测序。结果在60例患者,发现rtl 180M阳性17%,rtm 204V阳性20%,rtn 236T阳性12%,rtA 181V/T阳性10%;rtl 180M阳性和rtm 204V阳性患者HBV DNA拷贝数较高,rtn 236T阳性患者较rtn 236T阴性患者ALT和HBV DNA拷贝数较低;rtA 181V/T阳性患者较rtA 181V/T阴性患者ALT水平高。结论rtl 180M、rtm 204V、rtn 236T和rtA 181V/T变异多见于年龄大、病程长的患者,HBV DNA拷贝数升高先于ALT升高者,预后较差,其中rtl 180M和rtm 204V变异患者病情容易复发。
慢性乙型肝炎;HBV DNA;基因变异
Hepatitis B;HBV DNA;Gene mutation
我国乙型肝炎流行率约为7.18%。据统计,全球慢性HBV感染者约2.4亿,我国约占40%[1,2]。乙型肝炎的特点为起病隐
匿,以亚临床及慢性感染较常见,是导致肝硬化和肝癌的最主要因素。核苷(酸)类似物可有效抑制乙型肝炎病毒复制,降低肝硬化和肝癌的发生率。长期服药可导致乙型肝炎病毒出现YMDD区段变异,进而使HBV对拉米夫定产生耐药,使患者体内病毒复制反弹。对HBV复制的判断最可靠和精确的方法是从患者体内检出HBV DNA,再对DNA测序来确定病毒变异。本文探讨了HBV DNA基因位点变异特点及其影响因素,以期为临床诊断、治疗和判断预后提供科学依据。
1 资料与方法
1.1研究对象回顾性分析我科2010年12月至2014年
12月住院的慢性乙型肝炎患者60例,均为使用拉米夫定或阿德福韦酯后出现病情反复的患者,临床诊断符合2010年发布的《慢性乙型肝炎防治指南》的标准[3]。排除药物性肝损伤、酒精性肝炎、中毒性肝炎及其他疾病所致的肝功能异常。
1.2实验室指标使用OLYMPUS AU5400全自动生化分析仪检测血生化指标(试剂由上海德赛有限公司提供);采用荧光定量PCR法检测HBV DNA(DA7600,试剂由中山达安有限公司提供);采用ELISA法检测HBeAg和HBeAb定量(SYM-BIO荧光免疫分析仪,试剂由苏州新波生物技术有限公司提供)。
1.3血清HBV DNA基因测序患者血清保存于-80℃冰箱,定期加干冰送往北京地坛医院肝病研究所。使用德国Roche MagNA Pure LC全自动核酸提取、加样系统,获得HBV DNA模板后,使用美国PE9600扩增仪扩增,用Promega公司的PCR产物纯化试剂盒纯化PCR产物,纯化产物经Beckman测序试剂盒进行测序。使用美国Beckman Coulter CEQ8000 Genetic Analysis System检测,获得HBV DNA序列和图谱。
1.4统计学处理所有统计分析均应用SPSS 17.0统计软件包处理,计量资料以±s表示,两样本均数的比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1一般资料在慢性乙型肝炎患者60例中,男41例,女19例,年龄25~75岁,平均年龄(53.13±10.71)岁,平均病程(57.37±74.32)个月。发现rtl 180M阳性17%,rtm 204V阳性20%,rtn 236T阳性12%,rtA 181V/T阳性10%。60例患者均服用阿德福韦酯【葛兰素史克(天津)有限公司】10 mg,1次/d或拉米夫定片【葛兰素史克制药(苏州)有限公司】100mg,1次/d,时间为6~12个月。
2.2不同HBV基因变异患者肝功能和病毒载量的比较rtl 180M阳性和rtm 204V阳性患者血清HBV DNA拷贝数较高,rtn 236T阳性患者较rtn 236T阴性患者ALT水平和HBV DNA拷贝数较低,rtA 181V/T阳性患者较rtA 181V/T阴性患者ALT水平高(表1)。
2.3HBbeAg阳性与阴性患者HBV基因变异情况比较rtl 180M阳性和rtm 204V阳性患者HbeAg阴转率低(表2)。
表1 不同HBV基因变异患者肝功能和病毒载量(±s)的比较

表1 不同HBV基因变异患者肝功能和病毒载量(±s)的比较
与其阴性组比,①P<0.05
基因位点例数AST(U/L)GGT(U/L)ALT(U/L)HBV DNA(lg cp/ml)rtl 180M阳性1043.32±11.8738.83±10.1960.54±13.655.43±2.53①rtl 180M阴性5040.34±9.4735.29±9.1834.53±6.434.65±2.69 rtm 204V阳性1241.34±9.2242.18±9.1055.34±13.586.48±1.48 rtm 204V阴性4845.28±8.5840.92±11.4776.38±9.275.38±2.03 rtn 236T阳性732.82±8.2118.92±4.1822.38±8.38①4.32±1.98①rtn 236T阴性5330.19±7.0632.19±5.2848.38±14.385.32±2.10 rtA 181V/T阳性631.06±5.2923.91±5.8324.28±6.38①3.19±0.34 rtA 181V/T阴性4424.27±6.4912.38±4.6316.38±7.393.21±0.39
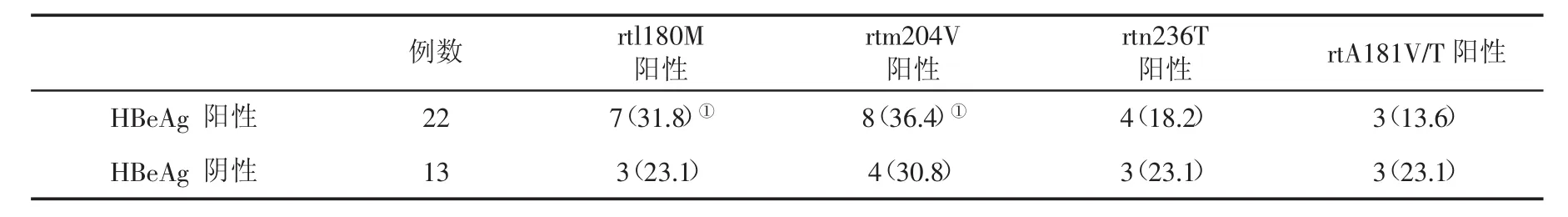
表2 HBeAg阳性与阴性患者HBV基因变异(%)情况比较
3 讨论
HBV DNA感染人体后在肝细胞核内形成共价闭合环状DNA(cccDNA),并以其为模板不断进行复制。正常情况下,药物通过特异性地与HBV聚合酶中的某一部位结合,引起病毒DNA双链断裂,进而通过影响病毒复制而发挥抗病毒的作用。然而,长期使用拉米夫定等核苷类似物可诱发HBV多聚酶编码基因区的点突变[4],导致药物有效性下降。同时,由于HBVcccDNA半衰期长,很难从体内彻底清除,需要长时间抗病毒治疗,耐药发生率亦逐年增加。
乙型肝炎病毒耐药包括基因型耐药和表型耐药。HBV基因型耐药是通过分析药物作用靶位,即HBV RT基因序列的改变,推导相应氨基酸的改变,以确定病毒是否产生了基因型耐药,其前提是所检测的突变已被证实可以引起耐药。HBV基因型耐药分析至少需要包括rt180、rt181、rt184、rt202、rt204、rt236和rt250等7个位点相关[5~7]。表型耐药是确定基因型耐药检测结果的最终方法,也是发现新的耐药突变位点以及潜在的交叉耐药位点的手段。目前,表型耐药检测仅用于基础研究领域,尚未应用于临床,严重影响了病毒学、分子生物学、免疫学以及抗病毒治疗等方面的研究。因此,建立一种可行的、相对简单快速的分析方法可促进表型耐药分析在临床中的应用,从而辅助临床医生更加准确地判断病情、制定个体化的抗病毒方案,达到持续抑制HBV复制和缓解肝脏疾病的目的。
乙型肝炎病毒基因变异的检测方法学研究较多。基因突变位点的检测可以用酶切法、变性梯度凝胶电泳法、变性高压液相电泳法等多种方法,但最终仍需要通过DNA测序来确定突变位置和类型[7]。本研究直接采用DNA测序检测基因变异。研究发现rtl 180M阳性和rtm 204V阳性患者HBeAg阴转率低,rtn 236T阳性和rtA 181V/T阳性患者血清HBeAg无明显变化,与国内研究结果相似[8、9]。发现rtl 180M 和rtm 204V变异患者年龄较大、病程较长、HBV DNA拷贝数较高,rtn 236T变异患者较rtn 236T正常患者年龄和病程长,但ALT和HBV DNA拷贝数较低;rtA 181V/T变异患者较rtA 181V/T正常患者病程长和ALT高。有研究认为,N236T突变与rt181T突变互为补偿突变,一种突变可以增强另一种突变的病毒复制力和适应能力,而且N236T突变与rt181T联合突变可引起肝脏炎症的波动,导致患者血清ALT升高,该结果与我们观察到的结果一致[10]。杨松等认为以rtA 181T变异为主,本研究病例数较少,因而未得出相似的结论[11]。有研究通过体外试验证实rta181T/HBeAg截短变异有潜在致癌作用[12、13]。本研究在探讨HBV DNA基因位点变异与乙型肝炎患者预后的关系时发现rtl 180M、rtm 204V、rtn 236T和rtA 181V/T变异患者预后较差,其中rtl 180M和rtm 204V变异患者病情容易复发。
乙型肝炎病毒耐药可增加肝硬化及肝癌发生率,并可能逆转已改善的肝脏组织学损害,使后续治疗变得更加复杂,增加长期治疗成本[14]。临床医师应密切关注乙型肝炎长期治疗过程中基因变异的发生及由此所引发的病毒学反弹、肝功能恶化等,并权衡抗病毒效果与耐药后可能带来的病情加重之间的利弊,尤其是终末期肝病患者。如出现病毒变异耐药,应根据患者的个体情况调整抗病毒药物治疗,避免造成因突然停药导致的病毒大量复制,进而进一步加重病情。
[1]齐小秋,王宇.全国人群乙型病毒性肝炎血清流行病学调查报告.北京:人民卫生出版社,2011:53-55.
[2]World Health Organization.Hepatitis B.Geneva:World Health Organization,2015.
[3]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[4]One-NitaSK,Kato N,ShiratoriY,etal.YMDDmotifin hepatitis B virus DNA polymerase influences on replication and lamivudine resistance:A study by in vitro full-length viral DNA transfection.Hepatology,1999,29(3):939-945.
[5]徐东平.乙型肝炎病毒耐药的检测方法与临床意义.解放军医学杂志,2010,35(6):610-613.
[6]叶晓玲,刘妍,徐东平.乙型肝炎病毒阿德福韦酯耐药相关变异的研究进展.实用肝脏病杂志,2015,18(3):312-316.
[7]李华珊,王宇,马红.乙型肝炎病毒耐药突变检测方法应用研究进展.中华肝脏病杂志,2014,22(11),860-862.
[8]苏荣,杨延斌,伍芷青,等.HbeAg、HBV-DNA载量及ALT在慢性乙型肝炎患者不同药物治、疗中的变化分析.现代预防医学,2014,41(9):1678-1680.
[9]戚应杰,岳莉,朱义媛,等.乙型肝炎病毒耐药基因变异位点与基因型及病毒载量的关系.国际检验医学杂志,2015,36(3):392-394.
[10]赵攀,徐东平,李晓东,等.乙型肝炎病毒逆转录酶区N236T单独突变与N236T突变与rt181T联合突变患者临床特征的比较.第二军医大学学报,2010,31(8):834-836.
[11]杨松,邢卉春,姚永远,等.阿德福韦酯治疗应答不佳的慢性乙型肝炎患者的耐药分析.中华实验和临床感染病杂志,2015,9 (1):10-13.
[12]Kitchell E,Jain MK.Evaluation and treatment of the patient coinfected with hepatitis B and HIV.Antivir Ther,2007,12(5):761-768.
[13]梁雪松,万谟彬.核苷(酸)类似物长期治疗的常见耐药位点及发生率.中华肝脏病杂志,2007,15:55-56.
[14]贾德兴,冯静,李萍,等.拉米夫定和阿德福韦酯抗乙型肝炎病毒耐药位点检测及临床意义.实用肝脏病杂志,2014,17(5):497-501.
(收稿:2016-02-17)
(本文编辑:陈宗炳)
·短篇论著·
10.3969/j.issn.1672-5069.2016.04.022
内蒙古自治区科研基金资助项目(编号:NJZZ11173)
014010内蒙古自治区包头市包头医学院第一附属医院感染性疾病科
郝建宏,女,35岁,医学硕士,副主任医师。主要从事感染性疾病诊断与治疗学研究。E-mail:haohongnm0@163.com
林爱清,E-mail:184650553@qq.com
Hepatitis Bviral genemutationinpatients withhepatitis BHao Jianhong,Hu Yiling,Lin Aiqing.Department of Infectious Diseases,First Affiliated Hospital,Batou Medical College,Baotou 014010,Inner Mongolia Municipality

