2种块菌的物种分子鉴定与系统地位分析
樊永军,赵艳玲,陈秀莉,闫 伟
(1 包头师范学院 生物科学与技术学院,内蒙古包头 014030;2 内蒙古农业大学 林学院,呼和浩特 010018)
2种块菌的物种分子鉴定与系统地位分析
樊永军1,赵艳玲1,陈秀莉1,闫 伟2*
(1 包头师范学院 生物科学与技术学院,内蒙古包头 014030;2 内蒙古农业大学 林学院,呼和浩特 010018)
以采自内蒙古贺兰山地区的2种块菌为实验材料,分别运用形态学和分子生物学方法进行物种鉴定,并通过与GenBank数据库信息比对,利用Mega5.1软件构建系统进化树,分析其进化关系并确定2种块菌的进化地位。结果表明:两菌株子囊果都为地下生;其中,菌株order-a为灰黄色,近球形到不规则形,较硬,表面被覆微绒毛;菌株tuber-b呈黄褐色,质地均匀,表面有疣状物,顶端呈凹陷状,全株带有干果般特殊的香气。经分子生物学方法分析认为菌株order-a为块菌属的一种,tuber-b为冬块菌(Tuberbrumale), 并初步确定为内蒙古新记录种。
块菌;ITS;物种鉴定;系统地位
块菌(truffles)属于子囊菌亚门(Ascamycotina)块菌科(Tuberaceae)块菌属(Tuber),是与树木共生的外生菌根真菌[1]。迄今为止,已知的块菌种属呈现世界性分布,全球范围内所描述的块菌属真菌估计在60种以上,据《菌物词典》(第9版)记载,一共确定了63个种,主要产自西班牙、意大利、法国等欧洲国家,分布于南温带的森林地区和北温带的森林地区,只有极少数分布于干旱的荒漠、半荒漠地带和亚热带的林区[2]。块菌在中国的分布地区主要是西南地区的云南和四川,海拔在 1 600~2 600 m的针叶林或针阔混交林下,西北的新疆和西藏等地。此外在河北、山西、湖南、吉林、甘肃、辽宁、北京、福建、湖北和台湾等地均有分布。到目前为止,不同文献报道在中国发现的块菌种类有28种之多。由于块菌的研究在中国起步比西方国家晚,所以不同文献对于中国块菌名录记载的数量和种类也有所不同。如:徐阿生等[3]报道了21个种,Zhuang等[4-5]报道了13个种,陈毅坚等[6]报道了25个种,陈应龙等[7]报道了28个种,陈娟等[8]报道了16个种,任德军等[9]报道了20个种,方明[10]报道则认为在中国确认分布的种有15个,郭尚等[11]报道了26种。
传统的形态学鉴定方法常常因为地理和环境条件等因素的影响而发生分歧,在国际上分子生物学技术已经被引入到块菌鉴定等研究中,如Percudani 等[12]利用18S rDNA研究了Terfeziaceae和Tuberaceae在Pezizales中的系统发育位置;Urbanelli 等[13]利用同工酶分析对块菌的系统学进行了研究;Rubini 等[14]利用核糖体DNA的不同区段特异性差异来区别T.brumale、T.melanosporum和T.indicum;Mello等[15]利用18S rDNA的区段将T.borchii和T.maculatum进行了区分等。本研究旨在形态学和解剖学分类的基础上,利用ITS1-5.8S rDNA-ITS2基因核酸序列分析对2株未知块菌进行分类鉴定,并利用相关软件构建系统进化树,确定其分类演化地位。
1 研究地概况
贺兰山自然保护区位于N38°20′50″~39°12′13″,E105°41′54″~106°05′03″。山体大体呈南北走向,南北长86 km,东西宽8 km,属阴山山系。总面积为67 709.9 hm2。气候具有明显的垂直分布规律,山麓与山顶气候差异大,山麓年降水量250~300 mm,年平均气温8.5 ℃,≥10 ℃年积温3 370 ℃,而山顶2 910 m处,年降水量438 mm,年平均气温4 ℃,≥10 ℃年积温在3 000 ℃以下,降水主要集中在7~8月份。同时,土壤垂直分异明显,随海拔高度和植被类型的变化有规律地分布,灰钙土是在荒漠草原形成的一类地带性土壤,分布于海拔1 900 m以下为山区及山前洪积扇地带,这一地段环境干旱,地层瘠薄,植被稀疏,其间真菌的分布较少,只有少数耐干旱的腹菌类生长;山地灰褐土分布于海拔1 900~3 100 m,含有机质较多,结构良好,是贺兰山高等真菌最繁盛的地带,其中海拔1 900~2 350 m的油松林、山杨林及虎棒子灌丛下为山地普通灰褐土,呈微碱性,含水量略低;海拔2 350~3 100 m为青海云杉纯林,其下为山地淋溶灰褐土,表面有数厘米厚的苔鲜层,呈中性,比较湿润,此段适宜高等真菌的生长发育;海拔3 100 m以上是亚高山灌丛与草甸植被,为山地草甸土,其间有少量大型真菌分布[16]。
2 材料和方法
2.1 材 料
实验样品于2015年2月采自内蒙古贺兰山国家级自然保护区,生境为青海云杉林+苔藓(表1)。
2.2 方 法
2.2.1 形态学分类鉴定 (1) 外部形态观察 观察指标:子实体的外部形态、颜色;菌体表面是否具疣状突起、基部是否凹陷;菌脉的密集程度、粗细,以及孢子囊、孢子的形态等。
(2) 显微结构观察 采用徒手切片法和石蜡切片法,观察孢子囊的形状、大小、壁厚,以及孢子的数目、大小、形状及表面的纹饰(网格状、刺状或网格-刺状)等。
2.2.2 分子生物学鉴定与分析 (1) PCR扩增 取少量经形态、解剖学方法分类的2种供试子实体约50~100 mg,采用传统CTAB法进行总DNA提取。
本实验中PCR反应所需试剂为一管便携式2×Master Mixture。rDNA的扩增引物为ITS1F和ITS4[17-18],PCR扩增反应在ABI(PE)-2700 PCR仪上进行,扩增产物用1.5%琼脂糖凝胶在0.5×TBE电泳缓冲液中电泳,以凝胶成像系统检测并记录扩增产物在琼脂糖凝胶上的图谱。
PCR扩增产物经电泳和凝胶成像系统检测后,运用天根生化科技有限公司的离心柱型普通琼脂糖凝胶DNA回收试剂盒从含有扩增产物条带的琼脂糖凝胶上回收、纯化,具体操作依试剂盒的操作手册。
用纯化后的PCR扩增产物和引物直接测序。测序均由上海生工生物工程公司完成。
(2) DNA序列系统进化分析 对测得的供试菌株rDNA ITS区段DNA序列运用Blast软件在DNA序列数据库中搜索同源序列并进行比较,在此基础上利用Mega5.1软件,采用Neighbor-Joining相邻比对法对order-a、tuber-b的同源性及相似性进行分析并构建系统进化树,确定其分类地位。

表1 样品采集信息
3 结果与分析
3.1 形态学及解剖学特征
菌株order-a如图1,A、B所示,子囊果地下生;灰黄色;近球形到不规则形;较硬;表面被覆微绒毛。包被分2层:外层淡黄色到淡黄褐色,内层透明到淡黄色,为交织组织至薄壁组织,少见表皮组织。包被内子实层具迷走状脉纹和褐色菌肉组织。子实层致密,呈乳黄色大理石状,菌脉团状,封闭,迷走状,在多处可到达包被边缘处。子囊近球形、阔椭圆形到不规则形;无柄或少见有柄,内含1~3(4)个子囊孢子;在产孢组织内自由排列。
菌株tuber-b如图1,C、D所示,其特征为子囊果地下生;呈黄褐色,质地均匀,表面有疣状物,顶端呈凹陷状,全株带有干果般特殊的香气。子实层较松散,在子实层内肉眼可见黑色颗粒状子囊,菌脉封闭,呈迷走状。切面呈现褐色,具色泽较浅的大理石状纹理。产孢组织颜色为灰黑色,子囊呈近球形或不规则形,无柄,内含幼嫩孢子1~5(6)、成熟孢子12~14个,孢子圆球形、椭圆形至长椭圆形,黄褐色,表面有密集的刺,于产孢组织内自由排列。
3.2 PCR扩增
从供试菌株中均提取到基因组DNA,经电泳和凝胶分析仪检测,提取的DNA在1.5%琼脂糖凝胶上电泳后均表现为单一清晰条带。经用紫外分光光度法检测,OD260/OD280>1.7,提取的DNA样品溶液浓度为100 μg/mL左右,其提取质量可满足进一步研究分析。以所获得基因组DNA为模板,选取2个特有引物进行PCR扩增ITS的部分序列,结果如图2所示,所得产物片段大小700 bp左右,与预期结果相一致,表明该方法提取获得的基因组DNA质量较好,能够满足基于PCR反应的后续分子生物学试验。
3.3 系统进化树的构建与分析
3.3.1 Neighbor-Joining tree的构建 运用GenBank 的序列局部相似性查询系统(BLAST),引用不同学者输入基因库中的隶属于块菌属(Tuber)的ITS区段序列,即冬块菌(Tuberbrumale)、勃氏块菌(T.borchii)、夏块菌(T.aestivum)、加洲块菌(T.californicum),每一种块菌引用3个序列;以及引用中甸块菌(T.zhongdianense)序列2个、刘氏块菌(T.liui)序列1个(表2)[19]。通过对所获得序列进行规范性修改及外类群的确定,然后运用Mega5.1软件采用Neighbor-Joining(相邻比对法)对order-a、tuber-b的同源性及相似性进行分析并构建进化树。并设置隶属于块菌科(Tuberaceae)的Choiromycesvenosus为外类群。
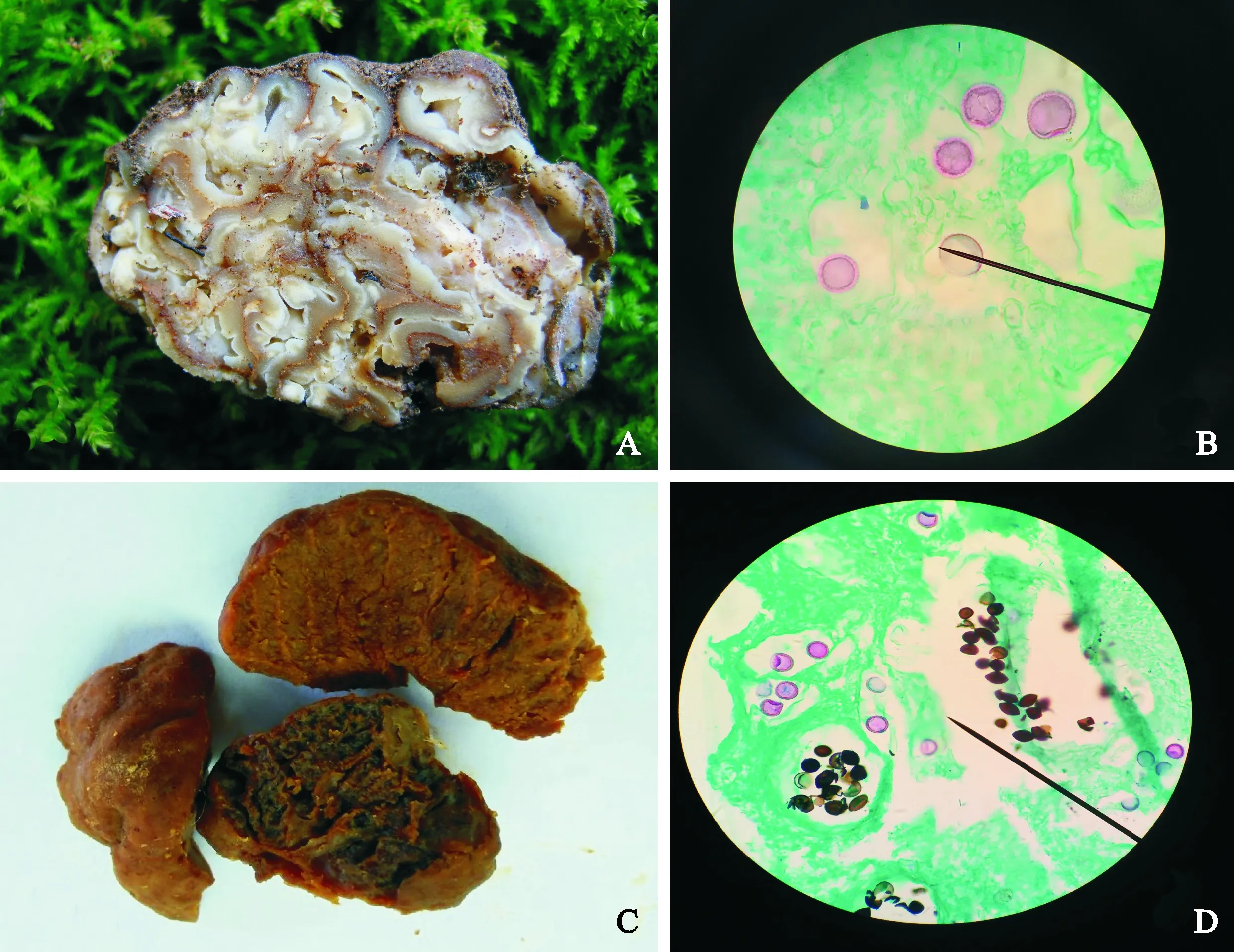
A. order-a外部形态结构(×45); B. order-a孢子显微结构图(×400) C. tuber-b外部形态结构(×45);D. tuber-b孢子显微结构图(×400)图1 2种块菌形态结构和孢子显微结构A. Morphological feature of order-a (×45); B. Microstructure feature of order-a spores(×400) C. Morphological feature of tuber-b (×45); D. Microstructure feature of tuber-b spores(×400)Fig.1 Morphological feature and microstructure feature of two truffles

A.样品PCR产物检测结果;B.样品纯化回收后检测结果;a.样品order-a的DNA跑胶结果;b.样品tuber-b的DNA跑胶结果图2 样品PCR产物及纯化回收后的电泳检测结果A. Amplification products of the samples; B. Purification of amplification products of the samples; a is results of gel electrophoresis of order-a; b is results of Gel electrophoresis of tuber-bFig.2 The check results of PCR products and purification products of the samples
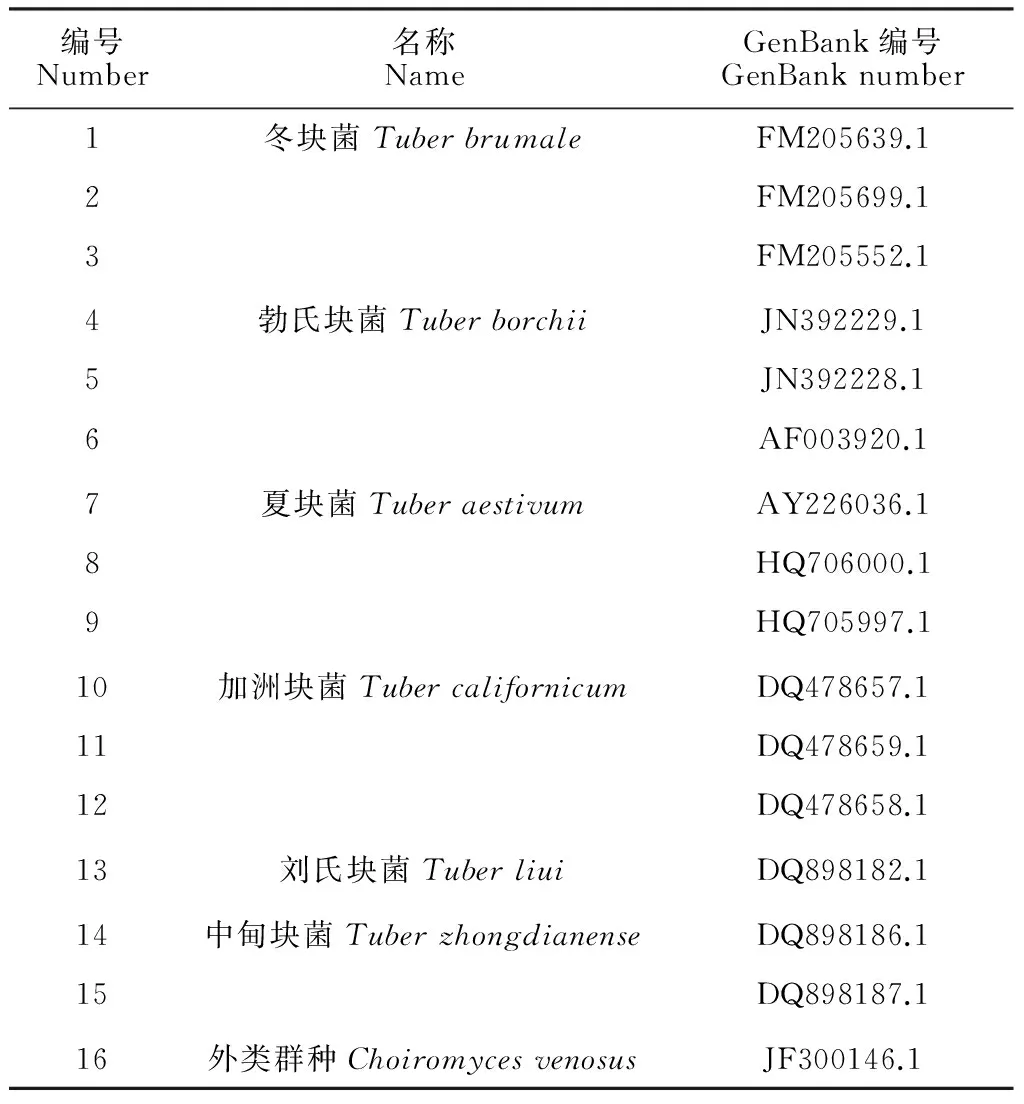
编号Number名称NameGenBank编号GenBanknumber1冬块菌TuberbrumaleFM205639.12FM205699.13FM205552.14勃氏块菌TuberborchiiJN392229.15JN392228.16AF003920.17夏块菌TuberaestivumAY226036.18HQ706000.19HQ705997.110加洲块菌TubercalifornicumDQ478657.111DQ478659.112DQ478658.113刘氏块菌TuberliuiDQ898182.114中甸块菌TuberzhongdianenseDQ898186.115DQ898187.116外类群种ChoiromycesvenosusJF300146.1
3.3.2 菌株order-a系统进化分析 如图3所示,由进化树上可以看出,冬块菌、勃氏块菌、夏块菌、加洲块菌分别聚为一枝,支持率都高于96%。其中,中甸块菌、刘氏块菌另聚一枝,支持率为86%。可以看出中甸块菌、刘氏块菌的亲缘关系较近。而order-a与冬块菌、勃氏块菌聚为一大枝,支持率为95%;相比冬块菌而言,order-a与勃氏块菌亲缘关系更近,支持率为61%;距外类群Choiromycesvenosus较远。由于支持率较低,初步确定为块菌属的一个种,还需进一步采样鉴定(图3)。
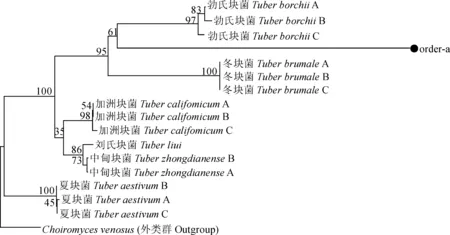
数值表示支持率,图4同图3 order-a系统进化树The value representing the support rate,the same asFig.3 The phylogenetic tree of order-a
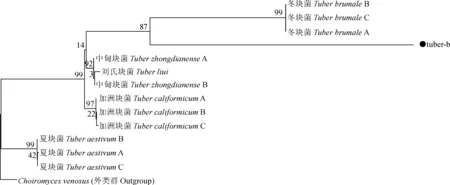
图4 tuber-b系统进化树Fig.4 The phylogenetic tree of tuber-b
3.3.3 菌株tuber-b系统进化分析 如图4,此进化树可分为4大枝。其中,本研究样品为一枝;夏块菌(T.aestivum)、加洲块菌(T.californicum)各为一枝;中甸块菌(T.zhongdianense)、刘氏块菌(T.liui)聚为另一枝,其支持率为92%,说明其亲缘关系较近;另一枝则为外类群(outgroup)。本实验样品与所选3株冬块菌(T.brumale)聚为一枝,支持率较高,达87%,说明其亲缘关系较近。因此结合其形态学特征初步确定此种为冬块菌(图4)。
4 讨 论
本研究中经对样品order-a进行构建系统进化发育树分析,暂定order-a为块菌属的一种,与其他块菌进化分支支持率比较,order-a与勃氏块菌亲缘关系支持率为61%;但在形态解剖结构方面,二者有许多相似之处,如:勃氏块菌子囊果地下生;灰黄色、淡黄褐色到灰褐色;近球形到不规则形;较硬;表面被毛或无。包被分2层:外层淡黄色到淡黄褐色,角胞组织,细胞多为近角形、近球形,少数角形、不规则形,表层细胞上生有毛,内层透明到淡黄色,为交织组织至薄壁组织,少见表皮组织。产孢组织褐色到黑褐色,多由交织组织构成,少有角胞组织、表皮组织;菌脉白色,较细,具分支,起源于基部。子囊近球形、阔椭圆形到不规则形;无柄或少见有柄,内含1~3(4)个子囊孢子;在产孢组织内自由排列[9];而样品order-a子囊果同样地下生,黄褐色,近球形到不规则形;较硬;表面被覆微绒毛,质地均匀。产孢组织颜色为黑色,孢子在未成熟时呈现圆筒形,成熟时则呈椭圆形,大多数含有8~12个子囊孢子,于产孢组织内自由排列。二者在子囊果的形态结构、颜色、质地、产孢组织颜色等方面非常相近,只是子囊孢子数量与形状略有差别,分析其可能与采集时间有关,但需要分子证据进一步证实。
供试菌株tuber-b经系统进化发育树分析,其与冬块菌亲缘关系较近,支持率达87%,结合形态学特征定名此种为冬块菌(T.brumale)。刘培贵等在块菌名实考证及其资源保护一文中对冬块菌的描述为成熟的子实体颜色为黑褐色,有特殊香味,表面也有明显的瘤突,瘤突呈多边形扁平的金字塔状。产孢组织幼嫩时白色,成熟后变成褐色,有白色的迷宫状的脉纹,脉纹较粗而且稀疏。子囊孢子椭圆形,长椭圆形,黄褐色,表面有密集的刺,和黑孢块菌相似。每个子囊含有子囊孢子的数目也多,可达6个孢子。冬块菌主要分布在欧州大陆,主产区在法国、意大利和西班牙。冬块菌的生境和黑孢块菌的生境十分相似,常常发生在同一菌塘内。土壤是石灰岩发育形成的石灰土,多石质,排水良好,pH值在7.5~8.0或以上[20]。与本研究中所采集块菌形态结构相似,有香味,且生境为海拔2 350~3 100 m青海云杉纯林下,土壤为山地淋溶灰褐土,表面有数厘米厚的苔鲜层,呈中性,所以,结合进化树分析结果,初步定该种为冬块菌。但对于内蒙古地区而言,目前尚无此名称的相关报道。因此就本研究而言,暂认定此种为内蒙古地区新纪录种。
[1] 王福强, 张世奇. 块菌的国内外研究及其有效活性成分的应用[J]. 农产品加工, 2011,(1):63-67.
WANG F Q, ZHANG S Q. Study on the truffles at home and abroad and their effective application of the active ingredient [J].FarmProductsProcessing, 2011,(1):63-67.
[2] 刘培贵, 王 云, 王向华, 等. 中国块菌要览及其保护策略[J]. 菌物研究, 2011,9(4):232-243.
LIU P G, WANG Y, WANG X H,etal. Outline of Chinese truffles and their conservational strategies[J].JournalofFungalResearch, 2011, 9(4): 232-243.
[3] 徐阿生, 郑维列. 中国块菌属真菌研究述评[J]. 林业科学研究, 2003,16:73-85.
XU A S, ZHENG W L. Research comment on fungi of tuber in China [J].ForestResearch, 2003,16:73-85.
[4] ZHUANG W.Y. A list of Discomycetes in China. Supplement I [J].Mycotaxon, 2001, 79: 375-381.
[5] ZHUANG W.Y. A List of Discomycetes in China. Supplement II [J].Mycotaxon, 2003, 85: 153-157.
[6] 陈毅坚, 钟文武, 余正云. 食用块菌形态特征和抗氧化性能研究[J]. 食品工业科技, 2010,(2):139-141.
CHEN Y J, ZHONG W W, YU Z Y. Study on morphological character and antioxidant activity of edible truffle [J].ScienceandTechnologyofFoodIndustry, 2010,(2):139-141.
[7] 陈应龙, 弓明钦. 块菌资源多样性及其地理分布[J]. 中国食用菌, 2000,19(5):6-7.
CHEN Y L, GONG M Q. Truffle resources diversity and geographical distribution [J]. Edible Fungi of China, 2000,19(5):6-7.
[8] 陈 娟, 邓晓娟, 陈吉岳, 等. 中国块菌属多样性[J]. 菌物研究, 2011,4: 244-254.
CHEN J, DENG X J, CHEN J Y,etal. A checklist of the genusTuber(Pezizales, Ascomycota) in China [J].JournalofFungalResearch, 2011, 4: 244-254.
[9] 任德军. 中国块菌属(Tuber)系统学研究[D].福州:福建农林大学, 2003.
[10] 方 明. 15个块菌菌株的形态学与分子生物学鉴定[D].长春:吉林大学, 2006.
[11] 郭 尚, 李 渊, 赵照林, 等. 块菌的研究现状、问题及展望[J]. 食用菌, 2014,(1):4-6.
GUO SH, LI Y, ZHAO ZH L,etal. Study on the current situation, problems and prospect of truffles [J].EdibleFungi, 2014, (1):4-6.
[12] PERCUDANI R, TREVISI A, ZAMBONELLI A,etal. Molecular phylogeny of Truffles (Pezizales: Terfeziaceae, Tuberaceae) derived from nuclear rDNA sequence analysis [J].MolecularPhylogeneticsandEvolution, 1999, 13(1): 169-180.
[13] URBANELLI S, SALLICANDRO P, DE VITO E,etal. Identification ofTubermycorrhizae using multilocus electrophoresis[J].Mycologia, 1998, 90: 389-395.
[14] RUBINI A, PAOLOCCI F, GRANETTI B,etal. Single step molecular characterization of morphologically similar black truffle species [J].MicrobiologyLetters, 1998, 164: 7-12.
[15] MELLO A, VIZZINI A, LONGATO S,etal.TuberborchiiversusTubermacutatum: neotype studies and DNA analyses [J].Mycologia, 2000, 92(2): 326-331.
[16] 中国科学院内蒙古宁夏综合考察队. 内蒙古植被:山地植被 [M]. 北京:科学出版社, 1985, 723-748.
[17] WHITE T J, BRUNS T, LEE S,etal. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics.[M]// Innis MA, Gelfand D H, Sninsky J J, White T J. PCR Protocols: a guide to methods and applications. Academic, New York, 1990, 12:315-322.
[18] GARDES M, BRUNS T D. ITS primers with enhanced specificity for basidiomycetes application to the identification of mycorrhizae and rusts [J].MolEcol., 1993, 2:113-118.
[19] LIU B. New species and new records of Hypogeous fungi from China (I) [J].ActaMycologicaSinica, 1985, 4:84-89.
[20] 王 云, 刘培贵. 块菌名实考证及其资源保护[J]. 植物分类与资源学报, 2011, 33(6): 625-642.
WANG Y, LIU P G. Verification of Chinese names of truffles and their conservation in natural habitats [J].PlantDiversityandResources, 2011, 33(6): 625-642.
(编辑:宋亚珍)
Molecular Identification and Analysis of Phylogenetic Position for Two Truffles
FAN Yongjun1, ZHAO Yanling1, CHEN Xiuli1, YAN Wei2*
(1 Department of Biology Science and Technological, Baotou Teachers’ College, Baotou, Inner Mongolia 014030, China; 2 Forest College, Inner Mongolia Agricultural University, Hohhot 010018, China)
Two truffles were taken as experimental materials which were from Helan mountain area in Inner Mongolia, and they were identified basing on the morphological and molecular methods. In the process of experiment, the DNA sequences were blasted using the GenBank, and phylogenetic trees were constructed by using Mega5.1 software. The results show that two strains of ascoma are hypogeous. Thereinto, order-a is sallow, subsphaeroidal, to irregular shape, and with microvilli on surface. And tuber-b is yellowish-brown, uniform texture, with a wart on surface, and there is a special aroma of dried fruit. Through the analysis of molecular biological methods, order-a was identified as a species ofTubergenus, tuber-b isTuberbrumale, and the tuber-b is identified as a new record species in Inner Mongolia.
Tuber; ITS; species identification; phylogenetic position
1000-4025(2016)08-1560-06
10.7606/j.issn.1000-4025.2016.08.1560
2016-04-20;修改稿收到日期:2016-05-13
国家自然科学基金(31260132,31460188);内蒙古自然科学基金(2014MS0302,2016MS0301)
樊永军(1975-),博士,教授,主要从事菌根应用技术研究。E-mail:fanyj1975@163.com
*通信作者:闫 伟,教授,博士研究生导师,主要从事菌根应用技术研究。E-mail:weiyan@imau.edu.cn
Q949.3
A

