鸽新城疫病毒分离鉴定及动物感染试验
李复煌,李冰心,郑瑞峰 ,王 俊,李占鸿,马富梅,刘再超, 张清水*
(1.北京市畜牧总站,北京 100107;2.中国农业大学动物医学院/农业部动物流行病学人畜共患病重点实验室,北京 100193;3.北京市大兴区动物疾病控制中心,北京 102629;4.北京市顺义区动物卫生监督所,北京 101300)
鸽新城疫病毒分离鉴定及动物感染试验
李复煌1,李冰心2,3,郑瑞峰1,王俊2,李占鸿2,马富梅2,刘再超4, 张清水2*
(1.北京市畜牧总站,北京 100107;2.中国农业大学动物医学院/农业部动物流行病学人畜共患病重点实验室,北京 100193;3.北京市大兴区动物疾病控制中心,北京 102629;4.北京市顺义区动物卫生监督所,北京 101300)
从发病商品肉鸽组织中分离到3株新城疫病毒,对其基因序列和感染力进行测定和分析。用RT-PCR对3株病毒F基因进行了扩增,测序,3株新城疫病毒的F基因同源性比较及进化分析结果表明,3株病毒均属于Ⅵb亚型,且与2011年比利时分离株亲缘关系较近,F蛋白裂解位点符合强毒特征;肉鸽攻毒试验进一步证实了3株新城疫病毒的高致病性,肉鸽感染新城疫病毒后通过呼吸道及消化道途径排毒,具有高度接触传染性。试验结果证明了鸽感染新城疫病毒后的排毒时间及方式,为鸽新城疫的及早发现与防控提供了依据。
鸽;新城疫病毒;F基因;排毒监测
鸽新城疫由鸽源禽Ⅰ型副黏病毒(Pigeon paramyxovirus type Ⅰ,PPMV-Ⅰ)即新城疫病毒(Newcastle disease virus,NDV)引起的一种高度接触性、败血性传染病。该病发病急、传播快、病死率高,发病鸽通常会出现肠炎、腹泻及神经症状等。NDV为单股负链RNA病毒,全基因组长度约为15 kb,编码6种主要的结构蛋白,其中F蛋白和HN蛋白为主要的免疫原性蛋白。病毒颗粒外包绕囊膜,具有凝集红细胞的特性。新城疫病毒只有一个血清型,但基因型众多,分ClassⅠ和ClassⅡ两个大群,ClassⅠ包括9种基因型(1-9),ClassⅡ同样有9种基因型(Ⅰ-Ⅸ),每种基因型还包括多种亚型[1-2],其中从鸽子分离到的新城疫病毒绝大部分属于ClassⅡ,仅有少数属于ClassⅠ[3]。
该病于19世纪70年代末首次在苏丹和埃及的信鸽中被发现,其后在各国被陆续报道,我国于1986年前后在发病鸽群中分离到该病病原[4],已经给我国的信鸽及肉鸽养殖造成了巨大的经济损失。鸽Ⅰ型副黏病毒可感染不同日龄的鸽子,自然条件下,肉鸽、信鸽和赛鸽均可感染发病,母鸽较公鸽易感,乳鸽较成年鸽易感,但对鸡、鸭无致病性[5]。成年鸽感染后死亡相对缓慢,通常无死亡高峰,死因多由继发感染导致。发病鸽和带毒鸽作为该病的主要传染源,通过呼吸道和消化道等方式传播[6]。本实验室于2012年—2014年分别从广西、北京等地发病商品肉鸽中分离到3株新城疫病毒,并且对其全基因组序列进行了测序分析。同时通过人工感染商品肉鸽的方法观察其对商品肉鸽的致病性,通过采集感染鸽咽拭子及泄殖腔拭子来观察感染鸽的排毒方式及排毒的时间,感染雏鸽表现出极高的致病性,通过口腔和泄殖腔持续排毒,引发同居感染。
1 材料与方法
1.1材料
1.1.1实验动物9日龄SPF鸡胚,购自北京梅里亚维通实验动物技术有限公司;35日龄商品肉鸽,购自北京大兴某鸽场。
1.1.2试剂胎牛血清、DMEM高糖培养基,赛默飞世尔科技(中国)有限公司产品;病毒 RNA提取试剂盒、胶回收试剂盒、PyrobestTMDNA 聚合酶, 宝生物工程(大连)有限公司产品;反转录试剂盒(AMV、RNA酶抑制剂),Promega生物技术有限公司产品;pEASY-Blunt Simple Cloning Kit载体,Trans T1感受态细胞,DNA Marker(D2000 Plus),北京全式金生物技术有限公司产品;胰蛋白酶大豆琼脂(TSA)、LB琼脂、LB肉汤,美国BD医疗器械有限公司产品;硫酸链霉素、青霉素钠,华北制药股份有限公司产品。
1.2方法
1.2.1病毒的分离取发病死亡鸽的肝脏、脾脏及脑等组织用灭菌研磨器研磨,离心过滤,过滤后滤液尿囊腔途径接种5枚9日龄SPF鸡胚,置于37℃孵化箱中孵育,观察鸡胚死亡情况,弃去24 h之内死亡的鸡胚。收集死亡鸡胚尿囊液,用10 mL/L的鸡红细胞进行HA试验,具体操作参照文献[7]进行。同时将处理好的病料接种鸡胚成纤维细胞(chicken embryo fibroblast,CEF),37℃、体积分数为5%的CO2培养箱中孵育1 h,然后加入CEF细胞生长液,加完后放入37℃、体积分数为5%的CO2培养箱中,72 h后观察有无细胞病变(CPE)的产生。
1.2.2病毒的鉴定
1.2.2.1引物设计根据GenBank中已发表的鸽NDV的序列,设计2对F基因的扩增引物:F上游引物F(F)5'- ATGGGCTCCAAACCCCACATC-3';下游引物F(R)5'- TCATGTTCTTGTAGTTGCTCTC-3',目的片段大小为1 662 bp。引物由上海生工生物工程技术服务有限公司合成。
1.2.2.2病毒RNA的提取将收获的死亡鸡胚尿囊液按照MiniBEST Viral RNA/ DNA Extraction Kit Ver.5.0说明书操作,提取尿囊液中的病毒RNA。
1.2.2.3反转录以提取的尿囊液RNA为模板,利用引物5'-ACGGGTAGAAGG TGTG AATC-3'进行反转录,反应条件及体系如下:RNA 10 μL,反转录引物1 μL,70℃变性10 min,冰浴1 min。然后向反应管中依次加入:MgCl24 μL,10×buffer 2 μL,dNTP(10 μmol/L) 2 μL, RNA酶抑制剂0.5 μL,AMV 0.5 μL,至反应总体积为20 μL。混匀,42℃反应60 min,获得cDNA,置于-20℃冻存。
1.2.2.4PCR扩增利用反转录获得的cDNA为模板,F基因特异性引物来扩增F基因,反应条件为:94℃ 5 min;94℃ 30 s, 55℃ 30 s,72℃ 1 min,30个循环;72℃延伸7 min。PCR产物用10 g/L的琼脂糖进行凝胶电泳,观察条带情况。
1.2.3鸽NDV F基因的克隆及测序按照上述方法扩增出新城疫病毒的F基因,8 g/L琼脂糖进行凝胶电泳,利用TaKaRa胶回收试剂盒对目的条带进行胶回收;将回收片段与pEASY-Blunt Simple Cloning Kit载体连接,具体步骤按照全式金分子克隆说明书进行操作,最后将菌液涂布于加有氨苄青霉素的LB平板上,37℃培养过夜。筛选阳性克隆,送至上海生工生物工程技术服务有限公司进行序列测定。
1.2.4基因组序列的拼接及分析DNA Star、Contig Express等生物学软件将所得的序列测定结果进行分析、拼接,获得病毒的F基因全序列,并将该序列与 GenBank 中登录的新城疫病毒以及不同地区不同宿主来源的新城疫病毒进行序列比对,基于F基因,分析其与各毒株的核苷酸序列与氨基酸序列同源性。同时利用MegAlign软件中的Clustal W方法对分离自不同时间、不同地点及不同宿主的27株新城疫病毒的F基因核苷酸序列构建进化树,进行系统进化分析,同时对不同来源的新城疫毒株F蛋白进行氨基酸序列的同源性分析。
1.2.5试验感染肉鸽的排毒监测36只肉鸽平均分为3组,每组12只(10只攻毒,2只空白对照),3株鸽源新城疫病毒分别通过滴鼻方式感染肉鸽,饲喂于不同的隔离器中,分别于攻毒后的第2、4、6、8、10、12天采集肉鸽咽拭子及泄殖腔拭子,利用含5 000单位青、链霉素的DMEM处理,将处理完的液体接种96孔板CEF,放入37℃、体积分数为5%的CO2培养箱中孵育1 h,加入CEF细胞维持液,放入CO2培养箱中,72 h后观察细胞病变。
2 结果
2.1病毒的分离
死亡鸽组织研磨处理后接种9日龄SPF鸡胚,鸡胚大约72 h全部死亡,死亡鸡胚胚体水肿、出血明显(图1)。收集死亡鸡胚尿囊液进行血液凝集试验,能够凝集10 mL/L鸡红细胞,效价为6log2。组织研磨液接种CEF,约72 h后出现明显的细胞病变,细胞变圆皱缩、部分细胞甚至出现崩解坏死(图2)。
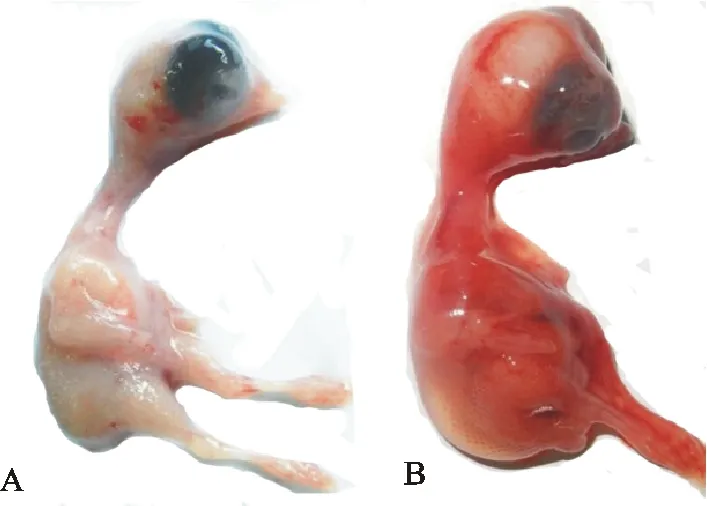
A.正常鸡胚;B.病毒致死鸡胚
A.Normal chicken embryo;B.Dead chicken embryo
图1鸡胚病变
Fig.1Pathological lesions of chicken embryo
2.2RT-PCR鉴定
提取病毒RNA,反转录后利用鸽新城疫病毒F基因的特异性引物进行PCR扩增,可见明显的目的条带1 662 bp,最终鉴定为新城疫病毒(图3)。

A.阴性对照;B.48 h;C.72 h
A.Negative control;B.48 hours;C.72 hours
图2病料接种CEF后细胞病变
Fig.2CPE of CEF after inoculated with the tissue samples
2.3F基因的序列测定及进化分析
对3株鸽新城疫病毒的F基因进行测序, 3株NDV F基因的大小均为1 662 bp,共编码553个氨基酸。3株NDV F蛋白的第112-117位氨基酸裂解位点序列均为RRQKRF,属于典型的新城疫强毒株F蛋白氨基酸裂解位点的特征[8-9]。将分离的3株鸽新城疫的F基因与参考毒株进行进化分析(表1),绘制进化树(图4),可见所分离的3株鸽源新城疫病毒亲缘关系较近,且与2013年北京分离株、2011年的比利时分离株亲缘关系最为接近,属于同一分支,为Ⅵb亚型。

M.DNA 标准DL 5 000;1.样品;2阳性对照;3阴性对照
M.DNA Marker DL 5 000;1.Sample;2.Positive control;3.Negative control
图3F基因PCR扩增
Fig.3PCR amplification results of F gene

表1 本研究所引用GenBank中NDV F基因序列信息
2.4攻毒肉鸽的排毒监测
试验组肉鸽攻毒后的第2天即检测到病毒排出,排毒方式主要以口腔、呼吸道途径为主,第2天就开始排毒,消化道途径排毒量较少。第4天在泄殖腔拭子中检测到病毒,咽拭子中的病毒检出率达到100%,并能一直持续到鸽子死亡;GX0302试验组同居未感染肉鸽(对照组)攻毒后第6天在咽拭子中检测到病毒,BJ0612、BJ0902则分别在攻毒后的第8天和第10天检测到病毒的排放(图4~图5)。3株新城疫病毒均表现出较强的致病性,攻毒组肉鸽攻毒后第11天死亡率即达到90%,同居对照组死亡率达到50%。

图4 3株鸽源新城疫病毒与不同来源的新城疫病毒基于F基因核苷酸序列的系统发育进化树Fig.4 Phylogenetic tree constructed between three NDV strains from the pigeons and other different resources NDV based on the F gene

A.GX0302;B.BJ0612;C.BJ0902
图5肉鸽人工感染新城疫病毒后咽拭子及泄殖腔拭子的病毒分离率
Fig.5The virus isolation rates of the throat swabs and cloacal swabs after the infections of pigeons with the three NDV strains
3 讨论
鸽形目鸟类是鸽新城疫的主要传播源,鸽源新城疫病毒最早可能起源于中东地区,于19世纪80年代迅速流行开来,尼罗河三角洲地区、苏丹、意大利美索不达米亚及整个欧洲地区均出现鸽感染新城疫病毒的报道[10],我国于1986年分到该病病原,并鉴定为Ⅵb基因型[9,11]。
20世纪80年代流行的新城疫病毒F蛋白裂解位点主要以GRQKRF为主,进入20世纪90年代以来,F蛋白的氨基酸裂解位点逐步进化为RRQKRF[11],这与本实验室所测的3株新城疫病毒的序列信息相符,通过肉鸽人工感染试验,进一步的证实了3株新城疫病毒的强毒特征。
根据F基因遗传系统进化树可以看出,北京及广西鸽源新城疫分离株主要位于基因Ⅵ细分支,属于ClassⅡ中的Ⅵb亚型,这个结果与我国近几年鸽源新城疫病毒的流行情况相符[12]。3株鸽新城疫分离株与北京分离株BJP13和比利时分离株11的亲缘关系最近,表明分离株可能为最近几年北京鸽新城疫流行毒株,且该毒株可能与比利时毒株属于同一来源。
鸽群感染新城疫病毒后通常呈现流行性暴发,未免疫鸽群病死率达到100%[13-14]。鸽群发病之初通常会有一段时间的排毒期,本试验通过人工攻毒肉鸽的方式来了解鸽感染新城疫病毒后的排毒情况,对采集的鸽拭子进行检测,初步认识了鸽感染新城疫病毒后的排毒期及排毒方式,为鸽新城疫的及早发现及控制提供了理论依据。
[1]Steward M,Vipond I B,Millar N S,et al.RNA editing in Newcastle disease virus[J].Gen Virol,1993,74(12):2539-2548.
[2]Kim L M,King D J,Curry P E,et al.Phylogenetic diversity among low-virulence Newcastle disease viruses from waterfowl and seafowl and comparison of genotype distributions to those of poultry-origin isolates[J].J Virol,2007,81(22):12641-12653.
[3]Ren S,Xie X,Wang Y,et al.Molecular characterization of a class ⅠNewcastle disease virus strain isolated from pigeon in China[J].Avian Pathol,2016,3:1-34.
[4]Alexander D J.Avian Paramyxoviridae-recent developments[J].Vet Microbiol,1990,23:103-114.
[5]Liu M,Qu Y,Wang F,et al.Genotypic and pathotypic characterization of Newcastle disease virus isolated from racing pigeons in China[J].Poult Sci,2015,94(7):1476-1482.
[6]游洪,王林川.鸽Ⅰ型副黏病毒研究进展[J].动物医学进展,2001,22(2): 13-16.
[7]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[8]世界动物卫生组织.诊断试验和疫苗标准手册[M].3版.农业部畜牧兽医局,译.北京:中国农业科技出版社,1996:140-146.
[9]Kommers G D,King D J,Seal B S,et al.Pathogenesis of six pigeon-origin isolates of Newcastle disease virus for domestic chickens[J].Vet Pathol,2002,39:353-362.
[10]Kaleta E F,Alexander D J,Russell P H.The first isolation of the avian PMV-1 virus responsible for the current panzootic in pigeons[J].Avian Pathol,1985,14(4): 553-557.
[11]Meulemans G,van den Berg T P,Decaesstecker M,et al.Evolution of pigeon Newcastle disease virus strains[J].Avian Pathol,2002,31:515-519.
[12]孙敏华,胡奇林. 新城疫分子流行病学研究进展[J].动物医学进展, 2010,31(12): 95-99.
[13]钟植文,黎先伟,陈珊,等.一株鸽新城疫病毒的分离鉴定及F与HN基因序列分析[J].动物医学进展,2015,36(5):86-90.
[14]Panda A,Huang Z,Elankumaran S,et al.Role of fusion protein cleavage site in the virulence of Newcastle disease virus[J].Microb Pathogene,2004,36:1-10.
Isolation and Identification of Pigeon Newcastle Disease Virus and Experimental Infection in Pigeons
LI Fu-huang1,LI Bing-xin2,3,ZHENG Rui-feng1,WANG Jun2,LI Zhan-hong2,MA Fu-mei2,LIU Zai-chao4,ZHANG Qing-shui2
(1.Beijing Municipal Animal Husbandry General Station,Beijing,100107,China;2.KeyLaboratoryofAnimalEpidemiologyandZoonosis,MinistryofAgriculture,CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing,100193,China;3.AnimalDiseaseControlandPreventionCentre,Daxing,Beijing,102629,China;4.InstituteofAnimalHealthSupervision,Shunyi,Beijing,101300,China)
Three Newcastle disease virus strains were isolated from dead pigeons,the molecular identification was carried out by RT-PCR method and the F gene was sequenced then.The homology comparison and phylogenetic analysis were also implemented base on the F gene.The result showed that three strains belong to the Ⅵb subtype.F protein cleavage site was consistent with the virulent NDV strains,which was further verified through pigeon challenge assay.The pigeons infected with NDV shed the virus through the respiratory and digestive tracts showing highly contagious property.The challenge assay demonstrated the shedding way of the infected pigeons which is in favour of the prevention of the pigeon ND.
pigeon;Newcastle disease virus; F gene; virus shedding
2016-04-27
北京市农业重大科技项目(20150118)
李复煌(1977-),男,甘肃靖远人,高级兽医师,博士研究生,主要从事兽医技术管理工作。*通讯作者
S852.659.5
A
1007-5038(2016)09-0053-05

