HPLC法测定猪体内双氯芬酸的血药浓度
李宇琛,陈鸿雨,吴天兴,陆小松,韩孝欣,刘 芳,王东亮,李龙飞,卜仕金
(扬州大学兽医学院/江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
HPLC法测定猪体内双氯芬酸的血药浓度
李宇琛△,陈鸿雨△,吴天兴,陆小松,韩孝欣,刘芳,王东亮,李龙飞,卜仕金*
(扬州大学兽医学院/江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
建立猪血浆中双氯芬酸含量的HPLC测定法。猪血浆中双氯芬酸采用正己烷-异丙醇混合溶液(90∶10,V/V)提取,HPLC紫外检测器检测。色谱柱为C18柱,流动相为甲醇-15 g/L乙酸水溶液(80∶20,V/V),测定波长为276 nm。外标法定量。结果表明,血浆中杂质不干扰双氯芬酸的测定,双氯芬酸血药浓度在0.025 μg/mL~20.0 μg/mL范围内线性关系良好(R2=1),最低定量限为0. 05 μg/mL,高、中、低空白血浆添加样品浓度的日内变异系数和日间变异系数分别小于4%和6%,回收率为85%~97%。结果表明,该方法适用于猪血浆中双氯芬酸含量的测定,可用于含双氯芬酸钠的制剂在猪体内的药物代谢动力学和生物利用度研究。
高效液相色谱;双氯芬酸;血药浓度;仔猪
双氯芬酸钠(diclofenac sodium)是第三代非甾体抗炎药,具有解热、镇痛和抗炎的作用[1]。其作用机制为抑制环氧化酶的活性,从而阻断花生四烯酸转化为前列腺素,同时它能促进花生四烯酸与甘油三酯结合,降低细胞内游离的花生四烯酸浓度,从而间接抑制白三烯的合成[2],这使得双氯芬酸钠具有了较强的抗炎作用。在国内外兽医临床实践中,双氯芬酸钠用于治疗各种炎症和创伤性退化疾病以及马、牛、狗、猪等跛行性疼痛、术前的白内障切除方面均有良好的疗效[3]。因其具有起效快、作用时间长、疗效好、副作用小、长期应用无积蓄性等特点,作为人类药物已经应用多年[4-6],在兽医中应用则相对有限,特别是国内缺乏靶动物的药物代谢动力学试验数据。双氯芬酸钠在血浆中的解离百分率可达99.96%,因此其血药浓度测定的标示物为双氯芬酸。本研究在国内外现有研究基础上建立优化了一种测定猪血浆中双氯芬酸的高效液相色谱(HPLC)检测方法,用以获得双氯芬酸钠单方或复方制剂在猪体给药后的血药浓度-时间数据,为双氯芬酸钠药物代谢动力学研究和生物利用度评价提供了可靠的方法支持与技术保证。
1 材料与方法
1.1材料
1.1.1药品与试剂双氯芬酸钠对照品(含量为99.9%,批号:100334-200302),购自中国食品药品检定研究院;甲醇(色谱纯),美国TEDIA公司产品;乙酸(色谱纯),德国CNW公司产品;正己烷、异丙醇和盐酸均为分析纯,购自国药集团化学试剂有限公司。
1.1.2主要仪器Agilent1260型高效液相色谱仪,配有紫外检测器和色谱工作站,Agilent公司产品;UPH-11-20T型优普超纯水制造系统,成都超纯科技有限公司产品;RE-52旋转蒸发器,上海亚荣生化仪器厂产品;SHB循环水式多用真空泵,郑州长城科工贸有限公司产品;101-2A型电热鼓风干燥箱,南通市沪通制药机械设备厂产品;电子分析天平,感量0.000 1 g,德国塞多利斯天平公司产品;KS-250D超声仪,宁波科生仪器厂产品;WH-1微型漩涡混合仪,上海沪西分析仪器厂有限公司产品;TGL-16C型高速离心机,上海安亭科学仪器厂产品;LD5-2A型低速离心机,北京雷勃尔离心机有限公司产品。
1.2方法
1.2.1试液的配制
1.2.1.11 mol/L盐酸溶液的配制量取浓度为360 g/kg~380 g/kg的分析纯浓盐酸(摩尔浓度约为12 mol/L)41.6 mL,用458.4 mL双纯水稀释并混匀即配成1 mol/L盐酸溶液。
1.2.1.215 g/L乙酸水溶液的配制将色谱纯乙酸和水按98.5∶1.5(m/m)的比例混匀,现配现用。
1.2.1.3流动相的配制将甲醇和15 g/L乙酸水溶液按80∶20(V/V)比例混匀,经0.45 μm有机滤膜过滤,并超声脱气20 min即可。现配现用。
1.2.1.4双氯芬酸标准储备液和工作液的配制精密称取双氯芬酸钠对照品(经105℃烘干至恒重)约21.5 mg于10 mL量瓶中,用甲醇溶解并定容至刻度,即配成浓度为2 000 μg/mL双氯芬酸标准储备液。置-20℃冰箱中保存。
准确吸取适量双氯芬酸标准储备液,用流动相(甲醇∶15 L/g乙酸水溶液=80∶20,V/V)倍比稀释成分别为一定浓度的系列标准工作液。现配现用。
1.2.1.5正己烷-异丙醇溶液将正己烷和异丙醇按90∶10(V/V)的比例混匀即可,现配现用。
1.2.2猪空白血浆添加样品的制备空白血样来自未用双氯芬酸等非甾体类消炎药的猪,血样采集后用肝素抗凝,4 500 r/min离心10 min,分离血浆后于-20℃保存备用。将保存的血浆经自然(室温)解冻后,加入一定量的双氯芬酸标准工作液,涡旋混匀制得空白血浆添加药物样品。
1.2.3检测
1.2.3.1色谱条件色谱柱为Agilent ZORBAX Eclipse Plus C18(250×4.6 mm,5 μm)柱;流动相为甲醇-15 g/L乙酸水溶液(80∶20,V/V);流速为0.9 mL/min;紫外检测波长为276 nm;柱温25℃;进样量20 μL。
1.2.3.2猪血浆样品的预处理准确吸取500 μL血浆样品加入1 mol/L盐酸溶液0.1 mL后涡旋30 s,随后加入2 mL正己烷-异丙醇(90∶10,V/V)涡旋5 min,16 000 r/min离心10 min。有机相移至25 mL鸡心瓶中,45℃水浴条件下旋转蒸干。残渣加500 μL流动相涡旋5 min复溶, 12 000 r/min离心10 min。上清液经0.22 μm滤膜过滤,滤液供HPLC分析。
1.2.3.3标准曲线的绘制按1.2.2项下制备方法分别制得0.025、0.05、0.5、5、10、20 μg/mL系列空白血浆标准添加药物浓度。将上述样品按照1.2.3.2项下的血浆样品处理方法处理后,进行HPLC分析。采用外标法计算,以双氯芬酸峰面积对血药浓度进行加权线性回归,得回归方程,每个浓度重复3次。
1.2.4方法学验证
1.2.4.1检测限(LOD)和定量限(LOQ)的测定 取信噪比S/N≥3时浓度为检测限(LOD),定量限(LOQ)结合精密度和准确度试验结果确定(信噪比S/N一般要≥10)。
1.2.4.2回收率测定按1.2.2项下制备方法分别制得0.05、5、20 μg/mL 3个双氯芬酸空白血浆添加浓度。按1.2.3.2项下的血浆样品预处理方法处理后,取上清液20 μL作HPLC分析。将测得双氯芬酸峰面积,代入当天的标准曲线求得实测浓度。实测浓度与添加的真实浓度之比值乘以百分数即为相对回收率。每个浓度重复3次。
1.2.4.3精密度测定按照标准曲线制备方法分别制备0.05、5、20 μg/mL 3个浓度的空白血浆添加样品及一条随行标准曲线,按1.2.3.2项下血浆样品处理方法操作。每批每个浓度制备5份平行样品,连续3 d,共做3个批次。将测得双氯芬酸峰面积,代入当天的标准曲线得到实测浓度,据此分别计算批内和批间变异系数。
1.2.5稳定性考察
1.2.5.1室温放置下的稳定性制备浓度为0.05、5、20 μg/mL的5个平行样品,考察存储期间血浆内双氯芬酸的稳定性。首先按照标准曲线制备方法分别制备上述3个浓度的空白血浆添加样品后立刻对样品进行分析,得到0时数据,之后在室温(约22℃)下放置2 h后进行样品分析。通过与0时测定的数据比较,考察室温下放置时血样中双氯芬酸的稳定性。
1.2.5.2反复冻融条件下的稳定性制备浓度为0.05、5、20 μg/mL的5个平行样品,考察存储期间血浆内双氯芬酸的稳定性。首先按照标准曲线制备方法分别制备上述3个浓度的空白血浆添加样品后立刻对样品进行分析,得到0时数据。在-20℃下至少储存1 d后取出解冻,之后再次冷冻、解冻,反复共进行3次冻融循环处理。两次冻融间隔时间至少为5 h。通过与0时测定的数据比较考察反复冻融下血样中双氯芬酸的稳定性。
1.2.5.3冻存期间的稳定性制备浓度为0.05、5、20 μg/mL的5个平行样品,考察存储期间血浆内双氯芬酸的稳定性。首先按照标准曲线制备方法分别制备上述3个浓度的空白血浆添加样品后立刻对样品进行分析,得到0时数据,之后分别于冻存(约-20℃)1周和1月后进行样品分析。通过与0时测定的数据比较考察样品贮存期间的稳定性。
2 结果
2.1分离效果
由双氯芬酸对照品、空白血浆、空白添加样品的分离图谱可知,双氯芬酸的色谱峰分离效果良好,空白血清及其他杂质对其无影响,保留时间为7.1 min左右(图1~图3)。
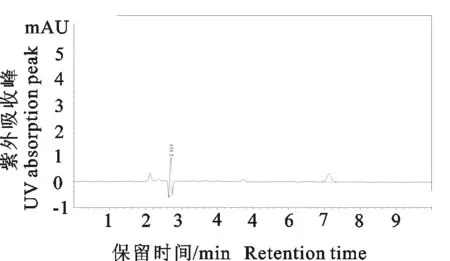
图1 双氯芬酸(0.05 μg/mL)对照品色谱图Fig.1 HPLC chromatograms of diclofenac standard at 0.05 μg/mL

图2 空白血浆色谱图Fig.2 HPLC chromatograms of blank plasma
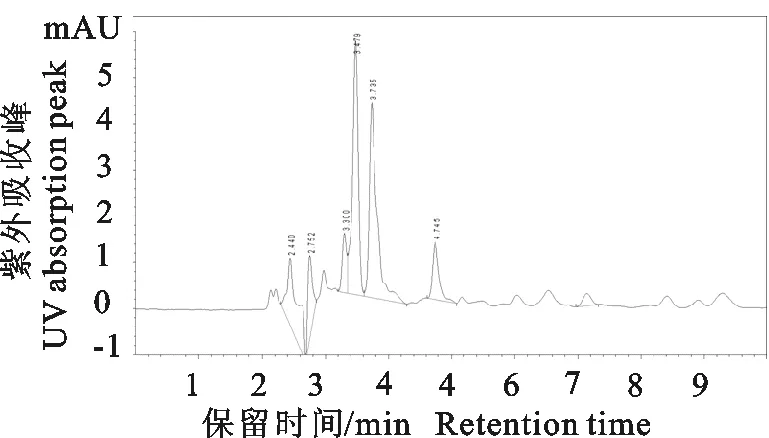
图3 空白血浆添加双氯芬酸标准品(0.05 μg/mL)色谱图Fig.3 HPLC chromatograms of spiked diclofanac standard in plasma at the level of 0.05 μg/mL
2.2标准曲线、检测限及定量限
空白血浆添加浓度在0.025 μg/mL~20.0 μg/mL范围内,线性关系良好(R2=1),相对标准曲线方程为y=50.896x+0.322 2(图4)。双氯芬酸在猪血浆中的最低检测限为0.025 μg/mL,最低定量限为0.05 μg/mL。
2.3准确度和精密度
猪血浆中双氯芬酸测定方法回收率测定结果见表1。由表1可见,猪空白血浆添加样品在0.05 μg/mL~20 μg/mL时,回收率大于85%。猪血浆中双氯芬酸测定方法精密度测定结果见表2。由表2可见,猪空白血浆添加样品在0.05 μg/mL~20 μg/mL时,日间变异系数和日内变异系数分别小于4%和6%。

图4 双氯芬酸标准曲线图Fig.4 Standard working curve of diclofenac表1 血浆中空白添加双氯芬酸相对回收率Table 1 The recovery of spiked diclofenac in plasma

添加浓度/(μg·mL-1)Addedconcentration检出的加标浓度回收率a/%Recovery标准差SD平行数n变异系数/%RSD0.0585.102.8953.40596.550.5150.532093.753.0153.21
注:a表示基于检出的平均浓度进行计算。
Note:a means the calculation based on detected average concentration.

表2 血浆样品精密度测定
注:n为样本数;a表示基于检出的平均浓度进行计算。
Note:n is the number of samples;a means the calculation based on detected average concentration.
2.4猪血浆中双氯芬酸测定方法的稳定性
2.4.1室温放置下的稳定性对于猪血浆中的双氯芬酸而言,放置室温条件(约22℃)可保持稳定达2 h(表3)。
2.4.2反复冻融下的稳定性对于猪血浆中的双氯芬酸而言,在3个循环冻融后仍可保持较好的稳定(表4)。
2.4.3样品存储期间的稳定性对于猪血浆中的双氯芬酸而言,于-20℃条件下冻存时能够保持稳定1个月(表5)。
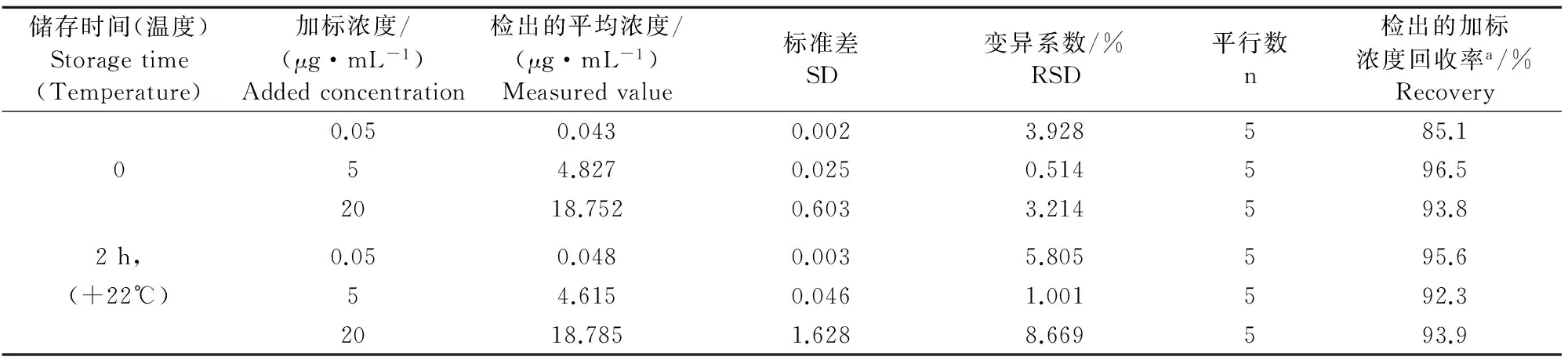
表3 室温放置2 h后猪血浆中双氯芬酸测定的稳定性
注:a表示基于检出的平均浓度进行计算。
Note:a means the calculation based on detected average concentration.
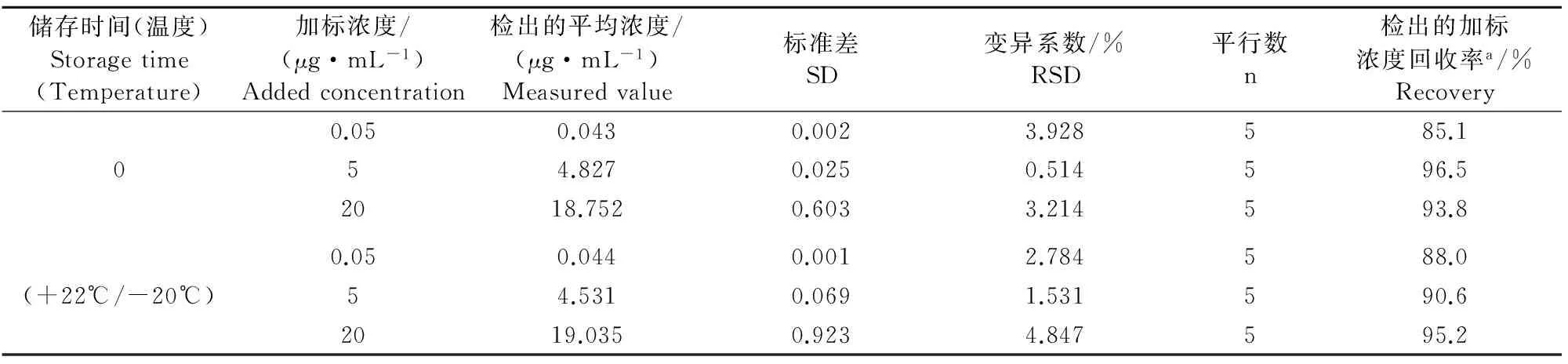
表4 3个冻融循环后猪血浆中双氯芬酸测定的稳定性
注:a表示基于检出的平均浓度进行计算。
Note:a means the calculation based on detected average concentration.

表5 -20℃条件下冻存后血浆中双氯芬酸测定的稳定性
注: a表示基于检出的平均浓度进行计算。
Note: a means the calculation based on detected average concentration.
3 讨论
在流动相的选择方面,文献报道以乙腈-磷酸缓冲液[7]或甲醇-水[8]作为流动相均不能获得理想的分离效果,故本研究选择甲醇和15 g/L乙酸水溶液作为流动相,且以甲醇为主要流动相,具有毒性低、成本低,每次试验后色谱系统冲洗时间短等优点[7]。在本研究中发现,适当提高甲醇在流动相中的比例,可以极大程度地减少双氯芬酸的保留时间,当甲醇在流动相中的比例达到80%时,双氯芬酸在7.1 min左右出峰,仪器的分析周期为10 min,节约了样品的分析时间,适合大量样本分析的需要。钟剑珊等[9]通过对双氯芬酸对照品进行紫外测定,发现其在276 nm处有最大吸收,因此,本研究亦选择276 nm作为测定波长。双氯芬酸在本试验确定的色谱条件下具有较好的保留特性和分离度,提示本方法具有良好的特异性。
双氯芬酸为弱酸性药物(pH7.68,pKa4),在提取过程中,先用1 mol/L HCL酸化血浆,有利于双氯芬酸的萃取[10]。本研究对比考察了文献报道中提取率较高的3种样品前处理方法,即在酸化血浆的前提下,分别用乙腈[11]、乙腈-乙酸乙酯-异丙醇[12]、正己烷-异丙醇[13-14]处理血浆样品。结果表明,正己烷-异丙醇作为提取溶剂干扰峰相对较少,灵敏度高,基线噪音小,对血浆中的双氯芬酸的回收率满足本试验需求,且以正己烷-异丙醇混合溶液为萃取剂,在45℃水浴条件下很快挥干,亦减少了样品处理时间;同时正己烷-异丙醇可以克服部分血浆样品中有溶血现象的问题,萃取液澄清透明、无絮状沉淀物,保证了样品分析的准确性。本试验样品处理方法相对简单,快捷,回收率高,重复性好。
从准确度、精密度和稳定性试验测定结果可以看出,试验误差相对较小,采用外标法可满足本试验需求。本研究建立的双氯芬酸血浆浓度测定方法,具有操作简便、专属性强、灵敏度高等特点,可满足猪体内药物浓度测定,适用于双氯芬酸钠药物代谢动力学和生物利用度的研究。
[1]Desjardins P J,Olugemo K,Solorio D,et al.Pharmacokinetic properties and tolerability of low-dose SoluMatrix diclofenac[J].Clin Thera,2015,37(2):448-461.
[2]Bruno A,Tacconelli S,Patrignani P.Variability in the response to non-steroidal anti-inflammatory drugs:Mechanisms and perspectives[J].Basic Clin Pharmacol Toxicol,2014,114(1):56-63.
[3]Pejcic Z,Pokrajac M,Jezdimirovic M.Pharmacokinetics of diclofenac in pigs after intramuscular administration of a single dose[J].Acta Veterinaria,2006,56(4):323-331.
[4]Gibofsky A,Hochberg M C,Jaros M J,et al.Efficacy and safety of low-dose submicron diclofenac for the treatment of osteoarthritis pain:a 12 week, phase 3 study[J].Curr Med Res Opin,2014,30(9):1883-1893.
[5]McGettigan P,Henry D.Use of non-steroidal anti-inflammatory drugs that elevate cardiovascular risk: an examination of sales and essential medicines lists in low-,middle-,and high-income countries[J].PLoS Med,2013,10(2):e1001388.
[6]李健和,胡焰,曹俊华,等.非甾体抗炎药物注射制剂的开发与临床应用[J].中国新药与临床杂志,2013,32(3):167-176.
[7]胡爱萍,胡国新,邱相君,等.反相高效液相色谱法检测人血浆中双氯芬酸钠的浓度[J].温州医科大学学报,2006,35(3):192-192.
[8]郭海杰,吴慧哲,孙明立,等.双氯芬酸钠缓释片在健康人体的生物等效性与药代动力学[J].中国临床药理学杂志,2008,24(6):521-525.
[9]钟剑珊,黄红深.HPLC法测定双氯芬酸钠肠溶片的含量[J].今日药学,2013,23(9):586-588.
[10]王雅琴.双氯芬酸钠注射液在猪体内药动学及残留消除研究[D].江苏扬州:扬州大学,2015.
[11]邓阳,颜苗,王峰,等.基于2D-HPLC结合捕集柱技术测定人血中双氯芬酸钠浓度及其应用[J].中国药学杂志,2015,50(24):2146-2150.
[12]石珊,毕开顺,刘晓,等.双氯芬酸钠缓释片的人体生物等效性考察[J].沈阳药科大学学报,2008(9):744-748.
[13]林佳亮,王庭贤,苏云驰,等.双氯芬酸钠贴剂绝对生物利用度和局部组织药物浓度研究[J].中国药师,2004,7(11):834-836.
[14]吴珏珩,汤丽芬,谭炳炎,等.双氯芬酸钾的人体药代动力学特点研究[J].广东药学,2001,11(3):24-27.
Determination of Diclofenac in Pig Plasma with HPLC
LI Yu-chen,CHEN Hong-yu,WU Tian-xing,LU Xiao-song,HAN Xiao-xin,LIU Fang,WANG Dong-liang,LI Long-fei,BU Shi-jin
(Veterinary Medicine College,Yangzhou Univercity/Jiangsu Co-innovation Center for Prevention and ControlofImportantAnimalInfectiousDiseasesandZoonoses,Yangzhou,Jiangsu,225009,China)
In order to establish a HPLC method for the determination of plasma concentrations of diclofenac in piglets,hexane-isopropanol solution (90∶10,V/V) was used for extracting diclofenac of plasma.The plasma concentrations of diclofenac were measured by HPLC UV-Detector.The chromatography was carried on a C18column,the mobile phase was composed of methanol-15 g/L acetic acid (20∶80, V/V),the detection wavelength was set at 276 nm for diclofenac,and analysis based on the external standard method.Under the condition of this test,diclofenac in plasma was well separated,and no interference from plasma matrix was observed.The linear ranges for diclofenac were 0.025 μg/mL-20.0 μg/mL(R2=1),the lowest limit of quantitation was 0.05 μg/mL,and the ingredients showed good relationships between the peak area and the concentration.The inter-day and intra-day RSD was less than 4% and 6%.The recovery was between 85% and 97%.The method could be used for the determination the diclofenac levels of piglets,and applied to study on the pharmacokinetics and bioavailability researches of the preparation containing diclofenac sodium.
HPLC;diclofenac;plasma drug concentration;piglet
2016-02-22
江苏高校优势学科建设工程资助项目(PAPD);江苏省普通高校研究生科研创新计划项目(SJLX15-0675);扬州大学“新世纪人才工程”资助项目
李宇琛(1990-),男,内蒙古包头人,硕士研究生,主要从事兽医临床药理学研究。△同等贡献作者。*通讯作者
S859.7
A
1007-5038(2016)09-0058-05

