阿魏酸酯酶的研究与应用进展
王丽,孙钦栋,王贺祥
1.山东农业大学植物保护学院,山东泰安2710182.中国农业大学生物学院,北京100193
阿魏酸酯酶的研究与应用进展
王丽1,2,孙钦栋1,王贺祥2*
1.山东农业大学植物保护学院,山东泰安271018
2.中国农业大学生物学院,北京100193
阿魏酸酯酶可以水解植物细胞壁中由阿魏酸、p-香豆酸及二聚阿魏酸等酚酸与半纤维素和木质素形成的酯键,高效降解木质纤维素的同时可以释放出阿魏酸、p-香豆酸等抗氧化物质,在食品、造纸、医药、化妆品、生产生物乙醇等行业具有很高的应用价值和广阔的市场前景。本文系统总结了阿魏酸酯酶的来源、理化性质、结构特征与催化机理及发酵生产、应用等方面的最新研究进展。
阿魏酸酯酶;研究进展;应用进展
阿魏酸酯酶(Feruloylesterase,EC 3.1.1.73)又称为肉桂酸酯酶,属于羧酸酯水解酶亚类,该酶可以水解植物细胞壁中由阿魏酸、p-香豆酸及二聚阿魏酸等酚酸与半纤维素和木质素形成的酯键,打破它们形成的网状结构,将半纤维素和木质素分开,使纤维素酶可以与纤维素充分接触,大大提高纤维素的降解率。阿魏酸酯酶在加速木质纤维素降解的同时还释放出阿魏酸、p-香豆酸等抗氧化物质,在食品、造纸、医药、化妆品、生产生物乙醇等行业具有很高的应用价值和广阔的市场前景[1]。围绕阿魏酸酯酶的来源、分类、结构特征及催化机理,理化性质与应用等方面在近年来取得的最新进展进行了综述分析。
1 阿魏酸酯酶的来源
由于在木质纤维素降解中的独特功能,阿魏酸酯酶自从被发现后,一直是近些年研究的热点。目前已从多种生物中分离纯化,根据其来源,可以分为微生物阿魏酸酯酶和植物阿魏酸酯酶。
1.1微生物阿魏酸酯酶
微生物阿魏酸酯酶又分为真菌阿魏酸酯酶和细菌阿魏酸酯酶。
1.1.1真菌阿魏酸酯酶目前已发现的阿魏酸酯酶大部分都是真菌阿魏酸酯酶,这可能跟真菌的培养基质有关系。自然界的真菌主要生长在一些枯枝和草类的茎秆上,而阿魏酸酯酶是诱导酶,只有当培养基中含有木质纤维素类物质时才会被诱导产生。当培养基质改变时,有些真菌便不再产生阿魏酸酯酶,不同真菌的阿魏酸酯酶诱导培养基也是不同的。裂褶菌(Schizophyllum commune)在以纤维素为碳源的培养基中可以产生高活力的阿魏酸酯酶,而当以木聚糖和麦麸等木聚糖含量较高的底物作为碳源时则几乎不产生阿魏酸酯酶。黑曲霉(Aspergillusniger)是目前阿魏酸酯酶研究最多的真菌,先后已经有六种阿魏酸酯酶从中分离纯化出来,分别为FAE-I,FAE-II,AnFaeA,AnFaeB,FAE-1和FAE-2,它们的理化性质和底物特异性均不相同,其中FAE-I,FAE-II,AnFaeA和AnFaeB都是酸性阿魏酸酯酶,在酸性条件下较为稳定,而FAE-1和FAE-2则在碱性条件下比较稳定[2]。瘤胃真菌新美鞭菌属Neocallimastix MC-2菌株可以产生两种阿魏酸酯酶,分子量大小分别为69 kDa 和24 kDa,最适pH值都靠近中性,在40℃较稳定,其中一种酶对阿魏酰低聚糖和对香豆酰低聚糖都有水解作用,而另一种酶只对阿魏酰低聚糖具特异性,研究表明瘤胃真菌产生的阿魏酸酯酶能加快植物细胞壁等成分在瘤胃的降解速度,提高反刍家畜对饲料的消化程度[3]。同一真菌菌株中分离到的阿魏酸酯酶的最适温度、最适pH值等理化性质都比较相似,但在底物特异性方面都存在较大差异,这表明它们在木质纤维素降解过程中发挥的作用是不同的,具体机制还有待进一步研究。
随着研究的进行,在很多植物病原真菌和大型真菌中也开始有该酶的报道[4-6]。
1.1.2细菌阿魏酸酯酶产阿魏酸酯酶的细菌主要为动物和人的肠道细菌,最近在植物病原细菌和瘤胃细菌中也有报道。肠道细菌产生的阿魏酸酯酶能从膳食纤维中释放出肠道易于吸收的游离阿魏酸,使其进入血液中发挥抗氧化的功效。这已经被证实是乳酸菌抗氧化性的主要原因之一。Coutea等对采集自人粪便排泄物的35种细菌分离物进行了阿魏酸酯酶活性的测定,最后发现6种分离物具有阿魏酸酯酶的活性,研究中作者还首次证实了肠道细菌产生的阿魏酸酯酶能将膳食纤维中的具抗氧化活性的阿魏酸释放出来,是有益于人体健康的[7]。Abeijo´n Mukdsi等用含有产阿魏酸酯酶的发酵乳酸杆菌的羊奶奶酪喂食小鼠,发现摄食奶酪的小鼠比对照组小鼠的抗氧化能力明显提高,表现为血浆中的硫代巴比妥酸物质降低了2倍,谷胱甘肽还原酶提高了3倍,进一步证实乳酸菌产生的阿魏酸酯酶能提高肠道内的阿魏酸等抗氧化类物质的生物利用率[8]。瘤胃微生物产生的阿魏酸酯酶对饲料中木质纤维素类物质的快速消化起着重要作用,最初只在瘤胃真菌中被发现。李家宝等在瘤胃细菌Cellulosilyticum ruminicola H1的基因组中克隆了三种性质各异的阿魏酸酯酶,分别命名为FaeⅠ、FaeⅡ和FaeⅢ,三种酶的最适反应温度在40℃左右,最适pH分别为6.0~7.0、8.0和9.0,其中FaeⅡ对玉米芯和人工合成的阿魏酸甲酯、咖啡酸甲酯等模式底物都具有较高的催化活性,而FaeⅢ只对人工合成底物具特异性。通过分析作者推测出了其中两种阿魏酸酯酶在木质纤维素降解中的协同作用机制:FaeⅠ首先松散天然纤维素结构,将纤维素暴露出来,随后大分子底物被(半)纤维素酶降解成小分子酚酸——糖酯;而FaeⅡ对小分子底物具有较高亲和力,可迅速降解被转运进细胞的底物[9]。
1.1.3植物阿魏酸酯酶随着人们对阿魏酸酯酶研究的深入和广泛,在麦芽等发芽的谷物中也检测到了阿魏酸酯酶活性,但其报道相对较少,而且目前还没有关于其在植物体内具体功能的报道。Sancho等首次在大麦粒和麦芽中检测到了阿魏酸酯酶的活性,并发现大麦在25℃发芽2 d后阿魏酸酯酶活性达到最高,因此推测该酶可能在大麦的发芽过程中起作用,Humberstone等也曾在大麦麦芽的提取物中检测到阿魏酸酯酶的活性,但只到2010年大麦芽中的阿魏酸酯酶才被分离纯化出来,分子量为29.3 kDa,最适pH和温度分别为5.5和50℃[10]。Latha等在发芽的龙爪稷中也分离纯化到了一个阿魏酸酯酶,分子量为79.4 kDa,有四个亚基,其最适pH值和最适温度分别为7.5和45℃,且在pH 6.0~9.0和30~40℃时比较稳定[11]。
2 阿魏酸酯酶的理化特性
从1991年至今,有60多种阿魏酸酯酶已经被分离纯化。其中主要为微生物阿魏酸酯酶,植物中只有大麦芽和龙爪稷的阿魏酸酯酶已经被分离纯化。这些阿魏酸酯酶的理化性质差异很大,主要表现在分子量大小、最适pH值和温度、等电点、底物特异性等方面。如分子量大小主要分布在30~70 kDa之间;最适反应pH值主要集中在5~7;最适反应温度主要集中在40~60℃(表1)。
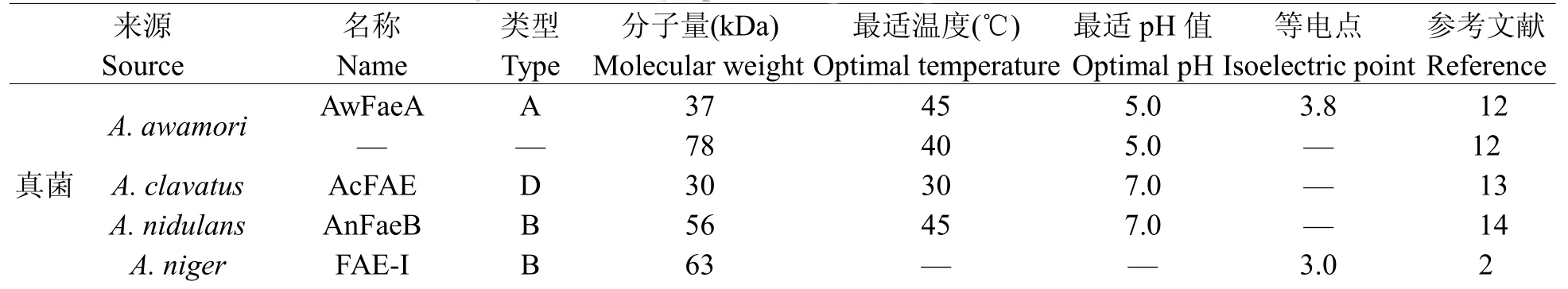
表1 部分已纯化的阿魏酸酯酶的理化性质Table1Physicochem icalpropertiesof partial purified FAEs known to date
“—”:没有相关数据.“—”:no relevantdata.
3 阿魏酸酯酶的分类
阿魏酸酯酶最初根据它们包含的芳香基团被分为两大类。之后又根据其对四种羟基化肉桂酸甲酯模式底物阿魏酸甲酯、咖啡酸甲酯、p-香豆酸甲酯和芥子酸甲酯(图1)的专一性、微生物生长中对底物的需求以及蛋白质序列特异性,将阿魏酸酯酶分为A、B、C、D四种类型(表2)[19]。
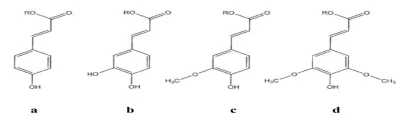
图1 四种羟基肉桂酸的化学结构(a)p-香豆酸;(b)咖啡酸;(c)阿魏酸;(d)芥子酸。R=H时为游离酸形式;R=CH3时为它们的甲基酯形式Fig.1Chem icalstructuresof four hydroxycinnam ic acids (a)p-Coumarate;(b)Caffeate;(c)Ferulate;(d)Sinapinate.R=H-free acid form,R=CH3-methyl-esterified form

表2 基于底物特异性、是否释放二聚阿魏酸以及序列相似性对阿魏酸酯酶进行的分类Table 2 Classification of feruloylesterases(FAEs)based on their activities toward synthetic substrates,their ability to release diferulic acids(diFerA)and their sequence sim ilarity
Shin等发现4类阿魏酸酯酶都有其特有的保守序列G-X-S-X-G。来源于塔宾曲霉(A.tubingensis)、黑曲霉(A.niger)和泡盛曲霉(A.awamori)的A型阿魏酸酯酶都具有共同的氨基酸序列G-H-S-L-G,这些氨基酸序列都存在于一个由16个氨基酸组成的保守序列中(ALTVTGHSLGASLAAL);来源于柄篮状菌(T.stipitatus)、构巢曲霉(A.nidulans)和黑曲霉(A.niger)的C型阿魏酸酯酶都具有共同的氨基酸序列G-C-S-T-G,且其典型序列都存在于一个由13个氨基酸构成的保守序列(SYYLGCSTGGRQG)中,B型和D型阿魏酸酯酶的相应氨基酸序列不如A型和C型保守,作者推测阿魏酸酯酶在酯酶基序周围的保守序列可能在底物特异性上起了决定作用[14]。
4 阿魏酸酯酶的结构特征和催化机理
4.1阿魏酸酯酶的结构特征
由于底物结构的复杂性,不同类型的阿魏酸酯酶在空间结构上存在着差异,但都为结构紧凑的球蛋白,整个拓扑结构为以多个α螺旋包围多个连续的β折叠片形成的典型α/β水解酶结构,活性中心大都具有典型的催化三联体结构“Ser-His-Asp”。如来自于黑曲霉的A型阿魏酸酯酶(FAEA或FAEA-Ⅲ,图2a),FAE-Ⅲ中央含有9个连续的β折叠片,周围被5个α螺旋和2个β折叠片包围(Katherine etal.,2004);丁酸弧菌Butyrivibrio proteoclasticus的阿魏酸酯酶Est1E(图2b),中央含有8个平行的β折叠片(其中一个反向平行),6个α螺旋分别围绕在两侧,另外还有4个β折叠片和2 个α螺旋插入到其中[24]。
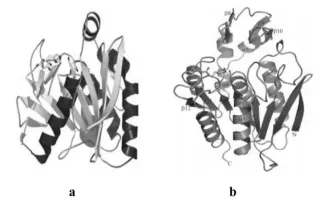
图2 (a)黑曲霉阿魏酸酯酶FAEA-Ⅲ的三维晶体结构;(b)丁酸弧菌阿魏酸酯酶Est1E的三维晶体结构Fig.2(a)Representation of the three-dimensionalstructure of the FAEA-Ⅲ;(b)Representation of the three-dimensional structure of the Est1E
程凡升等应用生物信息学的蛋白质结构预测方法,探讨了来源于荷斯坦奶牛瘤胃宏基因组文库的一个新型阿魏酸酯酶(FAE-SH1)的结构,发现FAE-SH1有一个以G-X-S-X-G(121-127)为特征的酯酶保守区域,而且还具备α/β水解酶的典型特征:Ser123、Asp215和His244在空间构型上构成可能的催化中心。此外,编码该酶的基因序列还存在一个Ile-His-Gly(49-51)保守区域,经分析该区域可以形成一个“氧空洞”,可能在酯键水解过程起稳定中间体的作用。FAE-SH1由7个α螺旋和8个平行的β折叠片组成,其中8个β折叠形成酶的主体结构,7个α螺旋分布于β折叠的周围,所有α螺旋和β折叠的方向均是右手螺旋,三级结构建模发现该酶的三联体催化中心Ser123、Asp215和His244可以在空间上接近并且在蛋白表面形成凹陷的裂缝,构成了供小分子进入的“入口”,这一结构是典型的酯键降解结构,是完成酯键水解过程的关键步骤,此外第136-176号氨基酸残基在“裂缝入口”处形成一个类似“盖子”的结构,该结构可阻止底物或者其它溶剂进入活性中心[25]。
4.2阿魏酸酯酶的作用机理
阿魏酸酯酶大多都含有Ser-His-Asp的“三点催化活性中心”,它的水解反应是通过共价的酰基-酶中间体的形成和随后的分解完成的。以黑曲霉的阿魏酸酯酶FAE-Ⅲ为例,它的活性位点为Ser133,Asp194和His247,其中Ser催化残基在保守序列G-X-S-X-G的中心,且正好处于连接蛋白质表面2个裂缝间的大腔中,完全暴露于外界溶剂,而Asp和His 2个催化残基则位于α/β水解酶的典型位置。FAE-Ⅲ的活性部位由一个盖状区和一个残基环组成,其中盖状区决定底物的特异性,残基环为底物结合提供较好的调整性,而阿魏酸酯酶序列中特有的N-糖基化位点使活性部位一直处于开放构象状态下,从而结合底物。在催化过程中,阿魏酸酯酶的催化中心和辅助中心将阿魏酸酯化合物中的阿魏酸残基束缚,然后经过一系列化学过程将酯键断裂,使阿魏酸游离出来[12]。Koseki等克隆了泡盛曲霉(A.awamori)的阿魏酸酯酶基因Aw faeA,发现它与黑曲霉阿魏酸酯酶FAE-Ⅲ的序列相似度为92%,且Ser133,Asp194和His247三个氨基酸残基也是很保守的,由此推测Aw FAEA的活性中心也是由这三个氨基酸组成,通过对盖状区的四个氨基酸Asp71,Thr72,Asp77和Tyr80进行突变研究了盖状区的功能,进一步证明了盖状区结构是与底物的特异性密切相关的[16]。
5 阿魏酸酯酶基因的克隆表达与调控
5.1阿魏酸酯酶基因的克隆表达
目前已经有近20种不同来源的阿魏酸酯酶基因被克隆和测序,其中多个已经在原核和真核表达系统实现了异源或同源表达。研究发现,真菌阿魏酸酯酶在大肠杆菌(Escherichia coli)中表达时不能形成正确空间折叠的蛋白,导致其在大肠杆菌中不表达或表达量很低,如A.niger阿魏酸酯酶FAEA在大肠杆菌中的表达量仅为在黑曲霉中表达量的1/10[26]。相比而言,毕氏酵母(Pichia pastoris)是较理想的真菌阿魏酸酯酶的表达体系,以芽殖酵母的α因子为分泌信号,并利用乙醇氧化酶(AOXl)的启动子在毕氏酵母中已经实现了多个真菌阿魏酸酯酶基因的异源表达[27]。
为了更好的发挥阿魏酸酯酶的功能,科研人员还将阿魏酸酯酶克隆到植物中使其分泌阿魏酸酯酶从而对自身细胞壁进行降解。Buanafina等将黑曲霉(A.niger)的阿魏酸酯酶基因转入了高羊茅草(Festuca arundinacea)中,并分别利用组成型表达的水稻肌动蛋白启动子、诱导型表达的花椰菜花叶病毒(CauliflowerMosaic Virus,CaMV)35s启动子、玉米的泛素启动子以及可诱导的热休克和衰老启动子进行了表达,结果发现几种启动子都可以有效的在转基因植物体内表达阿魏酸酯酶并将其定位于植物液泡内,但可诱导的热休克和衰老启动子表达的效率最高,当细胞死亡时转基因高羊茅内表达的阿魏酸酯酶可以对植物细胞壁进行“自体消化”,而且这种降解效率可随着外源木聚糖酶的加入而大大增强,使得转基因植物可以更好的用于动物饲料或是生物乙醇的生产。
5.2阿魏酸酯酶基因的调控
阿魏酸酯酶表达调控方面的研究较少,目前研究的比较深入的是编码黑曲霉阿魏酸酯酶FAEA 的faeA基因。研究发现faeA的表达主要受木聚糖降解调节子XlnR、碳源代谢物抑制子CreA和对某些芳香族化合物做出反应的某个因子等三大因子的调控。faeA的诱导表达主要有2个途径:一个为木聚糖/木糖诱导途径,它受木聚糖降解调节子XlnR调节;另一个为芳香族化合物(如阿魏酸、香草酸、香兰醇等)诱导途径,适当浓度的阿魏酸能诱导阿魏酸酯酶的表达,但浓度过高时阿魏酸会对细胞产生毒害作用,反而使阿魏酸酯酶的产量下降,两个途径是有协同效果的,适当浓度阿魏酸的加入可以增强木聚糖对faeA的诱导表达。碳代谢物抑制子蛋白CreA介导的碳代谢产物抑制途径对faeA的表达有抑制作用,外源加入葡萄糖能抑制以木糖为碳源的野生菌株faeA基因的表达,但对CreA突变株却几乎没有抑制作用,说明碳代谢产物对faeA的抑制主要是由于CreA导致的。
6 阿魏酸酯酶的发酵生产
阿魏酸酯酶的发酵生产主要有液体发酵和固体发酵两种,其中固体发酵以周期短、能耗少、水消耗量较低、对环境污染程度低、产量大等优点在阿魏酸酯酶的生产中受到广泛的重视。目前在黑曲霉、青霉、嗜热侧孢霉和泡盛曲霉等微生物中都实现了固体发酵产阿魏酸酯酶。阿魏酸酯酶是诱导酶,常用麦麸、玉米麸、啤酒糟、燕麦木聚糖、甜菜渣等木质纤维素含量丰富的混合碳源作基质来进行生产,而当以葡萄糖、木糖、乳糖、麦芽糖等单糖或二糖作为碳源时,微生物不会产生阿魏酸酯酶。F.proliferatum NRRL26517在以玉米麸为碳源时产生的阿魏酸酯酶是以燕麦木聚糖为碳源时的7倍多,研究发现这是因为玉米麸中含有较多的阿魏酰酯键,而用去除阿魏酰酯键结构的玉米麸作为碳源时,该菌株产阿魏酸酯酶的能力大大下降,表明玉米麸中的阿魏酰酯键对诱导阿魏酸酯酶的产生是必需的[14]。Topakas等在诱导嗜热侧孢霉产阿魏酸酯酶时发现用碱处理除去麦秸中的阿魏酰酯键后,该菌株产阿魏酸酯酶的能力大大降低,再次证实了碳源中的阿魏酰酯键对诱导产生阿魏酸酯酶的重要性[2]。
7 阿魏酸酯酶的应用现状
7.1分离阿魏酸
植物细胞壁是阿魏酸的最重要来源,粮食加工业每年产生大量副产品,如啤酒糟、麦麸、玉米麸、米糠等,这些物质的主要成分是细胞壁,含有丰富的阿魏酸。传统工业中普遍采用碱处理的方法来提取阿魏酸,高浓度的碱易引起植物细胞壁中其他成分的改变而且还容易有化学残留,不利于后期的提纯。研究发现阿魏酸酯酶可以从麦麸、玉米麸、小麦秸秆、玉米秸秆、啤酒糟、甘蔗渣、燕麦壳、咖啡渣、苹果渣等很多农副产品中释放出阿魏酸[5,6,22,23]。近年来研究者越来越多地采用温和而特异性高的酶法来提取阿魏酸并取得了很好的效果。
7.2用作膳食纤维补充剂
流行病学研究认为麦麸、燕麦等膳食纤维的消费与某些慢性病,如冠心病和某些癌,特别是与消化道有关的结肠癌的预防有着密切关系,这种对健康的有益作用常常归功于膳食中的酚酸类物质。膳食中的酚酸类化合物主要是阿魏酸,而几乎所有的阿魏酸都是以糖酯的形式存在,以这种复杂形式存在的阿魏酸通常认为不能被动物和人体所吸收。研究发现乳酸菌、枯草芽孢杆菌、双歧杆菌等多种肠道菌产生的阿魏酸酯酶可以将膳食纤维中的将阿魏酸游离出来,但是这些微生物释放的阿魏酸浓度太低,不能达到保健防护的效果,因此需要外源添加阿魏酸酯酶制剂来增强阿魏酸的释放量,使之更好的发挥其生理活性功能。Abeijo´n Mukdsi等用含有能产生阿魏酸酯酶的发酵乳酸菌L. fermentum CRL1446的羊奶奶酪喂食小鼠,发现喂食奶酪的小鼠比对照组小鼠肠道内的阿魏酸酯酶活性提高2倍多,而且喂食奶酪的小鼠抗氧化能力明显提高,表现为血浆中的硫代巴比妥酸物质(TBARS)降低了2倍,谷胱甘肽还原酶(GR)提高了3倍,进一步研究发现这都是因为乳酸菌产生的阿魏酸酯酶能将膳食纤维中的阿魏酸等抗氧化物质游离出来,提高其生物利用率,使其更好的发挥抗氧化活性[8]。
7.3合成酚酸化合物
阿魏酸、p-香豆酸和芥子酸等羟基肉桂酸具有抗菌、防紫外线、抗肿瘤、抗氧化等功效,因此在食品、医药和化妆品领域具广泛的应用前景。但由于这些酚酸分子中的烷烃较短,含有双键,导致其亲水性较强,脂溶性较差,影响到其在体内的转运和利用,因此大大限制了其在油脂类食品和化妆品中的应用。研究发现将阿魏酸以酯键的形式连接到糖、醇或者脂类的母体上,可以显著改善阿魏酸的脂溶性,提高其稳定性。
阿魏酸酯酶可用于催化在水—有机溶剂混合体系或微乳液中发生的羟基肉桂酸的酯化或酯基交换反应,而且生成阿魏酸酯衍生物的酯化反应只能用阿魏酸酯酶进行催化。尖孢镰刀菌F.oxysporum中分离的阿魏酸酯酶可以在没有表面活性剂的微乳液中催化1-丙醇和羟基肉桂酸的酯化反应[2]。黑曲霉中的阿魏酸酯酶AnFaeA可以催化芥子酸甲酯的转酯反应并生成1-或4-丁基芥子酸,研究发现芥子酸及其衍生物在抗衰老化妆品和防晒霜中有很好的应用前景,另外它还是增强DNA修复的重要因子[28]。
与游离的羟基肉桂酸相比,这些糖酯类衍生物具有更好的脂溶性,更强的活性,较低的毒性以及更强的适应性,在医药、食品、化妆品等方面有广阔的应用前景。
7.4在造纸工业的应用
工业上要获得高品质的纸浆,必须除去造成纸浆呈黑色的木质素,传统的制浆法都采用氯化物去除木质素,但产生的废水中含有大量的芳香族有毒污染物,对环境造成了严重的污染。而阿魏酸酯酶可以水解植物细胞壁间连接木质素和碳水化合物的阿魏酸酯键,所以在造纸行业中被认为是脱除木质素的一个新选择。
Record等分别检测了黑曲霉中的阿魏酸酯酶在单独或添加漆酶介体系统和木聚糖酶的条件下脱除麦秸秆中木质素的效果,发现在麦秸秆纸浆漂白过程中单独添加阿魏酸酯酶时可以去除38%的木质素,当与木聚糖酶和漆酶协同作用时,可以脱除74%的木质素,且卡伯(Kappa)值降至3.9[29]。
7.5在饲料工业上的应用
农作物秸秆是我国畜牧业中十分重要的粗饲料来源,其在反刍家畜日粮中所占的比例高达70%以上。但农作物秸秆中的阿魏酸、二聚阿魏酸等酚酸类分子以酯键方式与半纤维素分子间形成致密网状交联结构,空间上阻遏了瘤胃微生物所分泌的纤维素酶、木聚糖酶等木质纤维素降解酶对饲草中纤维素和半纤维素的有效酶解,一度成为瘤胃生物利用细胞壁类物质的瓶颈因素。
研究发现用阿魏酸酯酶预处理农作物秸秆等粗饲料,可促进瘤胃微生物对饲料细胞壁的降解,提高反刍家畜对饲料的消化程度,减少随粪便排出的营养物质,从而提高饲料的利用效率[30]。
此外,因为阿魏酸酯酶可以加速木质纤维素的降解,因此在生物质利用和燃料乙醇的生产中发挥重要作用。
8 展望
综上所述,阿魏酸酯酶在医药、食品、造纸、饲料等领域都具有重大应用前景,但目前已报道的阿魏酸酯酶普遍酶活力低,稳定性较差,一定程度上限制了其在实际生产中的应用。近年来国内外科学家对阿魏酸酯酶的研究主要侧重其理化性质方面,而关于其结构特性和催化机理方面的报道较少,这无疑也成为限制高活性阿魏酸酯酶研制的一个关键因素。接下来,从该酶的结构和催化特性方面入手,进一步借助分子生物学的手段提高该酶的活性和稳定性将是值得深入研究的问题。
[1]Fazary AE,Ju,YH.Feruloyl esterases as biotechnological tools:currentand future perspectives[J].Acta Biochim ica et Biophysica Sinica,2007,39:811-828
[2]Topakas E,Vafiadi C,Christakopoulos P.M icrobial production,characterization and applications of feruloyl esterases[J].Process Biochem istry,2007,42:497-509
[3]Borneman WS,Ljungdahl LG,Hartley,etal.Purification and partial characterization of two feruloylesterases from the anaerobic Neocallimastix strain MC-2[J].Applied and EnvironmentalM icrobiology,1992,58:3762-3766
[4]Hassan S,Hugouvieux-Cotte-Pattat N.Identification of two feruloyl esterases in Dickeya dadantii3937 and induction of themajor feruloylesterase and of pectate lyasesby ferulic acid[J].Journalof Bacteriology,2011,193:963-970
[5]Wang L,Ma ZQ,Du F,etal.A novel feruloylesterase from theediblemushroom,Panusgiganteus:A potential dietary supplement[J].Journalof Agriculturaland Food chem istry,2014,62:7822-7827
[6]Wang L,Zhang R,Ma ZQ,et al.A feruloy esterase(FAE)characterized by relatively high thermostability from the ediblemushroom Russula virescens[J].Applied Biochemistry and Biotechnology,2014,172:993-1003
[7]Couteau DM,Gibson GR,Williamson G,et al.Isolation and characterization of human colonic bacteria able to hydrolyse chlorogenic acid[J].Journalof Applied M icrobiology,2001,90:873-881
[8]Abeijón Mukdsi MC,Haro C,González SN,et al.Functional goatmilk cheese w ith feruloyl esterase activity[J].Journalof Functional Foods,2013,5:801-809
[9]Li J,Cai S,Luo Y,et al.Three feruloyl esterases in Cellulosilyticum ruminicola H1 act synergistically to hydrolyze esterified polysaccharides[J].Applied and EnvironmentalM icrobiology,2011,77(17):6141-6147
[10]刘莎莎,李华,石庆华,等.大麦芽阿魏酸酯酶的分离纯化及其部分酶学性质的测定[J].中国畜牧兽医,2010,37:28-31
[11]Latha GM,Srinivas P,Muralikrishna G.Purification and characterization of ferulic acid esterase from malted finger millet[J].Journalof Agriculturaland Food chemistry,2007,55:9704-9712
[12]Kanauchi M.Characteristics and role of feruloyl esterase from Aspergillus Awamori in Japanese spirits,‘Awamori' production[J].Scientific,Health and SocialAspectsof the Food Industry,2012:145-162
[13]Damasio AR,Braga CM,Brenelli LB,etal.Biomass-to-bio-products application of feruloyl esterase from Aspergillus clavatus[J].Applied M icrobiology and Biotechnology,2013,97:6759-6767
[14]Shin HD,Chen RR.A type B feruloyl esterase from Aspergillus nidulans w ith broad pH applicability[J].Applied M icrobiology and Biotechnology,2007,73:1323-1330
[15]Hegde S,Muralikrishna G.Isolation and partial characterization of alkaline feruloyl esterases from Aspergillus niger CFR 1105 grown onwheatbran[J].world JournalofM icrobiology&Biotechnology,2009,25:1963-1969
[16]Koseki T,Hori A,Seki S,et al.Characterization of two distinct feruloyl esterases,AoFaeB and AoFaeC,from Aspergillus oryzae[J].Applied M icrobiology and Biotechnology,2009,83:689-696
[17]Yang SQ,Tang L,Yan QJ,etal.Biochem ical characteristics and gene cloning of a novel thermostable feruloyl esterase from Chaetomium sp.[J].Journalof Molecular Catalysis B-Enzymatic,2013,97:328-336
[18]Kuhnel S,Pouvreau L,Appeldoorn MM,et al.The ferulic acid esterases of Chrysosporium lucknowense C1:purification,characterization and their potential application in biorefinery[J].Enzyme and M icrobial Technology,2012,50:77-85
[19]Crepin VF,Faulds CB,Connerton IF.Identification of a type-D feruloyl esterase from Neurospora crassa[J].Applied M icrobiology and Biotechnology,2004,63:567-570
[20]McClendon SD,Shin HD,Chen RR.Novel bacterial ferulic acid esterase from Cellvibrio japonicus and itsapplication in ferulic acid release and xylan hydrolysis[J].Biotechnology Letters,2011,33:47-54
[21]Esteban-Torres M,Reveron I,Mancheno JM,et al.Characterization of a feruloyl esterase from Lactobacillus plantarum[J].Applied and EnvironmentalM icrobiology,2013,79:5130-5136
[22]Huang YC,Chen YF,Chen CY,et al.Production of ferulic acid from lignocellulolytic agricultural biomass by Thermobifida fusca thermostable esterase produced in Yarrowia lipolytica transformant[J].Bioresource Technology,2011,102:8117-8122
[23]Rakotoarivonina H,Hermant B,Chabbert B,et al.thermostable feruloyl-esterase from the hem icellulolytic bacterium Thermobacillus xylanilyticus releases phenolic acids from non-pretreated plant cellwalls[J].Applied M icrobiology and Biotechnology,2011,90:541-552
[24]Goldstone DC,Villas-Boas SG,Till M,et al.Structural and functional characterization of a prom iscuous feruloyl esterase(Est1E)from the rumen bacterium Butyrivibrio proteoclasticus[J].Proteins,2010,78:1457-1469
[25]程凡升,张茂秋,程凡杰,等.结构预测及分子对接方法研究几种水解产物对新阿魏酸酯酶的抑制作用[J].高等学校化学学报,2012,33:1788-1793
[26]Benoit I,Navarro D,Marnet N,et al.Feruloyl esterases as a tool for the release of phenolic compounds from agro-industrialby-products[J].Carbohydrate Research,2006,341:1820-1827
[27]Zhang SB,Wang L,Liu Y,et al.Expression of feruloyl esterase A from Aspergillus terreus and its application in biomass degradation[J].Protein Expression and Purification,2015,115:153-157
[28]Vafiadi C,Topakas E,Alissandratos A,et al.Enzymatic synthesis of butyl hydroxycinnamates and their inhibitory effectson LDL-oxidation[J].Journalof Bacteriology,2005,133:497-504
[29]Record E,Asther M,Sigoillot C,et al.Overproduction of the Aspergillus niger feruloyl esterase for pulp bleaching application[J].Applied M icrobiology and Biotechnology,2003,62:349-355
[30]杨红建,黎大洪,谢春元,等.阿魏酸酯酶处理对羊草、玉米秸、稻秸及麦秸瘤胃体外发酵特性的影响[J].动物营养学报,2010,22:207-211
A Review on Research and Applications of Feruloyl Esterase
WANG Li1,2,SUNQin-dong1,WANGHe-xiang2*
1.College ofPlantProtection/Shandong AgriculturalUniversity,Taian 271018,China
2.College ofBiological Sciences/China AgriculturalUniversity,Beijing 100193,China
Feruloyl esterases(FAEs)are able to hydrolyze the ester bond between hydroxycinnam ic acids and hem icellulosic sugars and release ferulic acid from the plant cellwall,which demonstrate awide variety of applications in food,cosmetic,medical,feed industries and producing bioethanol.This review provided an overview of the current know ledge on feruloyl esterases including its source,physicochem icalproperty,structural featuresand catalyticmechanism and itsapplications.
Feruloylesterase;research progress;application progress
Q55
A
1000-2324(2016)04-0628-08
2016-05-18
2016-05-24
山东省自然科学基金(ZR2015CL040);山东农业大学校青年科技创新基金(24031)
王丽(1985-),女,山东聊城人,博士,主要从事大型真菌中生物活性物质研究.E-mail:haoyou0102@163.com
Author for correspondence.E-mail:hxwang@cau.edu.cn

