人参活性成分及人参复方制剂对细胞色素P450酶调节作用的研究进展
吴德琳,刘 娟,郑思道
人参活性成分及人参复方制剂对细胞色素P450酶调节作用的研究进展
吴德琳,刘娟,郑思道
人参具有广泛的药理作用,与其活性成分复杂有关。临床应用时需要注意避免毒副反应及药物间不良相互作用。药物间相互作用绝大多数由细胞色素P450酶介导,其中以CYP3A4酶最重要。人参活性成分及人参复方制剂可以调节多种P450酶,尤其以下调CYP3A4酶活性的作用明确。部分人参活性成分与人参复方制剂对P450酶的调节方向相同,如人参皂苷Re及参麦注射液、参附注射液均上调CYP2C11、CYP2J3酶活性,而人参皂苷Rh2、人参皂苷 Compound K、参麦注射液、参附注射液均下调CYP3A4酶活性,提示人参复方的药理基础源于人参活性成分。另有部分人参活性成分对P450酶的调节方向与人参复方制剂的调节方向相反,如人参总皂苷下调CYP1A2、CYP2E1酶活性,而参麦注射液则上调这两种P450酶活性,提示人参复方的配伍可以改变人参活性成分对P450酶的调节作用。
人参皂苷;参麦注射液;参附注射液;细胞色素P450酶;药物相互作用
人参在古代中国就被用于治疗疾病,至今仍然被广泛应用,并被其他国家和地区接受,而聚焦于人参的研究也日渐增加,迄今为止研究人参的相关文献已超过6 000篇[1-2]。人参活性成分包括人参皂苷、多聚糖、生物碱、葡萄糖苷等,也包括对机体具有调控作用的体内代谢产物,其中人参皂苷是人参最主要的活性成分之一[3]。人参活性成分具有抗动脉粥样硬化、抗心肌缺血、抗心律失常、抑制心室重构、改善脑循环、抗炎、抗氧化应激、降糖、抗肿瘤等多种作用,用于治疗心脑血管疾病、肝病、糖尿病、肿瘤等,是临床应用最多的中草药之一[1,4-8]。源于人参的现代人参复方制剂(如参麦注射液、参附注射液等)也被广泛应用于临床,丰富着中药的临床应用范围。
随着人参及其复方制剂的推广应用,人参滥用、误用导致的人参与西药间相互作用等涉及用药安全性问题逐渐引起关注,如美国心脏协会和中华医学会心血管病学分会均已提出人参可能影响抗凝药物华法林代谢,建议避免两者合用,以利于临床用药安全[9-11]。有研究显示:人参对华法林的干预作用可能与其抑制细胞色素P450(cytochrome P450,P450或CYP)酶活性、延缓华法林清除的作用有关[12]。P450酶在药物代谢过程具有重要作用,参与调控目前已知95%药物的氧化或清除,其中以CYP3A4参与的反应最多,占13%~27%[13-14]。本文综述人参活性成分及人参复方制剂调控P450酶的作用,并探讨其特点。
1 人参活性成分对P450酶的调节作用
1.1人参总皂苷γ 射线照射后大鼠肝P450 酶表达水平发生变化,CYP1A2、CYP2B1、CYP2E1和CYP3A4 mRNA表达上调,相应酶活性增加,而人参总皂苷干预后可以逆转上述改变,降低CYP1A2、CYP2B1、CYP2E1和CYP3A4 mRNA和蛋白表达,并且作用强度呈现剂量依赖性,提示人参总皂苷可以调控放射引起的肝P450 酶表达异常[15]。另一研究也显示:人参总皂苷可以呈剂量依赖性下调小鼠肝CYP1A2 mRNA表达,抑制该酶活性,这一调节现象在脂多糖诱导处理的小鼠肝脏中更加显著[16]。人参总皂苷及20s型原人参二醇、20s型原人参三醇均能够通过下调人肝微粒体和肠道微粒体CYP3A4酶活性抑制活性维生素 D3降解,从而使活性维生素 D3维持在更高浓度,可能有益于肿瘤、神经变性疾病和代谢性疾病的治疗[17]。此外,20s型原人参二醇在小肠吸收及肝脏代谢的过程中受CYP3A酶的调节,其中主要的调节酶是CYP3A4,其次是CYP3A5,提示20s型原人参二醇可能会与其他经由CYP3A4酶代谢的药物存在相互作用[18]。红参提取物抑制乙醇诱导的小鼠肝CYP2E1酶表达上调,降低该酶活性,从而减少慢性酒精中毒引起的活性氧簇和活性氮表达升高,抑制氧化应激引起的肝损害[19]。另有研究表明:红参提取物能够上调高脂血症大鼠肝CYP7A1mRNA表达,降低低密度脂蛋白胆固醇与高密度脂蛋白胆固醇比值,促进胆固醇代谢[20]。该研究也通过离体研究证实,红参提取物上调大鼠原代肝细胞CYP7A1mRNA和蛋白表达水平,并进一步证实提取物中的人参皂苷Ro,Rg3,Re,Rg1,and Rg2发挥了主要作用,提示这些人参皂苷可能是红参通过CYP7A1酶调控血脂代谢的主要活性成分。此外,红参提取物对乙酰氨基酚诱导的肝损伤具有抑制作用,部分机制与其抑制CPY2E1酶活性进而改变乙酰氨基酚代谢的作用有关,提取物中的人参皂苷Rg3可能是引起上述作用的最主要活性成分[21]。
1.2人参皂苷Re通过对H9c2心肌细胞色素P450酶的干预发现,人参皂苷Re能够上调CYP2C11、CYP2J3表达,下调CYP4A1、CYP4A3和CYP4F4表达,从而调节心肌P450酶之间的平衡,其中对CYP2J3酶和CYP4A1酶表达水平的调节作用呈浓度依赖性[22]。 离体研究显示,人参提取物上调大鼠原代肝细胞CYP8B1mRNA表达,而进一步分析显示人参皂苷Re起到主要作用,表明人参皂苷Re可以上调肝细胞CYP8B1mRNA表达[23]。
1.3人参皂苷Rh2研究显示:人参皂苷Rh2是肝微粒体CYP3A4酶的作用底物,表明CYP3A4是人参皂苷Rh2的代谢酶,结合人参皂苷Rh2对CYP3A4酶具有下调作用,提示联合应用其他经由CYP3A4酶代谢的药物时需注意调整使用剂量[17,24]。
1.4人参皂苷Compound K人参皂苷Compound K是人参皂苷的体内代谢产物,可以抑制人肝微粒体CYP2C9、CYP3A4酶活性,而基本不影响CYP1A2、CYP2A6、CYP2D6、CYP2E1、CYP2C19等酶的活性[25]。
2 人参复方制剂对P450酶的调节作用
2.1参麦注射液参麦注射液呈剂量依赖性诱导H9c2心肌细胞CYP2C11和CYP2J3表达上调[26]。这一调节作用与人参皂苷Re对CYP2C11和CYP2J3的调节作用类似,提示人参皂苷Re可能是参麦注射液调节心肌细胞CYP2C11和CYP2J3表达的主要活性成分[22,26]。参麦注射液的成分之一红参对H9c2心肌细胞CYP2B1表达也具有诱导作用,这一作用与人参总皂苷对P450 酶调控的作用类似,但参麦注射液对CYP2B1上调并不明显,可能与参麦注射液另一成分麦冬对CYP2B1的抑制有关[15,26-27]。在体研究也证实参麦注射液对除CYP2B1、CYP4A3 和CYP4F6的心肌P450酶其他亚型具有上调作用[27]。另有研究显示:参麦注射液可上调大鼠肝脏CYP2C9 酶活性,但对CYP1A2、CYP3A酶活性无明显影响,可能与红参、麦冬上调CYP2C mRNA表达的作用有关[28]。该研究同时显示红参、麦冬对CYP2B mRNA表达均无影响,但参麦注射液却能够上调CYP2B6 mRNA表达,增强该酶活性,提示中药配伍能够改变各组分对P450酶的调控作用。此外,参麦注射液也显著增强大鼠肝脏CYP2E1酶活性,但抑制肠微粒体中CYP3A 酶活性[29]。可以看出参麦注射液对不同组织同一P450酶的调节作用可能存在不同,提示中药作用具有组织特异性的特点[28-29]。
2.2参附注射液研究显示:参附注射液在转录水平调控大鼠肝脏P450 酶活性,通过上调CYP2B、CYP2C11表达水平降低对应酶活性,而通过下调CYP1A2、CYP3A4表达水平抑制相应酶活性[30]。参附注射液对附子引起的心脏毒性具有抑制作用,减轻附子导致的心肌细胞存活率下降、细胞凋亡增加、乳酸脱氢酶升高、心率减慢等[31]。进一步研究显示:附子的诱导心肌细胞CYP2J3 mRNA表达下调可能与其心脏毒性有关,而人参和参附注射液能够上调CYP2J3 mRNA表达,提示人参、附子配伍后通过对心肌细胞CYP2J3mRNA的调控显示出减毒作用。如前所述,人参复方制剂参附注射液和参麦注射液均显示出类似调节CYP2J3 mRNA表达的作用,并且与人参皂苷Re对CYP2J3的调节作用类似,提示人参皂苷Re可能是人参、参附注射液、参麦注射液通过上调CYP2J3保护心脏的主要活性成分[22,26,31]。
可以看出人参活性成分及人参复方制剂对P450酶具有广泛调节作用,部分活性成分是人参复方制剂调控P450酶的物质基础(见表1)。
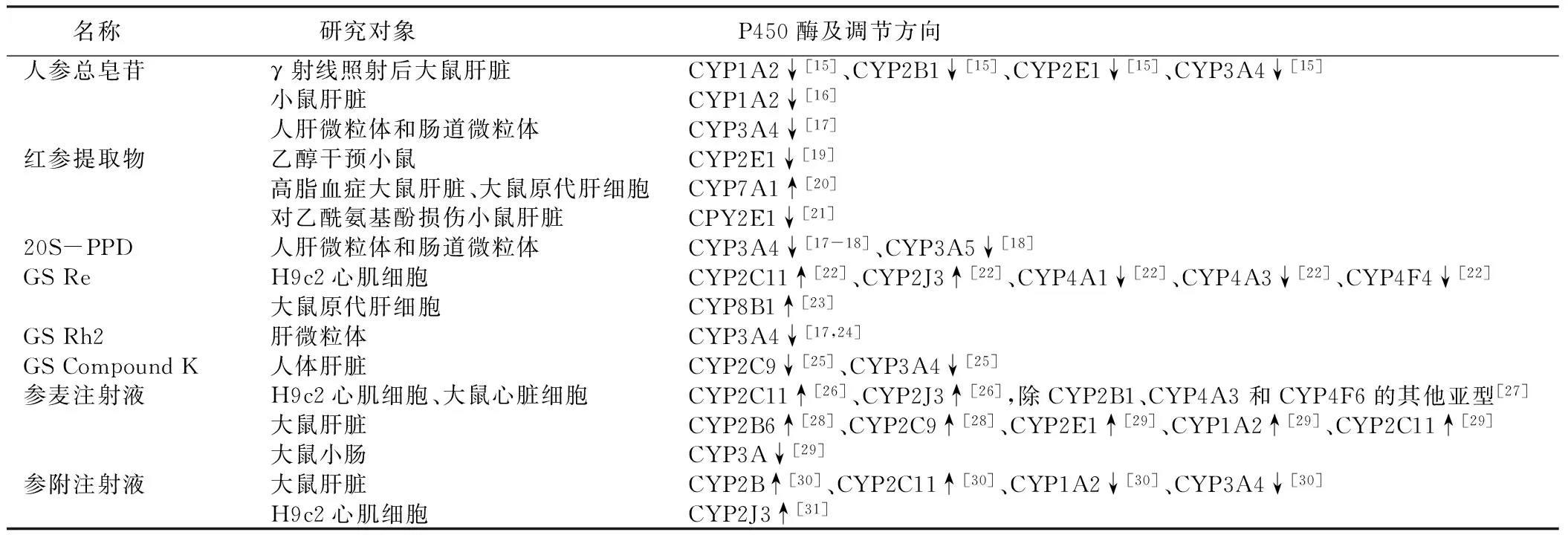
表1 人参活性成分及人参复方制剂对P450酶的调控作用
3 小 结
人参具有广泛药理作用,与其活性成分复杂有关[2]。临床应用时需要注意避免滥用、误用导致毒副反应及药物间不良相互作用[10]。药物间相互作用绝大多数由P450酶介导,因此仔细分析人参活性成分及人参复方制剂对P450酶的调节作用,对预测、阐释人参及其复方制剂的配伍、与西药间相互作用等具有重要意义[14]。而随着新技术和方法的出现,人参对P450酶的调节作用可能会得到进一步阐明[1]。
目前研究表明:人参活性成分及人参复方制剂可以调节多种P450酶,尤其以下调CYP3A4酶活性的作用明确。部分人参活性成分与人参复方制剂对P450酶的调节方向相同,如人参皂苷Re及参麦注射液、参附注射液均上调CYP2C11、CYP2J3酶活性,而GS Rh2、GS Compound K、参麦注射液、参附注射液均下调CYP3A4酶活性,提示人参复方的药理基础源于人参活性成分。另有部分人参活性成分对P450酶的调节方向与人参复方制剂的调节方向相反,如人参总皂苷下调CYP1A2、CYP2E1酶活性,而参麦注射液则上调这两种P450酶活性,提示人参复方的配伍可以改变人参活性成分对P450酶的调节作用。
[1]郑思道,于雯,王宁元.MicroRNA介导的人参及其活性成分药理作用与机制[J].世界中西医结合杂志,2016,11(6):880-883.
[2]Shin BK,Kwon SW,Park JH.Chemical diversity of ginseng saponins from Panax ginseng[J].J Ginseng Res,2015,39(4):287-298.
[3]Zheng SD,Wu HJ,Wu DL.Roles and mechanisms of ginseng in protecting heart[J].Chin J Integr Med,2012,18(7):548-555.
[4]孙莹莹,刘玥,陈可冀.人参皂苷的心血管药理效应:进展与思考[J].中国科学:生命科学, 2016,46(6):771-778.
[5]Ong WY,Farooqui T,Koh HL,et al.Protective effects of ginseng on neurological disorders[J].Front Aging Neurosci,2015,7:129.
[6]Lam P,Cheung F,Tan HY,et al.Hepatoprotective effects of chinese medicinal herbs: a focus on anti-inflammatory and anti-oxidative activities[J].Int J Mol Sci,2016,17(4):465.
[7]Gui QF,Xu ZR,Xu KY,et al.The Efficacy of Ginseng-Related Therapies in Type 2 Diabetes Mellitus: An Updated Systematic Review and Meta-analysis[J].Medicine (Baltimore), 2016,95(6):e2584.
[8]Kim K.Effect of ginseng and ginsenosides on melanogenesis and their mechanism of action[J].J Ginseng Res,2015,39(1):1-6.
[9]Page RL2nd,O’Bryant CL,Cheng D,et al.Drugs that may cause or exacerbate heart failure: a scientific statement from the American Heart Association[J].Circulation,2016,134(6):e32-69.
[10]Paik DJ,Lee CH.Review of cases of patient risk associated with ginseng abuse and misuse[J].J Ginseng Res,2015,39(2):89-93.
[11]中华医学会心血管病学分会,中国老年学学会心脑血管病专业委员会.华法林抗凝治疗的中国专家共识[J].中华内科杂志,2013,52(1):76-82.
[12]Chua YT,Ang XL,Zhong XM,et al.Interaction between warfarin and Chinese herbal medicines[J].Singapore Med J,2015,56(1):11-18.
[13]Guengerich FP,Waterman MR,Egli M.Recent structural insights into cytochrome P450 function[J].Trends Pharmacol Sci,2016,37(8):625-640.
[14]Rendic S,Guengerich FP.Survey of human oxidoreductases and cytochrome P450 enzymes involved in the metabolism of xenobiotic and natural chemicals[J].Chem Res Toxicol,2015,28(1):38-42.
[15]易剑峰,吴波,刘苍龙,等.人参总皂苷对γ射线照射后大鼠肝P450酶调节作用研究[J].中国中药杂志,2015,40(20):4037-4043.
[16]Sun H,Yan Y,Xu C,et al.Suppression of hepatic cyp1a2 by total ginsenosides in lipopolysaccharide-treated mice and primary mouse hepatocytes[J].J Agric Food Chem, 2016,64(11):2386-2393.
[17]Deb S,Chin MY,Adomat H,et al.Ginsenoside-mediated blockade of 1 alpha,25-dihydroxyvitamin D3 inactivation in human liver and intestine in vitro[J].J Steroid Biochem Mol Biol,2014,141:94-103.
[18]Chiu NT,Tomlinson Guns ES,Adomat H,et al.Identification of human cytochrome P450 enzymes involved in the hepatic and intestinal biotransformation of 20(S)-protopanaxadiol[J].Biopharm Drug Dispos,2014,35(2):104-118.
[19]Han JY,Lee S,Yang JH,et al.Korean Red Ginseng attenuates ethanol-induced steatosis and oxidative stress via AMPK/Sirt1 activation[J].J Ginseng Res,2015,39(2):105-115.
[20]Kawase A,Yamada A,Gamou Y,et al.Increased effects of ginsenosides on the expression of cholesterol 7 alpha-hydroxylase but not the bile salt export pump are involved in cholesterol metabolism[J].J Nat Med,2013,67(3):545-553.
[21]Gum SI,Cho MK.Korean red ginseng extract prevents APAP-induced hepatotoxicity through metabolic enzyme regulation: The role of ginsenoside Rg3,a protopanaxadiol[J].Liver International,2013,33(7):1071-1084.
[22]马增春,肖勇,赵佳伟,等.人参皂苷Re对H9c2心肌细胞CYP450酶的影响[J].中国药理学通报, 2016,32(4):494-498.
[23]Kawase A,Yamada A,Gamou Y,et al.Effects of ginsenosides on the expression of cytochrome P450s and transporters involved in cholesterol metabolism[J].J Nat Med,2014,68(2):395-401.
[24]Li L,Chen X,Zhou J,et al.In vitro studies on the oxidative metabolism of 20(s)-ginsenoside Rh2 in human,monkey,dog,rat,and mouse liver microsomes,and human liver s9[J].Drug Metab Dispos,2012,40(10):2041-2053.
[25]Xiao J,Chen D,Lin XX,et al.Screening of drug metabolizing enzymes for the ginsenoside compound K in vitro:an efficient anti-cancer substance originating from panax ginseng[J].PLoS One,2016,11(2):e0147183.
[26]张红曦,董志.参麦注射液对心肌细胞中细胞色素P450酶的影响[J].重庆医科大学学报,2014,39(10):1400-1403.
[27]张红曦,王宇光,马增春,等.参麦注射液对大鼠心脏细胞色素P450酶的调节作用[J].中国药理学通报,2014,30(4):484-490.
[28]张红曦,王宇光,马增春,等.参麦注射液对大鼠肝脏CYP450酶的影响[J].中国新药杂志,2013,22(21):2529-2533.
[29]卜明华,郑咏秋,张颖,等.参麦注射液和注射用血塞通对大鼠肝脏及肠道药物代谢酶CYP450的影响[J].中国临床药理学杂志,2012,28(1):49-52.
[30]李晗,王宇光,马增春,等.基于临床用量的参附注射液对大鼠肝脏主要药物代谢酶的影响[J].药学学报,2013,48(5):728-733.
[31]Xiao Y,Ma ZC,Wang YG,et al.Cardioprotection of Shenfu preparata on cardiac myocytes through cytochrome P450 2J3[J].J Integr Med,2013,11(5):327-336.
(本文编辑郭怀印)
北京市优秀人才培养资助青年骨干个人项目(No.2014000057592G296)
北京市中西医结合医院(北京 100039)
郑思道,E-mail:zhengsidao@yahoo.com
R329R289.5
A
10.3969/j.issn.1672-1349.2016.16.015
1672-1349(2016)16-1874-03
2016-04-18)

