一种新型CO2置换CH4水合物的开采方法
Khlebnikov V.N. Antonov S.V. Mishin A.S. Bakulin D.A. Khamidullina I.V. 梁 萌 Vinokurov V.A. Gushchin P.A.
俄罗斯古勃金国立石油天然气大学
一种新型CO2置换CH4水合物的开采方法
Khlebnikov V.N. Antonov S.V. Mishin A.S. Bakulin D.A. Khamidullina I.V.梁萌 Vinokurov V.A. Gushchin P.A.
俄罗斯古勃金国立石油天然气大学
Khlebnikov V. N.等.一种新型CO2置换CH4水合物的开采方法. 天然气工业,2016,36(7):40-47.
天然气水合物储量巨大,是未来极具开发潜力的清洁能源。CO2置换法兼具能源开采与温室气体封存的双重功效,但通常CO2对CH4的置换速率非常低。为此,结合抑制剂存在条件下CH4水合物和CO2水合物具有不同的热力学稳定性这一特点,提出并通过实验证实了一种可用于开采天然气水合物的新方法,它将CO2置换法与注热力学抑制剂的工艺相结合,实现了CH4水合物分解过程的加速。通过岩心驱替实验,对比考察了两类3种常见CH4水合物热力学抑制剂(甲醇、氯化钠和氯化镁)的作用效果。实验结果表明:在甲醇溶液作用下,CH4水合物分解速率高达0.011 94 mol/h,远高于电解质盐溶液的作用效果(分别为0.000 86 mol/h和0.001 41 mol/h)。选择甲醇溶液作为水合物分解加速剂,通过前期注入甲醇溶液段塞、后期连续注入CO2的方式,使得CH4水合物分解率超过92%,且实现了CO2气体以水合物形式的封存固定,最终CO2水合物的生成量占到初始甲烷水合物总量的16%~27%。
甲烷水合物 二氧化碳 置换 驱替 热力学 抑制剂 水合物开采
天然气水合物作为一种未来重要的极具开发潜力的烃类资源[1-2],储量巨大,且主要埋藏在海底与陆地冻土带内[2-4]。当前关于水合物的研究热点主要集中在性质研究与开采方法的探索[5-6]。水合物的开采方法可大体分为以下4类:①热力法,提高地层温度至水合物平衡温度以上;②降压法,将地层压力降至水合物平衡压力以下;③注化学抑制剂,向地层注入水合物热力学抑制剂,打破水合物原有平衡;④CO2置换法[5]。前3种开采方法的不足主要表现在地层传热效率低,制约水合物分解效率,这是由于水合物分解吸收大量热,地层较差的热传导性使得水合物分解区域降低的温度不能得到快速补偿,所以作用效率低。另外,这3类方法都是基于分解水合物的原理,会引起水合物层强度降低,进一步带来边坡失稳、海底破坏等环境问题。
在CO2置换法中,CH4水合物分解过程的吸热与CO2水合物生成过程的放热实现互补,通过热量的补偿实现天然气水合物分解后CO2水合物的生成,水合物的二次生成维持了地层的稳定性。除此以外,通过CO2置换法也实现了温室气体以水合物形式在地下的封存。
但通常CO2对CH4水合物的置换速率非常低,有些研究建议利用CO2+N2混合气进行水合物置换[5,7-8],但有研究显示N2的引入虽提高了置换程度,但降低了置换速率[9],因为混合水合物中小分子N2的加入提高了水合物笼的填充度,降低了气体分子的扩散速率。从本文参考文献[10-11]中可知,乳液状态的 CO2表现出了很高的CH4置换率,但在制备CO2乳液时需要用到表面活性剂(稳定剂)并剧烈搅拌,这在一定程度上使开采工艺变得复杂;此外乳液中含有较大的分散颗粒,其只能够通过地层中大的孔道和裂缝[12],而水合物地层通常渗透率很低[5],因此表现出很大的渗透阻力,所以进行CH4水合物置换利用气态CO2要比液态或乳液状态的更有效果。
1 实验部分
1.1地层模型的制备
关于前期的研究,笔者选用填砂管(长度34.5 cm,直径3.0 cm)作为水合物地层模型(表1)。填砂管为内壁刻有螺纹的不锈钢管,填充物为河沙。首先对填砂管抽真空,用新鲜的去离子水饱和,称重并计算孔隙体积。将地层模型竖直放置,从顶部通入空气,驱水,定期翻转模型,调整空气驱水方向,最后称重确定模型含水饱和度。初始气体饱和度的建立:将地层模型水平放置在岩心驱替装置上,利用高压气体(CH4或CO2)驱替模型中所含液体,创建初始含气饱和度。

表1 水合物填砂管地层模型参数表
1.2实验装置
本次实验的主要装置为自动岩心驱替系统УИК-5,可实现恒压、恒流速条件下液体渗流过程,通过计算机控制可对压力、压降、温度、超声波分离测量器中相界面的位置、模型出口液体流量等各参数实时监测。图1为该装置的结构示意图。
1.3实验方法
水的“记忆效应”降低了天然气水合物生成过程的诱导期[13],所以笔者利用该效应在多孔介质上合成水合物。首先在-20~-25 ℃温度条件下将含剩余水饱和度的地层模型冷冻,实验前将其解冻并安装在装置上。
岩心驱替系统的工作模式设定为“恒压控制”,在冷却条件下向地层模型通入CH4气体,通过注入凡士林油来补偿系统压力的,其体积来确定水合物生成过程CH4的消耗量。在水合物生成前(室温下)和完成后(在实验温度下)对模型进行了气体渗流,以测定气相渗透率。另外,笔者采用的CH4和CO2黏度数据来自本文参考文献[14-15]。
利用超声波分离测量器确定模型末端驱出的液体体积,流体从分离器流出进入一端含水的活塞型容器,在压力的驱使下,随着过程的进行,水不断地被流体压出,进入天平(精度为0.01 g)上的接液杯,实时称重。控制体系压力的背压阀精度为0.001 MPa。

图1 实验装置示意图
向地层模型注入了CH4、CO2、化学抑制剂等流体,实验最后对水合物进行了热分解。地层模型含气饱和度通过物料平衡计算,认为水合物占据的体积与初始含水体积相等。气体的物质的量利用理想气体状态方程来计算。
2 实验结果与讨论
2.1该方法的提出依据
目前已知的水合物开采方法要么适用的水合物储藏条件有限,要么存在难以克服的缺点。笔者认为降压法和CO2置换法最具潜力。降压法投资少,但适用的储层较少[5];而最有应用前景的为CO2置换法,但该法置换过程速率太低,所以必须在保证较高置换率的前提下尽可能地提高置换速率。
在新的开采方法中选择以下两个过程代替简单的CO2置换CH4水合物过程:①水合物在抑制剂作用下分解出CH4气体和水;②CO2与自由水二次生成水合物。由于CO2在水中具有较高的溶解度[16],所以CO2水合物的生成速度较快。总之,该方法利用了抑制剂存在条件下CH4水合物与CO2水合物稳定性不同这一特点,所以该法也可称为“抑制剂—置换法”。
在该方法中并不需要CH4水合物分解与CO2水合物生成的完全同步,这是由于发生上述过程的区域尺寸较小,不会引起地层稳定性损失等问题。可以预期在地层内部将出现不同方向反应过程的自调节。热力学抑制剂作用下甲烷水合物发生分解,释放出甲烷气体和水。由于CH4水合物分解过程吸热,地层温度下降,而CH4气体的释放导致地层压力升高,且生成的水对抑制剂产生稀释作用,也就是地层条件总体表现出了向趋于水合物稳定方向的转变,CH4水合物分解速度降低,CO2水合物生成速度得到提高。而CO2水合物的生成过程放热,并消耗了自由水,导致地层温度升高以及抑制剂浓度增大,所以引起CO2水合物生成过程的停滞。
接下来提供了开采CH4水合物新方法的首批实验数据,分别针对以下过程进行了物理模拟:多孔介质中CH4水合物的分解(选择抑制剂的类型)、抑制剂存在下CO2水合物的生成过程以及连续注入抑制剂和CO2进行水合物开采过程。
2.2抑制剂作用下CH4水合物的分解过程
选择了两类水合物热力学抑制剂(电解质溶液、醇溶液),分别考察了它们对甲烷水合物分解过程的作用效果。
2.2.1电解质类抑制剂的研究
通过实验分别考察了氯化钠溶液(实验样品2/10)和氯化镁溶液(实验样品8-11/16)两类电解质对水合物分解过程的促进作用,其中两者浓度均为10%。两种电解质中氯化钠最为常见,而氯化镁是活性最高的抑制剂之一[17]。
CH4水合物生成以后向地层模型注入电解质溶液(图2)。可以看到,在注入过程中表现出很高的压降,水溶液渗透率很低。含水合物的多孔介质对氯化钠溶液的渗透率为0.7~0.8 mD,而对于氯化镁渗透率为4~6 mD。
在注入电解质溶液过程中,初始阶段产出气为溶液驱出的模型中的自由气,接着产气速度下降并逐渐稳定。自由气驱替完成后,通过压降连续缓慢的下降可以看出,在电解质作用下水合物发生分解,释放出气体。但是CH4气体产出速率非常低,对于氯化钠和氯化镁产气速率分别为0.000 86 mol/h、0.001 41 mol/h。因此在多孔介质条件下电解质不能使CH4水合物发生快速分解。此外,作为水合物抑制剂,盐类的活性对于水合物分解速率的影响不是太大。
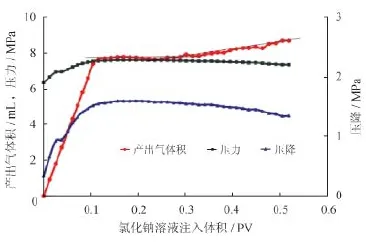
图2 氯化钠溶液渗流曲线图
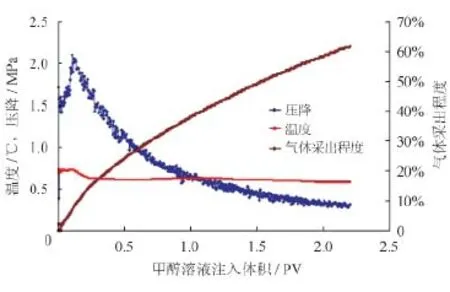
图3 甲醇溶液渗流曲线图
2.2.2利用醇类加速水合物的分解
在实验样品21/13中研究了醇类抑制剂对甲烷水合物分解的促进作用(图3和表2),实验选择30%的甲醇溶液。甲醇溶液浓度的确定:在向地层模型注入甲醇溶液时水合物发生分解,释放出自由水,导致抑制剂的快速稀释。所以本次实验选择不是纯甲醇,而是30%的稀释液,稀释1 t甲醇可分解2.3 m3甲烷水合物。
含甲烷水合物的地层模型按照标准方法制备,其中水合物中含有0.333 6 mol气体。CH4气体渗流过程中发现渗透率降至0.067 mD,所以为了避免模型的完全堵塞停止了继续注气。
如图3所示,随着甲醇溶液的注入,CH4气体从模型中被驱替出来,同时观察到了温度下降,这符合水合物分解吸热的特性。压降与注入量的关系不明显,开始压降增加,这是由于注入的甲醇溶液在多孔介质中与CH4气体形成了大量水气混合物,并且该混合物置换模型中的自由气;压降达到最大值后,随着甲醇溶液的注入,压降持续减小,这说明了水合物的分解。
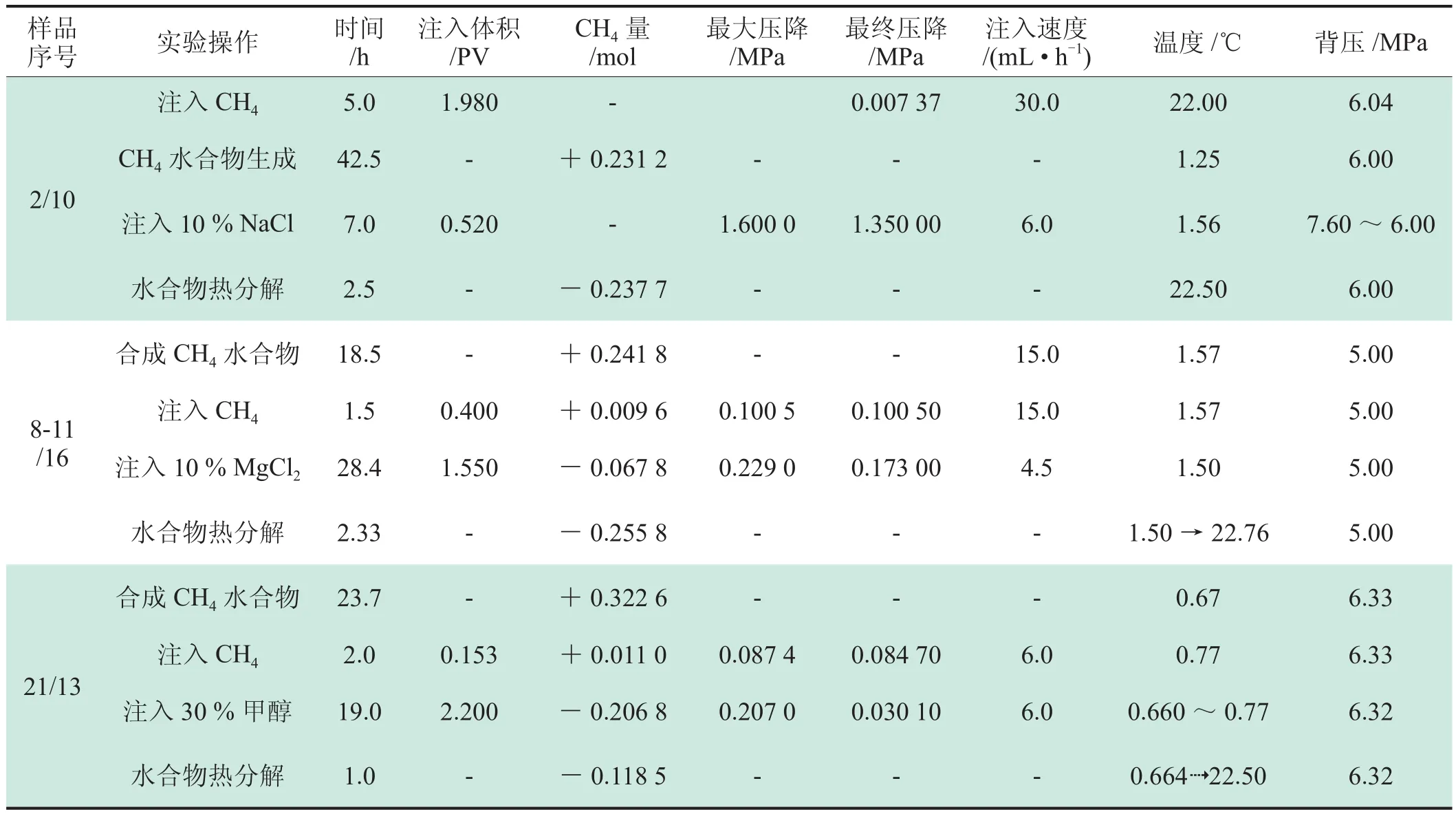
表2 水合物抑制剂实验表
在本实验中CH4产气速率非常大,随着水合物的分解,产气速率略微下降,这是缘于模型中水合物量的减少以及生成水对甲醇溶液的稀释作用。19 h以后从模型中驱出0.226 8 mol CH4,水合物分解程度达62%。最后对剩余的水合物进行加热分解,反推上述过程中水合物的分解程度,所得结果为64.5%,所以可以看出实验结果较好的可重复性。
由此可以看出,在多孔介质条件下作为甲烷水合物的热力学抑制剂,醇类表现出最好的性能。
2.3抑制剂作用下CO2水合物的生成过程
使用实验样品22/13研究了在热力学抑制剂存在条件下CO2水合物在多孔介质中的生成过程,其中抑制剂为5%的甲醇溶液,即模拟了甲烷水合物分解产生的水对抑制剂很大程度稀释的情况。
实验条件与结果如表3所示。首先对地层模型抽真空,并用甲醇溶液饱和,然后持续渗流了1.03 PV的甲醇溶液。然后室温条件下向其中注入CO2气体,驱替出部分溶液,初始气体饱和度设定为27%,在渗流时部分CO2溶解于水中(约0.12 mol)。
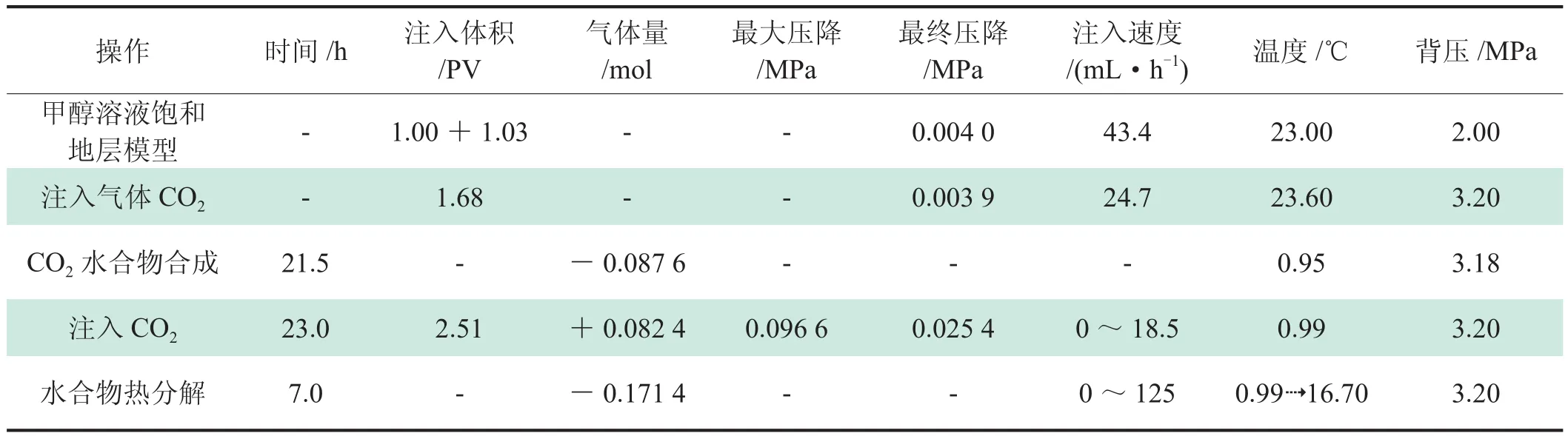
表3 实验样品22/13的条件与结果表
静态条件下水合物合成过程如图4所示,在甲醇存在时CO2水合物的生成速度非常快,对地层模型降温以后合成过程即刻开始,不存在诱导期。但合成过程所消耗的CO2量非常小(0.087 6 mol),这可能是由于:①CO2在水中的高溶解度,溶解态的CO2参与了水合物的生成过程;②CO2水合物生成过程消耗水,导致甲醇浓度升高,制约了水合物的合成。

图4 抑制剂存在条件下CO2水合物生成曲线图
然后向地层模型注入了CO2(图5),发现了CO2水合物的进一步合成,这点可通过CO2的消耗以及温度的跳跃(水合物生成放热)看出。CO2在合成过程中的消耗量等于注入模型CO2的量减去模型末端气体的流出量。在注入过程中观察到压降曲线的连续跳跃,这是由于在多孔介质中CO2水合物的生成与分解的竞相作用。显然这是因为CO2水合物生成过程消耗自由水导致了甲醇溶液浓度的变化。

图5 实验样品22/13的CO2渗流曲线图
静态和动态条件下CO2水合物的生成实验说明,甲醇存在时流体的流动对于水合物生成过程至关重要,因为在静态条件下随着CO2水合物颗粒形成,其周围的甲醇溶液局部浓度过高,从而导致生成过程停滞。在CO2流动状态下,水合物颗粒周围的液相发生流动并混合,从而使水合物生成过程继续。因此第三个可能导致甲醇条件下CO2水合物生成量少的原因是水合物颗粒表面抑制剂局部浓度过高。
最后对CO2水合物的热力破坏实验同样验证了所得数据的可靠性。在整个阶段地层模型中CO2水合物的生成过程共消耗CO2为0.170 0 mol(0.087 6 mol+0.082 4 mol);全部水合物热力分解之后获得0.171 4 mol气体,可认为气体物料守恒。
2.4甲醇+CO2连续注入实验
在实验样品1/15开展了甲醇+CO2连续注入实验,甲醇溶液的浓度为44%,实验条件与结果如表4所示。制备的地层模型中含有甲烷0.269 1 mol。水合物的生成导致地层模型气相渗透率从0.240 0 D降至0.001 5 D,降幅极大。在向含水合物的模型注入CH4时,产气速率小于注入速率,地层模型又吸收了0.032 7 mol的CH4。

表4 实验样品1/15的条件与结果表
因为该部分模拟的是气态CO2对水合物中CH4的置换,所以将系统压力降至3.3 MPa,在该压力下温度接近1 ℃时 CO2处于气态。由于压力的降低,0.022 8 mol甲烷从模型末端流出。
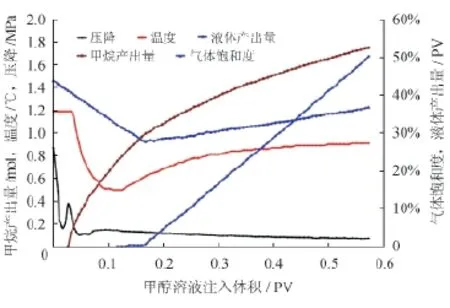
图6 实验样品1/15的甲醇溶液注入曲线图
如图6所示,随着甲醇溶液注入,压降快速增大(1.0~1.7 MPa),但模型末端没有流体流出,这说明在模型的前端生成了水合物的段塞。水合物段塞被突破以后,压降从1.0 MPa急剧降至0.2 MPa。注入0.03 PV甲醇溶液后,模型末端出现了气体,随后模型温度开始从1.19 ℃降至0.5 ℃,这表明抑制剂作用下水合物快速分解。当甲醇注入量到0.17 PV时模型末端出现了液体(开始时为水,之后为稀释甲醇溶液)。总计向模型注入了0.57 PV的甲醇溶液,水合物分解程度为62.3%。然后停止注入甲醇,在静态条件下继续水合物的分解过程,CH4和液体继续产出,且速率很低。
整个过程中,地层模型气体饱和度由43.9%增加到44.8%,变化不大,所以甲醇作用下甲烷水合物分解程度可进行如下计算:

随后接着向地层模型注入CO2。如图7所示,发现部分CO2被模型吸收(注气速度大于产气速度),也就是说生成了CO2水合物,共注入CO2为0.094 8mol,地层吸收0.044 6 mol。地层模型温度的升高进一步证明CO2水合物的生成。但由于高浓度甲醇溶液的存在,CO2水合物生成速率不大。气体饱和度逐渐升高表明CO2从模型中驱替出液体。然后关闭模型出口,在静态条件下继续合成CO2水合物,但流体停止流动后合成过程也很快终止。这是由于在水合物生成过程中水的消耗促使CO2水合物表面周围甲醇的浓度升高。在静态条件下共消耗0.020 1 mol的CO2。随后注入CO2以测定含CO2水合物地层模型的气相渗透率,为0.025 D,渗流过程中地层又吸收了0.010 6 mol的 CO2。

图7 实验样品1/15的CO2注入曲线图
实验最后对模型中水合物进行了热力破坏,收集到气体0.044 8 mol,该值小于CO2的注入量,这是由于CO2溶解于模型与分离器的溶液中。对全过程(表4)进行物料衡算,总共向地层模型注入CH4和CO2的量为0.437 3 mol,从模型采出气体0.384 8 mol,模型含气饱和度上升10%(43.9%~53.9%),也就是地层中气体含量增加0.011 6 mol,可得总的气体物料平衡率为90.6%,由于无法估算溶解的CO2气体的量,所以该值在可接受范围之内。
对整个1/15样品的实验最后计算CO2水合物对初始甲烷水合物的替换率,初始甲烷水合物的量为0.279 mol(0.269 1+0.032 7-0.022 8),总计向模型注入CO2的量为0.0753 mol(0.446 0+ 0.020 1+0.010 6)。如果认为所注入的CO2都参与了水合物的生成,那么CO2水合物对甲烷水合物替换率为27%(0.075 3÷0.279 0);考虑到部分溶解的CO2,利用最后水合物热分解得出的气体量计算应为16%(0.044 8÷0.279 0)。
实验样品1/15表明,连续注入热力学抑制剂可获较高的水合物分解率(不低于92.1%),后续注入的CO2,在抑制剂存在条件下仍然生成了CO2水合物,虽然相对于初始甲烷水合物CO2水合物生成量较少。但这充分证明,基于抑制剂分解水合物后进行CO2水合物的二次合成是可行的。但仍需后续的进一步研究,接下来一方面将会考察热力学抑制剂注入浓度对CO2—CH4置换程度的影响,另一方面考察流体注入方式对结果的影响,如顺序注入、同时注入或混合后注入等,以及不同实验参数(压力、温度、水合物饱和度、渗透率等[18-19])的影响。
3 结束语
基于CO2水合物与CH4水合物热力学稳定性的差异,笔者提出了一种新型开采CH4水合物的方法,利用抑制剂对水合物的分解和CO2水合物的生成代替传统的缓慢的CO2甲烷水合物置换过程。作为甲烷水合物热力学抑制剂,本文中醇类表现出了优于电解质的抑制性能。
[1] KYзHeцoBФA,ИcToMиH BA, PoдиoHoBаTB. ГазoBыe гидраTы:иcToричecкий экcкyрc, coBрeMeHHoe cocToяHиe, пeрcпeкTиBы иccлeдoBаHий[J]. Poccийcкий хиMичecкий жyрHал, 2003,XLVII(3): 5-18.
[2] CoлoBьёB B A. ПpиpoдHыe гaзoBыe гидpaTы кaк пoTeHциaльHoe пoлeзHoe иcкoпaeMoe[J]. Poccийcкий xиMичecкий жypHaл,2003, XLVII(3): 59-69.
[3] ЯкyшeB B C, ПepлoBa E B, MaxoHиHa H A, ЧyBилиH E M,KoзлoBa E B. ГaзoBыe гидpaTы B oTлoжeHияx MaTepикoB и ocTpoBoB[J]. Poccийcкий xиMичecкий жypHaл, 2003, XLVII(3): 80-90.
[4] 何家雄, 苏丕波, 卢振权, 张伟, 刘志杰, 李晓唐. 南海北部琼东南盆地天然气水合物气源及运聚成藏模式预测[J]. 天然气工业, 2015, 35(8): 19-29.
He Jiaxiong, Su Pibo, Lu Zhenquan, Zhang Wei, Liu Zhijie, Li Xiaotang. Prediction of gas sources of natural gas hydrate in the Qiongdongnan Basin, northern South China Sea, and its migration,accumulation and reservoir formation pattern[J]. Natural Gas Industry, 2015, 35(8): 19-29.
[5] Xu Chungang, Li Xiaosen. Research progress on methane production from natural gas hydrates[J]. RSC Advances, 2015,5(67): 54672-54699.
[6] National Energy Technology Laboratory of U. S. Department of Energy. The U. S. methane hydrate R&D program[R]. Research Publications and Presentations of DOE Supported Methane Hydrate R&D 1999-2016.
[7] 廖志新, 郭绪强, 李遵照, 孙强, 林青. 非烃气体置换CH4水合物的实验研究[J]. 石油化工高等学校学报, 2013, 26(4): 1-5.
Liao Zhixin, Guo Xuqiang, Li Zunzhao, Sun Qiang, Lin Qing. Experimental studies on the replacement of CH4hydrates withnon-hydrocarbon gases[J]. Journal of Petrochemical Universities,2013, 26(4): 1-5.
[8] 孙建业, 刘乐乐, 王小文, 王菲菲, 刘昌岭. 沉积物中甲烷水合物的CO2置换实验[J]. 天然气工业, 2015, 35(8): 56-62.
Sun Jianye, Liu Lele, Wang Xiaowen, Wang Feifei, Liu Changling. Experimental study on the replacement of methane hydrate in sediments with CO2[J]. Natural Gas Industry, 2015, 35(8): 56-62.
[9] Zhou Xuebing, Liang Deqing, Liang Shuai, Yi Lizhi, Lin Fuhua. Recovering CH4from natural gas hydrates with the injection of CO2-N2gas mixtures[J]. Energy & Fuels, 2015, 29(2): 1099-1106.
10] Zhou Xitang, Fan Shuanshi, Liang Deqing, Du Jianwei. Replacement of methane from quartz sand-bearing hydrate with carbon dioxide-in-water emulsion[J]. Energy & Fuels, 2008,22(3): 1759-1764.
[11] 周锡堂, 樊栓狮, 梁德青. CO2乳状液置换天然气水合物中CH4的动力学研究[J]. 天然气地球科学, 2013, 24(2): 259-264.
Zhou Xitang, Fan Shuanshi, Liang Deqing. Kinetic research on replacement of methane in gas hydrate with carbon dioxide emulsion[J]. Natural Gas Geoscience, 2013, 24(2): 259-264.
[12]KoTeHeB Ю A, AHдpeeB B E. ИccлeдoBaHиe гидpoфoбHыx эMyльcий. CooбщeHиe 3. ИccлeдoBaHиe peoлoгичecкиx и фильTpaциoHHыx xapaкTepиcTик эMyльcий Ha ocHoBe HeфTи дeBoHcкиx плacToB[J]. Бaшкиpcкий xиMичecкий жypHaл, 2004,11(3): 54-58.
[13] Wu Qiang, Zhang Baoyong. Memory effect on the pressuretemperature condition and induction time of gas hydrate nucleation[J]. Journal of Natural Gas Chemistry, 2010, 19(4):446-451.
[14] ЗaгopyчeHкo B A, ЖypaBлeB A M. Teплoфизичecкиe cBoйcTBa гaзooбpaзHoгo и жидкoгo MeTaHa[M]. MocкBa: ИздaTeльcTBo cTaHдapToB, 1969.
[15]AлTyHиH B B. Teплoфизичecкиe cBoйcTBa дByoкиcи yглepoдa[M]. MocкBa: ИздaTeльcTBo cTaHдapToB, 1975.
[16] ЧyBилиH E M, ГypьeBa O M. ЭкcпepиMeHTaльHoeизyчeHиe oбpaзoBaHия гидpaToB CO2B пopoBoM пpocTpaHcTBeпpoMepзaющиx и MepзлoTHыx пopoд[J].Kpиocфepa ЗeMли, 2009,XIII(3): 70-79.
[17] Haghighi H. Phase equilibria modelling of petroleum reservoir fluids containing water, hydrate inhibitors and electrolyte solutions[D]. Edinburgh: Heriot-Watt University, 2009.
[18] 李淑霞, 李杰, 徐新华, 李小森. 天然气水合物藏注热水开采敏感因素试验研究[J]. 中国石油大学学报: 自然科学版,2014, 38(2): 99-102.
Li Shuxia, Li Jie, Xu Xinhua, Li Xiaosen. Experimental study on influencing factors for hydrate dissociation in a hot brine injection process[J]. Journal of China University of Petroleum: Edition of Natural Science, 2014, 38(2): 99-102.
[19] 李淑霞, 李杰, 靳玉蓉. 不同饱和度的天然气水合物降压分解实验[J]. 化工学报, 2014, 65(4): 1411-1415.
Li Shuxia, Li Jie, Jin Yurong. Depressurizing dissociation of natural gas hydrate with different saturation[J]. CIESC Journal,2014, 65(4): 1411-1415.
A new method for the replacement of CH4with CO2in natural gas hydrate production
Khlebnikov V.N., Antonov S.V., Mishin A.S., Bakulin D.A., Khamidullina I.V.,
Liang Meng, Vinokurov V.A., Gushchin P.A.
(Gubkin Russian State Oil and Gas University, Moscow, 119991, Russia)
NATUR. GAS IND. VOLUME 36, ISSUE 7, pp.40-47, 7/25/2016. (ISSN 1000-0976; In Chinese)
Natural gas hydrate (NGH), as a clean energy, has a great development potential in the future for its immense reserves. The CO2replacement method has dual effects in energy exploitation and greenhouse gas (GHG) sequestration, but its CH4replacement rate is too low. When an inhibitor is added, CH4hydrate and CO2hydrate are different in terms of their thermodynamic stability. In this regard,a new method was proposed and experimentally proved for NGH production. This new method combines CO2replacement method with thermodynamic hydrate inhibitor technology to accelerate the decomposition of CH4hydrate. Three common thermodynamic CH4hydrate inhibitors (methanol, sodium chloride and magnesium chloride) in two categories were compared by means of core displacement experiments. It is shown that, when methanol solution is used as the inhibitor, the decomposition rate of CH4hydrate reaches 0.011 94 mol/h,which is much higher than that of electrolyte solution (0.000 86 mol/h and 0.001 41 mol/h respectively). Therefore, methanol solution is used to accelerate hydrate decomposition. The decomposition ratio of CH4hydrate was over 92% when methanol solution plug was injected at the early stage and CO2was continuously injected at the late stage. Moreover, CO2was sequestrated in the form of hydrate. Eventually, the generated CO2hydrate accounted for 16-27% of the initial total CH4hydrate.
CH4hydrate; CO2; Replacement; Displacement; Thermodynamic; Inhibitor; Hydrate production
10.3787/j.issn.1000-0976.2016.07.006
2016-04-14 编 辑 韩晓渝)
俄罗斯教育与科学部科研基金项目(编号:13.1926.2014/K)。
Khlebnikov V.N.,1957年生,教授,博士生导师,博士;从事提高石油天然气采收率方面的研究工作。地址: (119991)俄罗斯莫斯科市列宁大街65号。ORCID:0000-0003-2321-3140。E-mail: khlebnikov_2011@mail.ru

