半夏组织培养及其生物碱代谢调控的研究
刘永红,杨渊华,梁宗锁
(1.西安职业技术学院,a.生物工程系;b.党委组织部,西安 710077;2浙江理工大学生命科学学院浙江省植物次生代谢与调控重点实验室,杭州 310018)
半夏组织培养及其生物碱代谢调控的研究
刘永红1a,杨渊华1b,梁宗锁2
(1.西安职业技术学院,a.生物工程系;b.党委组织部,西安 710077;2浙江理工大学生命科学学院浙江省植物次生代谢与调控重点实验室,杭州 310018)
以野生半夏块茎为外植体,研究不同植物生长调节剂组合对半夏愈伤组织诱导的影响,发现MS添加0.3 mg/L Kin和1.0 mg/L IBA的培养基上可诱导出分化出芽点和根的愈伤组织;MS添加0.3 mg/L NAA和1.5 mg/L 6-BA的培养基中外植体直接分化为小块茎。小块茎接种于无植物生长调节剂的MS液体培养基中振荡悬浮培养6周,逐渐抽叶长根成为半夏组培苗。比较愈伤组织、小块茎、组培苗及野生块茎的生物碱含量及显微结构,发现愈伤组织的分化程度低于半夏野生块茎及组培小块茎,但生物碱含量却高于二者,分别为0.0205 、0.0189、0.0161 g/g。为消除植物生长调节剂对次生代谢产物积累的不确定影响,可建立一种高度分化、经济、稳定的体系——无植物生长调节剂的半夏组培苗悬浮培养体系,为进一步的半夏生物碱代谢调控提供模式材料。
半夏;愈伤组织;组培苗;生物碱;代谢调控
0 引 言
半夏(Pinelliaternata(Thunb.) Breit.)又名地文、水玉(《本经》),守田、示姑(《别录》),羊眼半夏(《唐本草》),是天南星科多年生草本植物。植株生3小叶的复叶,基部有珠芽,佛焰苞绿色,浆果卵状椭圆形,全国大部分地区都有分布[1]。通常以干燥块茎入药,是一种常用大宗药材。半夏所含化学成分的种类较多,但其含量都不高。已检测分离到的半夏化学成分有生物碱、葡萄糖苷、半夏淀粉、甾醇类、氨基酸、挥发油、芳香族成分、有机酸类、黄酮类、半夏蛋白、鞣质以及多种微量元素等[2]。生物碱是半夏药理作用的主要成分之一,具有镇吐痛,抗心律失常,抗坏血栓,抗肿瘤、抗菌、抗氧化以及糖苷酶抑制等作用[3]。
随着野生半夏资源的减少,人工栽培半夏病毒感染导致的产量和品质下降,通过半夏组织培养技术生产脱毒苗和人工种子的研究多见报道[4-6]。而关于半夏组织培养中不同分化程度的愈伤组织、小块茎、组培苗的诱导,以及以半夏组培苗悬浮培养体系研究活性成分的次生代谢调控途径少见报道。一般情况下,研究植物次生代谢调控的材料为盆栽植物或离体植物组织及细胞培养,前者易受环境影响,后者由于分化程度偏低而次生代谢物含量不高[7]。本试验探究了半夏不同分化程度组培诱导物,如愈伤组织、小块茎、组培苗的诱导条件以及小块茎的继代、增殖分化情况,在此基础上,尝试了无植物生长调节剂的半夏组培苗培养体系的建立,并比较了半夏组培物及野生半夏的生物碱含量,以期建立一种不受植物生长调节剂干扰的、经济可行的、高度分化的代谢调控模式体系——无植物生长调节剂的半夏组培苗悬浮培养体系。
1 材料与方法
1.1材料
半夏采自陕西太白山大峪口野生半夏,经西安职业技术学院植物学教研团队通过形态鉴定、显微鉴定及与标本对照,鉴定为天南星科(Araceae)半夏属(Pinellia)植物三叶半夏(Pinelliaternata(Thunb.) Breit.)。
1.2基本培养条件
MS基本培养基,添加30 g/L蔗糖和6 g/L的琼脂,pH值为5.8,植物生长调节剂6-BA、2,4-D、IBA、NAA、Kin以不同配比添加。配好的培养基每100 mL 三角烧瓶中分装25 mL左右,121 ℃高压灭菌20 min。培养温度(25±2) ℃,每天12 h光照12 h黑暗,光照强度2000~3000 lx。
1.3植物生长调节剂对愈伤组织诱导的影响
半夏野生块茎流水冲洗30 min,剥除表皮,用70%的酒精浸泡1 min , 无菌水冲洗后再用0.1% HgCl2溶液浸泡13 min, 无菌水冲洗后, 用灭菌的刀片切成0.5 ~ 0.8 cm3的方块,接入以下不同MS培养基中:a) 0.3 mg/L 2,4-D + 2.5 mg/L Kin ; b) 0.3 mg/L 2,4-D + 2.5 mg/L 6-BA ; c) 0.5 mg/L Kin + 0.5 mg/L NAA ; d) 0.3 mg/L Kin + 1.0 mg/L IBA; e) 0.3 mg/L NAA + 1.5 mg/L 6-BA;f) 野生半夏样品。每处理重复3次,培养2月后观察结果。诱导出的组织培养物在相应的培养基上增殖培养。
1.4小块茎的诱导和继代培养
消毒的野生半夏块茎,接种于g) MS + 0.3 mg/L NAA + 1.5 mg/L 6-BA培养基中,培养6周后,诱导出半夏无菌苗(编号h)。将无菌苗的叶片叶柄分别切成约1.0 cm2或1.0 cm的大小,接入i) MS +0.3 mg/L NAA + 1.2 mg/L 6-BA培养基中,每瓶接种叶片叶柄外植体5个,培养40 d后观察结果。小块茎的继代培养在以下培养基中进行:j) MS不添加植物生长调节剂; k) MS + 0.5 mg/L NAA ;l) MS + 1.0 mg/L ABA; 组培小块茎的生长速率(GR)、分化情况(DR)按文献[8]方法计算。
1.5组培苗的诱导和液体悬浮培养
将在MS无植物生长调节剂固体培养基上继代培养的小块茎接种于无植物生长调节剂的MS液体培养基中。于超净工作台上每(4.00±0.5) g小块茎接入含130 mL MS液体培养基的250 mL三角瓶中,置于28 ℃下震荡(120 r/min)培养,5星期后小块茎逐渐抽叶长根成为半夏组培苗(编号m、 n),计算半夏组培苗的平均生长量。
1.6愈伤组织、栽培块茎、组培块茎显微结构比较
MS添加0.3 mg/L Kin和1.0 mg/L IBA培养基上诱导增殖的愈伤组织(编号d)、MS不添加植物生长调节剂培养基上继代培养的小块茎、野生半夏块茎,分别用徒手切片法[9]制成临时切片,观察其显微结构。
1.7半夏培养物总生物碱的检测
半夏野生块茎,组培小块茎、愈伤组织、组培苗收获后,烘干,粉碎,采用酸性染料比色法测定总生物碱的含量[10]。实验重复3次,取平均值。
2 结果与分析
2.1不同生长调节剂组合对半夏愈伤组织诱导的影响
5种不同植物生长调节剂组合的培养基上,半夏块茎外植体的分化状态不同。诱导出不同生理状态的愈伤组织和器官,MS添加0.3 mg/L 2,4-D和2.5 mg/L Kin的培养基中,外植体膨大不明显,脱分化为白色愈伤组织;用同浓度的6-BA代替Kin,外植体脱分化为绿色的愈伤组织,其上可看到少量芽点;MS添加0.5 mg/L Kin和0.5 mg/L NAA的培养基中,外植体膨大为疏松带根愈伤组织;用较高浓度的IBA代替NAA时,外植体脱分化的愈伤组织长有较多芽点及根;MS添加0.3 mg/L NAA和1.5 mg/L 6-BA的培养基中,外植体直接分化为小块茎;可以看出,组培小块茎的形态类似于野生半夏块茎(图1)。外植体在添加不同植物生长调节剂的培养基上诱导进程如表1所示。

表1 不同生长调节剂组合对半夏愈伤组织和器官诱导的影响
注:外植体培养50 d后观察结果。

图1 不同培养基上半夏愈伤组织和分化器官的诱导情况
2.2半夏小块茎的诱导和增殖分化
半夏块茎接种在添加0.3 mg/L NAA和1.5 mg/L 6-BA的MS培养基中培养,可诱导出半夏无菌苗。以无菌苗的叶片和叶柄为外植体,在MS 添加0.3 mg/L NAA和1.2 mg/L 6-BA的培养基中,可诱导出半夏小块茎,小块茎继代培养于MS不添加植物生长调节剂的培养基中,可较长时间维持在小块茎的状态。添加NAA的培养基上,小块茎生出较多的根;添加ABA的培养基上,从小块茎上可长出二级、三级小块茎,如图2所示。当添加NAA和ABA后,半夏小块茎的生长速率较不添加要高,成苗比率有所降低(表2)。
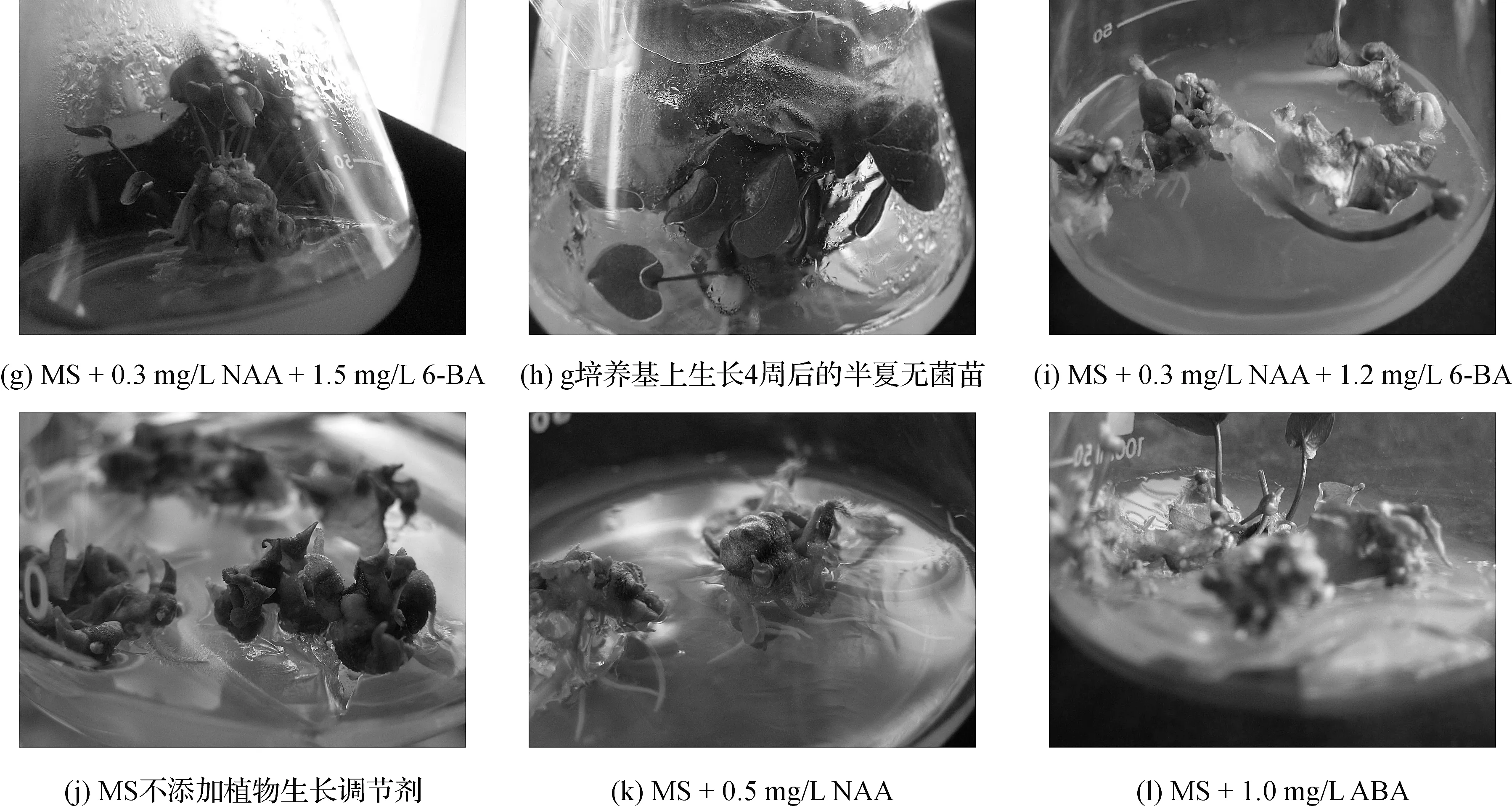
图2 半夏小块茎的诱导和增殖分化情况
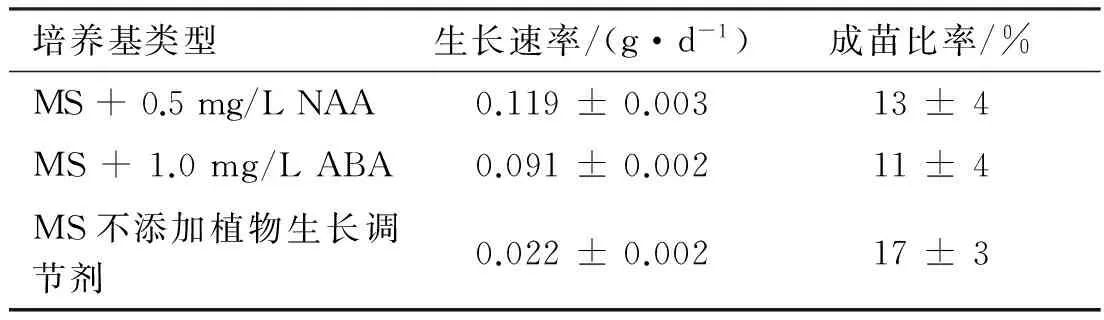
培养基类型生长速率/(g·d-1)成苗比率/%MS+0.5mg/LNAA0.119±0.00313±4MS+1.0mg/LABA0.091±0.00211±4MS不添加植物生长调节剂0.022±0.00217±3
注:实验重复3次,实验结果以平均值±标准偏差表示。
2.3组培苗的诱导和液体悬浮培养生长曲线
将在MS无植物生长调节剂培养基上继代培养的小块茎接种于无植物生长调节剂的MS液体培养基中振荡悬浮培养6周,逐渐抽叶长根成为半夏组培苗。如图3所示。

图3 组培苗的诱导和液体悬浮培养
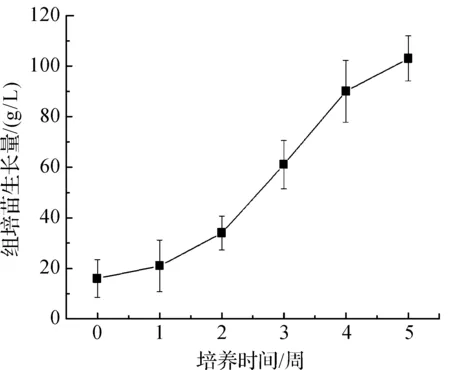
图4 半夏小块茎组培苗在MS无植物生长调节剂的液体培养基中的生长曲线
组培小块茎刚接入液体培养基时,增殖缓慢,可能是从固体培养转入液体悬浮培养的一个适应期,从第6 d开始,生长加速,开始抽芽长根,随后逐渐长成为组培小苗,并在原有小块茎的基础上增殖出新的小块茎,小块茎组培苗的液体悬浮培养生长曲线如图4所示。
2.4愈伤组织、组培苗小块茎、栽培块茎显微结构比较
在MS添加0.3 mg/L Kin和1.0 mg/L IBA培养基上诱导增殖的愈伤组织(d),悬浮培养的组培苗块茎,半夏野生块茎的显微结构如图5所示。可以看出,半夏愈伤组织的结构疏松而分化程度较低,电子显微镜下观察到的是细胞团。组培小块茎的结构相对致密些,已分化出表皮组织和基本组织。而野生块茎的结构高度分化,可观察到表皮,皮层和基本组织等。在组培苗小块茎和栽培块茎的细胞内都观察到一些细胞后含物,推测可能是淀粉粒。

图5 愈伤组织d、组培苗小块茎、野生块茎显微结构比较
2.5野生块茎、愈伤组织、小块茎和组培苗总生物碱含量的比较
采用酸性染料比色法测定了半夏野生块茎、愈伤组织、组培小块茎、组培苗的生物碱含量,发现在MS添加0.3 mg/L Kin和1.0 mg/L IBA培养基上诱导增殖的愈伤组织(d)生物碱含量最高,为0.0205 g/g ;野生块茎的生物碱含量高于组培小块茎和组培苗;而半夏组培苗的生物碱含量又高于组培小块茎,分别为 0.0177 g/g和 0.0161 g/g(图6)。
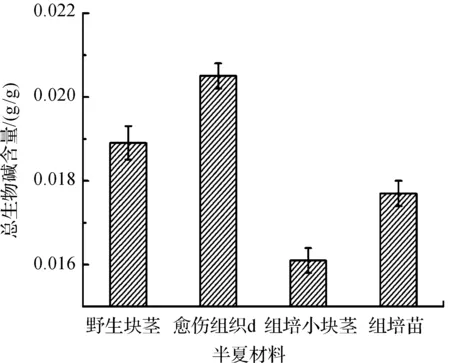
图6 半夏组培诱导物和栽培块茎的总生物碱含量比较
3 讨 论
不同植物生长调节剂组合对半夏组培诱导物的形态发生状况有显著影响。添加2,4-D和Kin,外植体易愈伤化;添加NAA和IBA,外植体愈伤化的同时会产生根;添加6-BA,外植体易分化出芽状结构,这可能和这些植物生长调节剂能促进细胞分裂和分化、诱导根原基和芽原基形成、及其浓度相对比值的高低有关[11]。本实验选用的5种植物生长调节剂组合诱导出不同形态特征的组织培养物,为后续不同的研究方向—细胞悬浮培养、芽、根、组培苗等器官悬浮培养打下基础。
据报道,ABA主要用于抑制种子的萌发[12],ABA作为生长抑制剂用于半夏小块茎,其抑制小块茎发芽的同时,促进母体小块茎上不断增殖出次级小块茎[13]。在小块茎悬浮培养时可添加ABA提高小块茎的产量,但添加ABA用于实际生产的成本比较高;据报道半夏生物碱主要集中于块茎及其根的表皮中[14],因此推测半夏长根组培苗的生物碱含量高于无根小块茎。半夏小块茎无植物生长调节剂悬浮培养时,易抽芽长根成为半夏组培苗,检测发现半夏组培苗悬浮培养体系的生物碱含量高于小块茎悬浮培养体系,这表明组半夏培苗培养体系不仅方便经济,而且更适宜生物碱的生产。
形态特征及显微结构观察表明,野生块茎的分化程度高于组培小块茎,两者都可观察到分化的表皮和基本组织,基本组织的细胞中贮藏有后含物淀粉粒;愈伤组织的分化程度最低,只看到一些细胞团,无淀粉粒。而生物碱含量检测结果表明愈伤组织的生物碱含量最高,高于野生块茎、组培苗和组培小块茎,推测这可能和植物生长调节剂的应用有关——愈伤组培继代培养于含植物生长调节剂的培养基中,而小块茎和组培苗继代于无植物生长调节剂的培养基中。关于植物生长调节剂对次生代谢产物积累的报道各有说法[15-17],推测植物生长调节剂的添加提高了半夏生物碱代谢途径中关键酶的比活力,从而促进了生物碱的合成代谢[18]。本实验中,探讨了无植物生长调节剂的组培物继代及悬浮培养环境,以消除植物生长调节剂对次生代谢产物积累的不确定影响,为进一步建立一个相对稳定的次生代谢调控模式体系打下基础。
[1] 罗睿,杜禹珊,孙莹莹,等.半夏珠芽发育过程的形态学和解剖学研究[J].西北植物学报,2014,34(9):1776-1781.
[2] 毛其芬,刘文洪,金航,等.半夏内生菌的分离及抗菌活性筛选[J].中华中医药学刊,2014,32(8):1838-1841.
[3] 龚道锋,王匍成,纪东汉,等.中国半夏化学成分及其药理、毒理活性研究进展[J].长江大学学报(自科版),2015,12(18):77-79.
[4] 孙燕,傅袭平,余乐,等.泰半夏小块茎的诱导及工厂化育苗技术研究[J].江苏农业科学,2014,42(12):67-68.
[5] 陈红艳,陈崇果,张领,等.半夏试管苗生产脱毒微型种茎技术的研究[J].湖南农业科学,2015,11(8):33-36.
[6] 淘米林,刘清波,黄红梅.半夏组织培养体系的建立[J].北方园艺,2013,1(4):113-117.
[7] LIU Y H, LIANG Z S, LIU J L. Use of protocorm-like bodies for studying alkaloid metabolism inPinelliaternata[J].Plant Cell, Tissue and Organ Culture,2010,100:83-89.
[8] 薛建平,朱艳芳,张爱民,等.半夏试管块茎直接再生技术的研究[J].作物学报,2004,30(10):1060-1064.
[9] 李正理.植物制片技术[M].北京:北京大学出版社,1996:27-31.
[10] 徐保宁,时银英,侯延辉,等.宁夏六盘山地区种植半夏有效成分含量的比较[J].宁夏医学杂志,2013,35(12):1262-1264.
[11] 关继东.园林植物生长发育与环境[M].北京:科学出版社,2009:107-120.
[12] 邓志军,宋松泉.ABA对黑黄檀种子萌发的抑制作用及其他植物激素对ABA的拮抗作用[J].云南植物研究,2008,30(4):440-446.
[13] 刘永红,梁宗锁,杨东风,等.半夏小块茎悬浮培养及其生物碱类化合物的测定[J].西北农林科技大学学报,2009,37(11):168-174.
[14] 孟祥海.光照强度、6-BA、GA3对半夏生长发育与有效成分含量的影响研究[D].杨凌:西北农林科技大学,2007.
[15] ZHAO J, ZHU W H, HU Q. Effects of light and plant growth regulators on the biosynthesis of vindoline and other indole alkaloids inCatharanthusroseuscallus cultures[J]. Plant Growth Regulator,2001,33:43-49.
[16] DIAS ACP, SEABRA RM, ANDRADE PB. Xanthone biosynthesis and accumulation in calli and suspended cells ofHypericumandrosaemum[J]. Plant Science,2000,150:93-101.
[17] RHODES MJC, PARR AJ, GIULIETTI A. Influence of exogenous hormones on the growth and secondary metabolite formation in transformed root culture[J]. Plant Cell Tissue Organ Culture,1994,38:143-151.
[18] 刘永红.半夏细胞及块茎悬浮培养体系的建立及主要生物碱的代谢调控研究[D].杨凌:西北农林科技大学,2010.
(责任编辑: 许惠儿)
Study on Tissue Culture ofPinelliaTernataand Metabolism Regulation ofPinelliaAlkaloids
LIUYonghong1a,YANGYuanhua1b,LIANGZongsuo2
(1a. Department of Bioengineering; 1b. the Party Committee Organization Department, Xi’an Vocational and Technical College, Xi’an 710077, China; 2. Key Laboratory of Plant Secondary Metabolism and Regulation of Zhejiang Province, School of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Tubers of wildPinelliaternata(P.ternata) were used to study the effect of different combination of plant growth regulators (PGRs) on induction ofPinelliaternatacalli. It is found that calli of buds and roots can be induced in the MS culture medium in which 0.3 mg/L Kin and 1.0 mg/L IBA are added; in the MS culture medium in which 0.3 mg/L NAA and 1.5 mg/L 6-BA are added, PLBs were induced without the formation of calli. PLBs were inoculated in MS liquid medium without PGRs, and turned intoPinelliaseedlings about 6 weeks later. Alkaloid content and microstructure of calli, PLBs, seedlings, and wild tubers were compared. It is found that differentiation rate of calli is lower than that of wild tubers and PLBs, whereas alkaloid content of calli is higher than that of wild tubers and PLBs. Alkaloid contents of calli, wild tubers and PLBs are 0.0205, 0.0189, and 0.0161 g/g, respectively. To eliminate uncertain effect of PGRs on metabolite synthesis, a highly differentiated, cheap, and stable system: free-PGR suspension cultures ofP.ternatais set up to further offer mode materials for alkaloid metabolism regulation ofP.ternata.
Pinelliaternata; calli; seedlings; alkaloids; metabolism regulation
10.3969/j.issn.1673-3851.2016.09.021
2016-03-18
陕西省教育厅科研计划项目(15JK2159)
刘永红(1974-),女,陕西宝鸡人,讲师,博士,主要从事药用植物学方面的研究。
梁宗锁,E-mail:liangzs@ms.iswc.ac.cn
R932
A
1673- 3851 (2016) 05- 0759- 06 引用页码: 090703

