球形碳酸钙/羟基磷灰石的制备及药物控释
钟奇伟,蔡玉荣
(浙江理工大学材料与纺织学院,杭州 310018)
球形碳酸钙/羟基磷灰石的制备及药物控释
钟奇伟,蔡玉荣
(浙江理工大学材料与纺织学院,杭州 310018)
丝胶蛋白调控得到尺寸均一的球形碳酸钙颗粒,并以此为硬模板,辅以水热,制备羟基磷灰石微球。以盐酸阿霉素为药物模型,用合成的碳酸钙、羟基磷灰石球形颗粒对其分别进行有效负载和可控释放研究,并用体外实验评价载药颗粒对共培养细胞的影响。用场发射扫描电子显微镜(FE-SEM)、傅里叶红外吸收光谱(FT-IR)、X射线粉末衍射(XRD)、紫外分光光度计和荧光显微镜等对样品进行了检测。结果表明:丝胶有利于碳酸钙球霰石相的稳定,同时通过离子交换反应可将碳酸钙转化为羟基磷灰石,碳酸钙和羟基磷灰石对盐酸阿霉素最佳负载浓度分别为8 μg/mL和10 μg/mL,羟基磷灰石对药物的控制释放能力更强。体外Huh-7肝癌细胞实验表明载药颗粒对细胞的增殖有明显抑制作用,证明所制颗粒的药物负载和释放功能。
碳酸钙;羟基磷灰石;药物载体;负载及释放
0 引 言
骨组织工程[1]在治愈骨缺损时可以避免传统骨移植存在的供体有限,复杂手术和免疫排斥反应等问题[2-3],因此得到广泛的研究。理想的支架材料不仅需要提供细胞黏附、增殖、分化的临时场所,而且有对生长因子的强吸附能力。目前研究较多的支架材料主要有生物活性玻璃[4]、磷酸钙骨水泥[5]、可注射水凝胶[6]等。
羟基磷灰石(HAP)是脊椎动物天然骨和牙齿的主要无机成分,因此具有良好的生物相容性和骨传导性[7],在骨组织工程中常被用作支架材料。同时,羟基磷灰石具有强吸附性,应用在催化、重金属吸附和药物缓释等领域[8-10]。Kasuya等[11]发现羟基磷灰石和不同浓度的明胶(10%~15%)在动物体内实验中表现出优异的机械能力和生物降解性,并能促进新骨的生成。Jun等[12]将骨形态发生蛋白-2负载在多孔羟基磷灰石上,在生长因子逐步释放下促进了新骨形成。
本实验利用丝胶蛋白作为有机调控剂,制备了尺寸均一的球形碳酸钙颗粒,并以此为硬模板,水热法合成多孔羟基磷灰石微球。盐酸阿霉素是一种高效抗癌药,利用碳酸钙和羟基磷灰石微球对盐酸阿霉素的负载和释放,与Huh-7肝癌细胞的共培养表征两种载体材料的药物控释能力。
1 实 验
1.1实验试剂
丝胶蛋白(分子量≈8000Da)来自湖州奥特丝生物化工有限公司;无水氯化钙(CaCl2)、无水碳酸钠(Na2CO3)、氢氧化钠(NaOH)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、浓盐酸(HCl)、磷酸氢二钾(K2HPO4)、氯化镁(MgCl2)、磷酸二氢钾(KH2PO4)、无水乙醇等试剂均为分析纯,Dio染色液、CCK-8试剂盒等购于杭州米克化工仪器有限公司;盐酸阿霉素购于Sigma公司;肝癌Huh-7细胞为实验室冻存的细胞。
1.2碳酸钙微球的制备
室温条件下,将0.2 M的CaCl2溶液缓慢滴加到2 g/L的丝胶蛋白溶液中,磁力搅拌混合均匀,用1 M的NaOH溶液调节溶液pH至7。接着加入0.2 M的Na2CO3溶液,40 ℃水浴机械搅拌180 min。反应结束后,将白色悬浊液用0.22 μm的滤纸抽滤,将所得滤饼用无水乙醇和去离子水各洗3次,最后将滤饼放入60 ℃烘箱中干燥48 h。
1.3羟基磷灰石微球的制备
准确称取5 g Na2HPO4·12H2O溶解于15 mL去离子水,完全溶解后用1 M NaOH调节溶液pH至9.5。然后加入0.5 g球形碳酸钙颗粒,磁力搅拌并超声30 min,形成悬浊液后置于聚四氟乙烯反应釜中,在140 ℃烘箱中分别反应2、4、8、16 h。反应完成后,产物用0.22 μm的滤纸抽滤,将所得滤饼用无水乙醇和去离子水各洗3次,最后将滤饼放入60 ℃烘箱中干燥48 h。
1.4碳酸钙和羟基磷灰石微球对盐酸阿霉素的负载
取浓度为10 μg/mL的盐酸阿霉素溶液20 mL,加入10 mg 碳酸钙颗粒,37 ℃水浴,110 r/min震荡速率下保持24 h。负载完成后,将悬浊液高速离心,收集上清液,利用紫外可见分光光度计对上清液检测,差值法计算颗粒上负载上的盐酸阿霉素的量,用Origin软件作图,得出两种颗粒对药物的最佳负载浓度,实验设置3个平行样。羟基磷灰石负载实验方法和碳酸钙相同。
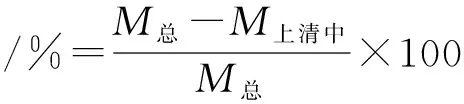
(1)
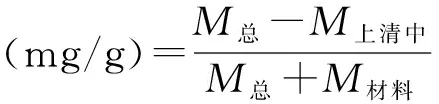
(2)
其中M总表示加入的总药量;M上清中表示在离心后在上清中的残余药量;M材料表示载体材料的质量[13]。
1.5载药碳酸钙和羟基磷灰石微球的体外释放
将载有盐酸阿霉素的颗粒20 mg分散在40 mL的0.01 M PBS缓冲液中,37℃水浴,110 r/min震荡速率下保持24 h。在规定的时间内取出样品,在8000 r/min下离心15 min,吸取0.6 mL上清液用紫外分光光度计测定上清液中盐酸阿霉素的含量,然后补充0.6 mL的PBS。用Origin软件统计药物累积释放量。每个样品设置3组平行样。
1.6载药碳酸钙和羟基磷灰石微球体外细胞实验
将碳酸钙和羟基磷灰石微球用紫外线照射48 h灭菌。然后准确称取两种载药颗粒各10 mg分别均匀平铺到48孔板底部。加入处于对数生长期的Huh-7细胞悬浊液,并补加新鲜完全培养基至每孔细胞浓度为1.5×104cell/mL,实验空白对照组为不加颗粒的情况下培养,每组实验设置3个平行样。用DiO细胞染色剂和CCK-8试剂盒表征。
DiO是一种亲脂性膜染料,进入细胞膜后可以侧向扩散逐渐使整个细胞的细胞膜被染色,在倒置荧光显微镜下可以直观的观察到细胞的形态和数量。
CCK-8试剂盒是一种基于WST-8的快速高灵敏度的试剂盒,主要用于细胞增殖及细胞毒性的检测。就同一种细胞而言,其颜色深浅程度与细胞数量成线性关系,颜色越深,说明细胞的数量越多,材料毒性越小。
1.7材料表征
样品分析:Hitachi公司 S4800场发射扫描电镜分析,Thermo Electron 公司XTRA型X射线粉末衍射仪分析,Thermo Electron的Nicolet 5700型傅里叶变换红外光谱,Hitachi公司的U-2900型紫外分光光度计,Bio-Rad公司的680行酶标仪和日本Nikon公司的C2型激光共聚焦显微镜。
2 结果与分析
2.1碳酸钙微球表征


图1 碳酸钙微球表征
2.2羟基磷灰石微球的表征
如图2所示,随着反应时间从2 h增加到16 h,颗粒始终保持良好的球形度,尺寸分布在5 μm左右。随着反应时间的增加,微球表面的粗糙程度增加,由致密变成疏松多孔状, 16 h时微球表面变得凹凸不平。因此,高温高压下延长水热反应时间可以增加羟基磷灰石表面粗糙度,增大比表面积。
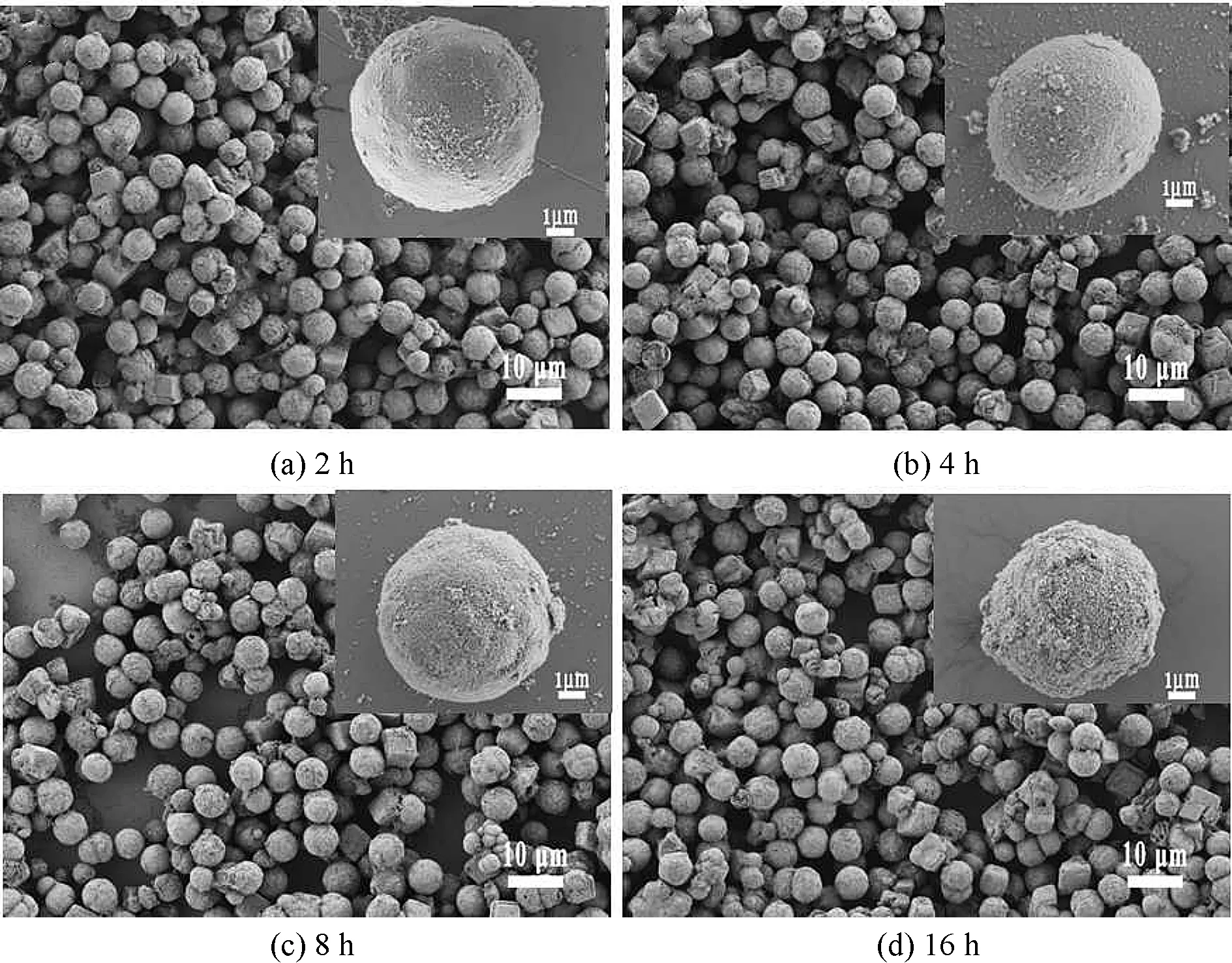
图2 不同水热时间下制备的羟基磷灰石微球FE-SEM图
图3 不同水热时间下制备的羟基磷灰石微球
2.3药物在碳酸钙和羟基磷灰石微球上的负载行为
图4为盐酸阿霉素在300~650 nm的波长范围内的吸光度分布曲线,可知药物的最大吸收波长为480 nm。然后分别配制一系列不同浓度的盐酸阿霉素溶液,测定其在480 nm下的吸光度值,计算得到标准工作曲线方程为Y=0.01987X-0.00129,R2=0.99903。
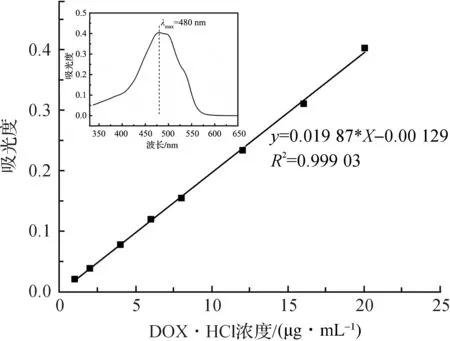
图4 盐酸阿霉素标准工作曲线
在骨修复治疗中,使用的药物高效但昂贵,必须要提高药物的有效使用率,所以定量研究载体材料的吸附能力十分必要。载药量和载药能力是评价载体材料负载能力的两大指标。如图5所示,对于10 mg的碳酸钙颗粒,当盐酸阿霉素的浓度从1 μg/mL增加到20 μg/mL时,载药量从95%左右快速降至25%。同时,药物浓度从1 μg/mL增加到8 μg/mL时,载药能力直线式上升。浓度继续增加到20 μg/mL时,载药能力逐渐处于定值。综合载药能力和载药量,10 mg的碳酸钙负载8 μg/mL盐酸阿霉素是最高效的。

图5 盐酸阿霉素的浓度对碳酸钙药物载药量和载药能力的影响
如图6所示,对于10 mg的羟基磷灰石颗粒,当盐酸阿霉素的浓度从1 μg/mL增至10 μg/mL时,羟基磷灰石微球载药量保持在90%以上,缓慢下降,载药能力快速上升。当药物浓度继续增至20 μg/mL,载药量快速下降至50%,载药能力变化趋于稳定。综合载药能力和载药量,10 mg的羟基磷灰石负载10 μg/mL盐酸阿霉素是最高效的。
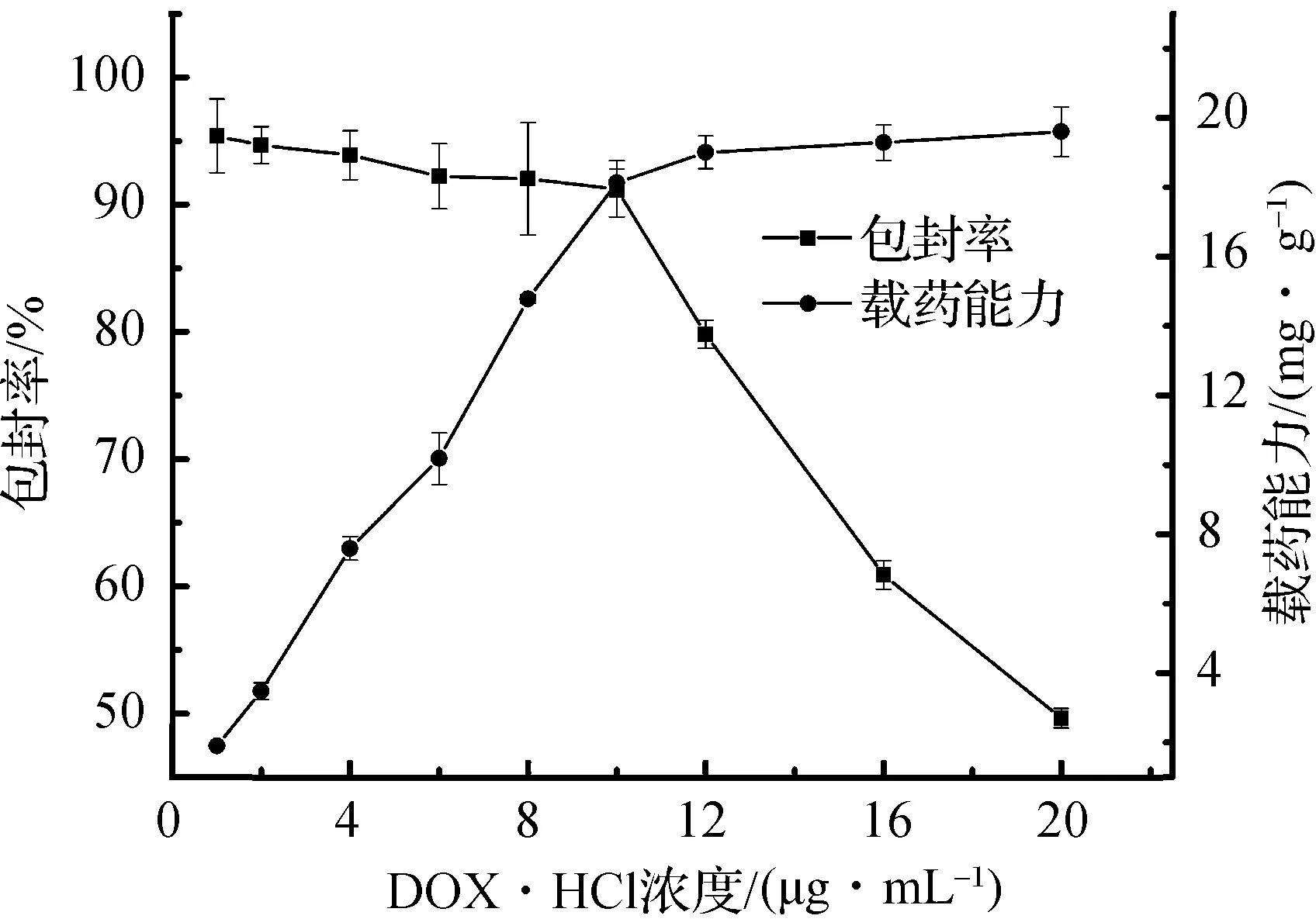
图6 盐酸阿霉素的浓度对羟基磷灰石药物载药量和载药能力的影响

2.4药物在碳酸钙和羟基磷灰石微球上的释放行为
图7为盐酸阿霉素在碳酸钙和羟基磷灰石微球上的累积释放量随时间变化曲线。盐酸阿霉素在碳酸钙微球上的释放可分为两个阶段:前期突释和后期缓慢释放。释放开始至12 h,药物释放量迅速达到60%,平均释放速率为18.3 μg/h,有明显的突释现象。到168 h,药物释放速度逐渐下降至稳定,平均释放速率为 1.5 μg/h,最终释放量达到89.7%。对于羟基磷灰石微球,释放开始至12 h,平均释放速度为12.3 μg/h,释放量达到36.8%。至96 h,药物释放速度相对变缓,平均释放速率为 2.1 μg/h,释放量达到44.3%。到168 h时释放量基本达到稳定,最终释放了84.3%。 当释放时间点在12 h,两者的释放量有显著差异(p<0.05),羟基磷灰石的突释行为要小的多。如果要进一步减少前期突释,可以对微球进行表面改性,增加对药物的吸附能力。

图7 载药碳酸钙和羟基磷灰石体外释放曲线
2.5载药颗粒的体外细胞实验
图8为Huh-7细胞与载药碳酸钙和羟基磷灰石微球共培养1、3、7d增殖实验。如图,在培养初期Huh-7细胞轮廓呈椭圆形,没有伪足和触角。培养1d后,碳酸钙和羟基磷灰石上的细胞绿色荧光稍弱。3d后,基本只能看到星星点点的亮光,碳酸钙上的细胞数量要多于羟基磷灰石。7d后,实验组荧光强度非常弱,细胞基本凋亡。图8(b)是用CCK-8试剂盒定量表征Huh-7细胞的增殖数量。与对照组相比,载药颗粒对Huh-7细胞的生长有明显抑制作用。1 d后,空白对照组的细胞数量比载药颗粒上细胞数量多(p<0.05)。3d后,Huh-7细胞在获得充足的营养后迅速增殖,载药颗粒共培养的细胞数量减少,因为在释放的盐酸阿霉素作用下被杀死(p<0.01)。7d后,空白对照组的细胞数量进一步增加,而颗粒上的细胞进一步凋亡(p<0.01)。其中,在每个时间点,载药羟基磷灰石对肝癌细胞的抑制效果要好于碳酸钙,主要有两个原因:一是羟基磷灰石负载的药物量大于碳酸钙,药物释放量大,对细胞的抑制作用明显;二是羟基磷灰石能够更好的保持药物的活性,对Huh-7肝癌细胞的杀伤力更大。

图8 载药颗粒对Huh-7细胞增殖的影响
3 结 论
a) 在丝胶蛋白的调控下,得到尺寸均一的球形碳酸钙颗粒。以其为硬模板,在磷酸根离子过饱和条件下合成了结晶度好、纯度高的多孔羟基磷灰石微球。
b) 羟基磷灰石的负载能力要强于碳酸钙。且药物释放过程中,碳酸钙有突释,而羟基磷灰石与药物通过氢键或者静电作用结合,控制药物释放能力较强。
c) 载药颗粒与Huh-7肝癌细胞共培养7d发现,两种载药颗粒都对肝癌细胞增殖产生抑制,且羟基磷灰石的抑制作用更明显。
[1] PETITE H, VIATEAU V, BENSAID W, et al. Tissue-engineered bone regeneration [J]. Nature Biotechnology,2000,18(9):959-963.
[2] SANTO V E, GOMES M E, MANO J F, et al. Controlled release strategies for bone, cartilage, and osteochondral engineering-part I: recapitulation of native tissue healing and variables for the design of delivery systems [J]. Tissue Engineering Part B: Reviews,2013,19(4):308-326.
[3] SUN X, KANG Y, BAO J, et al. Modeling vascularized bone regeneration within a porous biodegradable CaP scaffold loaded with growth factors [J]. Biomaterials,2013,34(21):4971-4981.
[4] YANG S, GUO Q, SHORES L S, et al. Use of a chondroitin sulfate bioadhesive to enhance integration of bioglass particles for repairing critical-size bone defects [J]. Journal of Biomedical Materials Research Part A,2015,103(1):235-242.
[5] VENTURA M, SUN Y, CREMERS S, et al. A theranostic agent to enhance osteogenic and magnetic resonance imaging properties of calcium phosphate cements [J]. Biomaterials,2014,35(7):2227-2233.
[6] NI P Y, DING Q X, FAN M, et al. Injectable thermosensitive PEG-PCL-PEG hydrogel/acellular bone matrix composite for bone regeneration in cranial defects [J]. Biomaterials,2014,35(1):236-248.
[7] WANG J Q, ZHANG X D, NIE M, et al. Exotic spartina alterniflora provides compatible habitats for native estuarine crab sesarma dehaani in the yangtze river estuary [J]. Ecological Engineering,2008,34(1):57-64.
[8] JIANG S D, YAO Q Z, ZHOU G T, et al. Fabrication of hydroxyapatite hierarchical hollow microspheres and potential application in water treatment [J]. The Journal of Physical Chemistry C,2012,116(7):4484-4492.
[9] MIZUGAKI T, NAGATSU Y, TOGO K, et al. Selective hydrogenation of levulinic acid to 1, 4-pentanediol in water using a hydroxyapatite-supported Pt-Mo bimetallic catalyst [J]. Green Chemistry,2015,17(12):5136-5139.
[10] MAEHARA H, SOTOME S, YOSHII T, et al. Repair of large osteochondral defects in rabbits using porous hydroxyapatite/collagen (HAp/Col) and fibroblast growth factor-2 (FGF-2) [J]. Journal of Orthopaedic Research,2010,28(5):677-686.
[11] KASUYA A, SOBAJIMA S, KINOSHITA M. In vivo degradation and new bone formation of calcium phosphate cement-gelatin powder composite related to macroporosity after in situ gelatin degradation [J]. Journal of Orthopaedic Research,2012,30(7):1103-1111.
[12] JUN S H, LEE E J, JANG T S, et al. Bone morphogenic protein-2 (BMP-2) loaded hybrid coating on porous hydroxyapatite scaffolds for bone tissue engineering [J]. Journal of Materials Science: Materials in Medicine,2013,24(3):773-782.
[13] LIANG Y H, LIU C H, LIAO S H, et al. Cosynthesis of cargo-loaded hydroxyapatite/alginate core-shell nanoparticles (HAP@Alg) as pH-responsive nanovehicles by a pre-gel method [J]. ACS Applied Materials & Interfaces,2012,4(12):6720-6727.
[14] SORIANO-SOUZA C A, ROSSI A L, MAVROPOULOS E, et al. Chlorhexidine-loaded hydroxyapatite microspheres as an antimicrobial delivery system and its effect on in vivo osteo-conductive properties [J]. Journal of Materials Science: Materials in Medicine,2015,26(4):1-15.
[15] GUO Y J, WANG Y Y, CHEN T, et al. Hollow carbonated hydroxyapatite microspheres with mesoporous structure: Hydrothermal fabrication and drug delivery property [J]. Materials Science and Engineering: C,2013,33(6):3166-3172.
(责任编辑: 许惠儿)
Preparation of CaCO3and Hydroxyapatite Microsphere and Its Potential Application in Drug-Controlled Release
ZHONGQiwei,CAIYurong
(College of Materials and Textiles, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Spherical CaCO3particles were fabricated in the presence of the silk sericin and then hydroxyapatite (HAP) microspheres were prepared by taking spherical CaCO3particles as the hard template via hydrothermal method. The load and controlled release of DOX·HCl were performed by using doxorubicin hydrochloride as drug model and applying the obtained CaCO3and HAP spheres as carries respectively. The influence of drug-loaded particles on cell culture was evaluated through in-vitro experiment. Field emission scanning electron microscope(FE-SEM), Fourier infrared absorption spectrum(FT-IR), X-ray diffraction pattern(XRD), UV spectrophotometer and confocal laser scanning microscopy were applied to characterize the samples. Results show that vaterite phase of CaCO3can be stabilized by silk sericin, and CaCO3can be transformed to HAP by the ion-exchange reaction. For the loading of drug, the optimum concentrations of DOX·HCl for CaCO3and HAP are 8 and 10 μg/mL separately. HAP has stronger ability for controlled release of drugs. In vitro cell experiment shows an obvious inhibition role of loaded-DOX·HCl particles for Huh-7 cells and potential application as drug carriers. This proves drug loading and releasing functions of the particles.
CaCO3; hydroxyapatite; drug carrier; loading and release
10.3969/j.issn.1673-3851.2016.09.009
2015-11-16
国家自然科学基金项目(51202219);浙江省自然科学基金项目(LY16E020013)
钟奇伟 (1990-),男,浙江湖州人,硕士研究生,主要从事生物材料方面的研究。
蔡玉荣,E-mail: caiyr@zstu.edu.cn
TB34
A
1673- 3851 (2016) 05- 0685- 06 引用页码: 090204

