生物活性炭对水溶液中铜、锌离子吸附效果的测定与分析
万 山
(衡阳县环境保护监测站,湖南 衡阳 421200)
生物活性炭对水溶液中铜、锌离子吸附效果的测定与分析
万山
(衡阳县环境保护监测站,湖南 衡阳 421200)
采用原子吸收分光光度计,测定了水溶液中Cu(II)、Zn(II)被香蒲活性炭吸附后的含量,并对测定结果进行分析。香蒲活性炭对水溶液中Cu(II)、Zn(II)的吸附能力与溶液起始pH值、Cu(II)、Zn(II)的初始浓度以及吸附时间成正比;溶液起始pH值为6~8时,香蒲活性炭对Cu(II)、Zn(II)的单位质量吸附量相对较高。随着活性炭投加量的增加,Cu(II)、Zn(II)的去除率增加,但单位质量吸附量降低,最大平衡单位质量吸附量分别为49.45和25.82 mg/g。结果表明,香蒲活性炭是一种较好的吸附材料,对Cu(II)的单位质量吸附量高于Zn(II);实际应用中可在pH值为6~8的范围内设计运行pH值,使得Cu(II)、Zn(II)去除的同时废水pH值也达标排放。
原子吸收分光光度法;铜锌;香蒲活性炭;吸附;分析
原子吸收分光光度法是测定水样中重金属离子,比如Cu(II)、Zn(II)的常用方法[1]。采矿、油漆、汽车制造、金属电镀和制革厂等工业活动和农业生产活动中化肥和杀虫剂的大量应用是水体重金属污染的主要来源。Cu(II)、Zn(II)是维持生物体生长的必需微量营养元素,然而当Cu(II)、Zn(II)浓度较高时就会危及生物体健康及环境安全。吸附是一种有效去除重金属的方式,其中活性炭因具有高孔隙度、大比表面积、表面化学的可变性以及高的表面活性而被认为是一种有效的吸附剂[2]。由于传统的活性炭都是以成本较高的木材和煤炭为原材料,其应用和推广受到限制,故人们开始寻求廉价的原材料来降低活性炭的制作成本,从市政及工业活动废料到农田废弃物都有相关研究报道[3]。
本实验采用原子吸收分光光度计,测定了香蒲质活性炭吸附水溶液中Cu(II)、Zn(II)滤液中Cu(II)、Zn(II)的含量,并对测定结果进行分析,旨在为重金属离子的吸附去除提供科学依据。
1 材料与方法
1.1试验方法
1.1.1溶液起始pH值对吸附效果影响的测定
移取50 mL配制好的50 mg/L Cu(NO)2、Zn(NO)2混合溶液置于若干个250 mL碘量瓶中,分别加入0.1 g 香蒲活性炭,调节其pH值为2.0,3.0,4.0,5.0,6.0,7.0,8.0于25 ℃恒温振荡1 h。过滤后采用原子吸收分光光度计(Z-2000,日立公司)测定定量滤纸过滤后滤液的Cu(II)、Zn(II)浓度,计算单位质量吸附量。
1.1.2吸附时间对吸附效果影响的测定
分别移取50 mL配制好的50,100,150 mg/L Cu(NO)2、Zn(NO)2混合溶液置于250 mL碘量瓶中,分别加入0.1 g香蒲活性炭, 于20℃恒温振荡2,4,6,8,10,15,20,25,30,40,60,90,120 min,定量滤纸过滤。采用原子吸收分光光度计(Z-2000,日立公司)测定滤液的Cu(II)、Zn(II)浓度,计算单位质量吸附量。
1.1.3溶液中铜锌初始浓度对吸附效果影响的测定
移取50 mL浓度分别为 10,20,40,60,80,100,120,150,200 mg/L的Cu(NO)2、Zn(NO)2混合溶液置于250 mL碘量瓶中,分别加入0.1 g 香蒲活性炭,于15、25、35 ℃恒温振荡1 h,定量滤纸过滤。采用原子吸收分光光度计(Z-2000,日立公司)测定滤液的Cu(II)、Zn(II)浓度,计算单位质量吸附量。
1.1.4活性炭用量对吸附效果影响的测定
移取50 mL配制好的50 mg/L Cu(NO)2溶液置于250 mL碘量瓶中,分别加入0.02,0.05,0.1,0.2,0.5,1,1.5,2 g 香蒲活性炭,于25 ℃恒温振荡1 h。过滤后采用原子吸收分光光度计(Z-2000,日立公司)测定滤液的Cu(II)、Zn(II)浓度,计算单位质量吸附量和去除率。
1.2数据分析方法
1)单位质量吸附量的计算。
单位质量吸附量qt,即每克吸附剂吸附的金属离子量(mg/g),计算公式如下:
其中,C0为溶液中金属离子的初始浓度(mg/L);Ct为某一时刻溶液中金属离子浓度(mg/L);m为溶液中活性炭投加量(g);V为溶液体积(L)。
2)去除率R%计算公式如下:
2 结果与讨论
2.1溶液起始pH值对吸附效果的影响
活性炭表面含具有活性的含氧官能团,主要有-CHO、-OH、-COOH、-C=O,它们是活性炭吸附的活性位点。pH值作为重要的介质因素,不仅影响吸附点位的吸附、解析和化学水解过程,而且影响溶液中重金属离子在溶液中的氧化还原反应、水解和沉淀。pH值对铜、锌离子去除率的影响如图1所示。由图1可知,pH值对活性炭去除Cu(II)、Zn(II)的影响比较明显,总的来说,Cu(II)、Zn(II)去除率都随着pH值升高而增大。在pH值小于4时,H+与Cu(II)、Zn(II)竞争吸附位点,抑制活性炭表面吸附Cu(II)、Zn(II),因而去除率相对较低。pH值在4~6之间时去除率有微小的上升趋势,香蒲活性炭表面羧基、羟基和磷酸基等活性基团是活性炭的活性位点,由于这些活性位点是有限的,当这些活性位点被Cu(II)、Zn(II)占据后,溶液中其他离子就无法再被吸附。当pH>6时,随着溶液pH值的增加及溶液中OH-浓度的增加,Cu(II)、Zn(II)开始形成Cu(OH)2和Zn(OH)2沉淀,因而Cu(II)、Zn(II)去除率增加;当pH值为7时,水溶液中Cu(II)、Zn(II)去除率分别达到98.16%和82.32%;当pH值大于7时,溶液中铜离子浓度较小,香蒲活性炭对Cu(II)的吸附接近饱和,因而去除率没有明显变化,而Zn(II)去除率继续增加。本研究表明,香蒲活性炭对Cu(II)的去除率高于Zn(II),这一结果与Monser和Adhoum[4]研究的改性活性炭的研究结果相一致,究其原因可能是Cu(II)的离子半径小于Zn(II)[5]。为了吸附平衡时得到较好的去除效果,同时防止Cu(II)、Zn(II)在水溶液中产生沉淀,本试验选用pH值为6作为后续试验的条件。
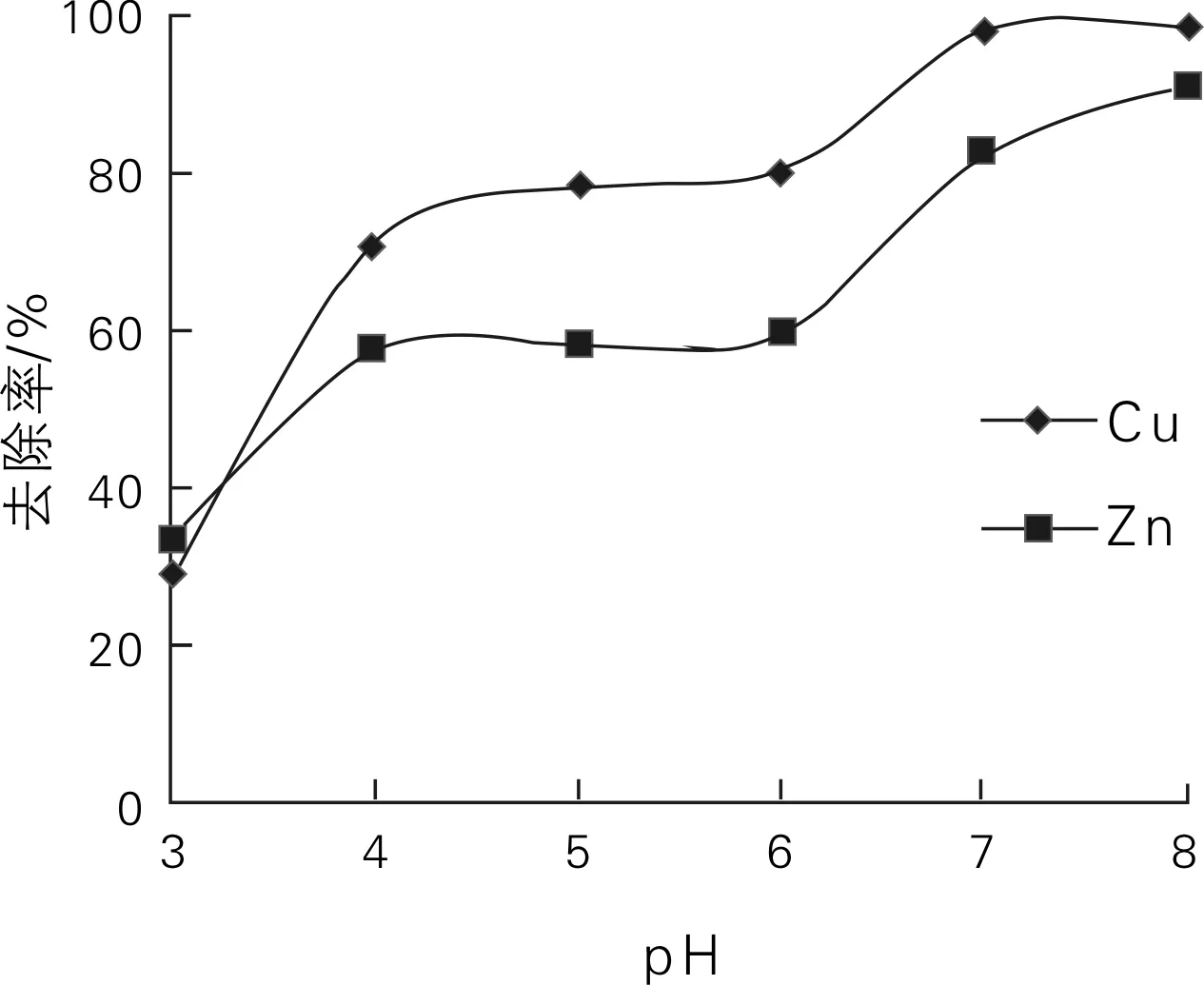
图1 pH值对铜、锌离子去除率的影响
2.2吸附时间与铜、锌起始浓度对吸附效果的影响
吸附时间对铜、锌离子吸附效果的影响如图2所示,由图2可知,香蒲活性炭对溶液中铜、锌离子的吸附都比较迅速,仅仅2min时间吸附就接近平衡,随后单位质量吸附量缓慢增加直至达到平衡吸附时间,大约到10min左右,香蒲活性炭对Cu(II)、Zn(II)的吸附都达到平衡,随后不再增加。活性炭对金属离子的吸附是一个循序渐进的过程,因而需要一定的时间达到吸附平衡[6]。本试验在如此短时间内达到吸附平衡可能与香蒲活性炭特殊的表面结构和官能团如磷酸基、羧基有关。香蒲活性炭对溶液中Cu(II)、Zn(II)的单位质量吸附量随着铜、锌离子初始浓度的增加而增大,当初始浓度从50mg/L增加到100mg/L时,Cu(II)、Zn(II)的单位质量吸附量分别从19.19和14.28mg/g增加到49.45和25.82mg/g。本试验虽然只需要10min就能达到吸附平衡,但是为使平衡更加充分,以下试验选用60min作为吸附时间。

图2 吸附时间对吸附铜、锌离子的影响
2.3活性炭用量对吸附效果的影响
香蒲活性炭用量对Cu(II)、Zn(II)去除率和单位质量吸附量的影响见图3。由图3可知,随着香蒲活性炭用量的增加,水溶液中Cu(II)、Zn(II)去除率逐渐增加而单位质量吸附量下降。当香蒲活性炭用量由0.02g增加到0.2g时,水溶液中Cu(II)、Zn(II)去除率显著增加,分别从21.33和43.43%增加到89.36和80.99%,当香蒲活性炭用量达到2g时,Cu(II)、Zn(II)去除率分别达到96.95%和92.36%(见图3中实线)。另一方面,当香蒲活性炭用量从0.02到0.2g时,活性炭对Cu(II)、Zn(II)的单位质量吸附量分别从26.67和43.43mg/g减少到1.21和1.15mg/g。香蒲活性炭用量增加,提供了更多的表面积和表面活性基团,因而吸附剂上吸附的Cu(II)、Zn(II)总量增加,水溶液中Cu(II)、Zn(II)浓度下降,去除率增加。水溶液中Cu(II)、Zn(II)总量是一定的,因而随着香蒲活性炭用量增加,活性炭单位质量吸附量逐渐减小。

图3 香蒲活性炭用量对吸附铜、锌离子的影响
3 结论
香蒲活性炭对Cu(II)、Zn(II)的吸附研究结果表明:Cu(II)、Zn(II)的单位质量吸附量随溶液起始pH值、重金属初始浓度的增加而增加,但随活性炭投加量的增加而降低;吸附平衡时间约为10min,达到吸附平衡时Cu(II)的单位质量吸附量较高于Zn(II)。在此基础上,有必要对活性炭的吸附动力学、热力学、等温吸附作进一步研究。
[1]张淑琴,童仕唐.活性炭对重金属离子铅锌铜的吸附研究[J].环境科学与管理,2008,33(4):91-93.
[2]张利波.烟杆基活性炭的制备及吸附处理重金属废水的研究[D].昆明:昆明理工大学,2007.
[3]RaoMM,RameshA,RaoGPC,etal.RemovalofcopperandcadmiumfromtheaqueoussolutionsbyactivatedcarbonderivedfromCeibapentandrahulls[J].JournalofHazardousMaterials,2006,129(1-3):123-129.
[4]MonserL,AdhoumN.Modifiedactivatedcarbonfortheremovalofcopper,zinc,hromiumandcyanidefromwastewater[J].Separation&PurificationTechnology,2002,26(26):137-146.
[5]LiY,YueQY,GaoBY.AdsorptionkineticsanddesorptionofCu(II)andZn(II)fromaqueoussolutionontohumicacid[J].JournalofHazardousMaterials,2010,178(1-3):455-461.
[6]OzdesD,GundogduA,KemerB,etal.RemovalofPb(II)ionsfromaqueoussolutionbyawastemudfromcoppermineindustry:equilibrium,kineticandthermodynamicstudy[J].JournalofHazardousMaterials,2009,166(2-3):1480-1487.
(责任编辑高嵩)
Removal Analysis of Cu(II) and Zn(II) in Solution by Bio-activated Carbon
Wan Shan
(Environmental Protection Monitoring Station of Hengyang,Hengyang Hunan 421200)
In this study,Atom Absorption Spectrometry was used to analyze the concentrations of Cu(II) and Zn(II) after adsorption by Cattail-based activated carbon in solutions.The sorption removal of Cu(II) and Zn(II) by activated carbon increased with the initial pH,the concentrations of Cu(II) and Zn(II),and the dosage of activated carbon in the solutions;there were higher sorption capacities for both metal ions in the pH range from 6 to 8.While the addition of activated carbon increased the removal efficiencies of Cu(II) and Zn(II);however, it decreased the adsorption capacities of Cu(II) and Zn(II).The maximum adsorption capacity for Cu(II) and Zn(II) was 49.45 and 25.82 mg/g,respectively.The results indicatd that cattail-based activated carbon was a good adsorption material,and had a higher adsorption capacity for Cu(II) than that of Zn(II);pH of 6 to 8 of solution could be chosen for practical design of adsorption system to ensure that the discharge pH meets the effluent standard while Cu(II) and Zn(II) removal.
atom adsorption spectrometry;Cu(II) and Zn(II);cattail-based activated carbon;adsorption;analysis
2016-04-28
万山,工程师,大专。
10.3969/j.issn.2095-4565.2016.04.005
X53
A
2095-4565(2016)04-0017-04

