阿尔茨海默病患者外周血调节性T细胞稳定性的分析
高玉雷 翟建华 刘 斌 柴艳芬
(天津医科大学总医院急诊医学科,天津 300052)
阿尔茨海默病患者外周血调节性T细胞稳定性的分析
高玉雷 翟建华 刘 斌 柴艳芬
(天津医科大学总医院急诊医学科,天津 300052)
目的:探讨阿尔茨海默病(AD)患者外周血调节性T细胞(Tregs)稳定性的特点。方法:分选AD患者外周血Tregs,通过流式细胞仪检测特征性标志物叉头转录因子(Foxp)-3和表面分子细胞毒性T淋巴细胞相关抗原(CTLA)-4 及膜相关转化性生长因子(TGF)-β的表达水平,通过ELISA检测特征性细胞因子TGF-β和白细胞介素(IL)-10分泌水平,并进一步通过Transwell培养板培养方法,分析AD患者Tregs发挥免疫抑制功能的特点。结果:与对照组比较,AD组患者细微精神状态语言检查(MMSE)评分明显降低(P<0.01);AD组外周血Tregs数目、特征性标志物Foxp-3及细胞表面标志物CTLA-4和膜相关TGF-β表达水平均均低于对照组,差异有统计学意义(P<0.05或P<0.01);特征性细胞因子TGF-β和IL-10分泌水平均无明显变化(P>0.05);经Transwell培养板培养24 h,能够降低AD组Tregs对CD4+CD25-T细胞增殖功能的抑制作用,差异有统计学意义(P<0.05)。结论:AD能够降低患者外周血Tregs稳定性,其机制主要是降低其以细胞接触途径介导的免疫调节作用。
阿尔茨海默病 调节性T细胞 免疫抑制 稳定性
阿尔茨海默病(AD)主要表现为神经系统β淀粉样变性,慢性神经炎症反应是病情发生发展的主要机制[1]。既往有研究表明,高龄AD晚期患者外周血主要表现为β淀粉样变性特异性T细胞比例升高[2]。近期通过5XFAD小鼠AD模型研究发现,这种特异性T细胞比例的升高与Foxp-3+调节性T细胞(Tregs)比例及稳定性降低有关,增加小鼠体内Tregs比例能够降低神经系统β淀粉样变性的程度以及延缓变性时间,但目前并没有针对AD患者外周血Tregs特点的
探讨[3]。本研究通过检测AD患者外周血Tregs特征性标志物叉头转录因子(forkhead/winged helix transcription factor, Foxp)-3和表面分子细胞毒性T淋巴细胞相关抗原(cytotoxic T lymphocyte associated antigen, CTLA)-4及膜相关转化性生长因子(transforming growth factor, TGF)-β表达水平,检测细胞因子TGF-β和IL-10分泌水平,并进一步通过Transwell培养板培养方法,初步探讨AD患者外周血Tregs稳定性的特点。
1 材料与方法
1.1 试验材料与仪器 人CD4+CD25+Tregs分选试剂盒(德国Miltenyi公司),胎牛血清(美国Hyclone公司),RPMI1640培养基和磷酸盐缓冲液(北京索莱宝公司),红细胞裂解液(天津灏洋生物公司),人IL-10和TGF-β ELISA试剂盒(上海依科赛公司),细胞毒性/增殖检测试剂-8(日本Dojindo公司),异硫氰酸荧光素(FITC)-人-Foxp-3、FITC-人-CTLA-4和APC-人-TGF-β (加拿大eBioscience公司)。CO2恒温培养箱(日本NAPC公司),光学显微镜和倒置显微镜(日本Olympus公司),SpectraMR多功能酶标仪(美国DYNEX公司),细胞分选仪和流式细胞仪(德国Miltenyi公司)。
1.2 研究对象 天津医科大学总医院神经内科2015年1月—2016年1月收治的AD患者(AD组)及无AD表现的患者(对照组)。AD依据美国国立神经病语言障碍卒中研究所AD及相关疾病协会制定的AD诊断标准[4]进行诊断,并采用细微精神状态语言检查(mini-mental state examination, MMSE)量表[5]进行痴呆评分筛选;对照组采用MMSE量表对能够生活自理的患者进行记忆力和智力测定等评分,排除痴呆等AD临床表现。所有研究对象均通过结合询问病史、常规体格检查及近期相关辅助检查等,排除免疫相关疾病及近期服用影响免疫功能药物的患者。对两组研究对象的年龄和性别等因素进行分析,保证研究资料的一致性。本试验均符合医学伦理学标准。
1.3 细胞分离及培养 分别抽取各组患者外周血40 ml,使用红细胞裂解液去除红细胞,人淋巴细胞分离液分离单个核细胞。按照磁珠分选原理分选人 CD4+CD25+Tregs和CD4+CD25-T细胞。流式细胞仪检测两种细胞纯度分别约为 96% 和95%,锥虫蓝染色细胞存活率均超过96%,可以进行试验。以抗-人-CD3/CD28为CD4+CD25-T细胞增殖的刺激因子,使用96孔普通培养板和Transwell培养板,CD4+CD25+Tregs和CD4+CD25-T细胞共培养细胞比例为1∶1共培养24 h。
1.4 检测指标及方法
1.4.1 流式细胞仪检测Tregs标志物表达 收集分选后的各组Tregs,离心弃上清液,加入100 μl磷酸盐缓冲液重悬细胞(2×105),分别加入FITC-人-Foxp-3、FITC-人-CTLA-4和APC-人-TGF-β,设阴性对照管;4 ℃避光孵育30 min,加入磷酸盐缓冲液 2~3 ml离心洗涤2次,弃上清液;重悬细胞,流式细胞仪检测表达率。
1.4.2 多功能酶标仪检测CD4+CD25-T细胞增殖能力 各组Tregs 和 CD4+CD25-T细胞共培养24 h后,各孔吸出 100 μl上清液,并加入10 μl细胞毒性/增殖检测试剂-8,继续培养1~2 h,通过多功能酶标仪检测波长450 nm处的吸光度值(A450)。
1.5 统计学方法 采用SPSS 17.0软件处理各组数据,计量资料以x±s表示,进行单因素方差分析,两两比较采用LSD检验,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1 对照组与AD组一般资料分析 两组研究对象的样本数目、性别及年龄分布差异均无统计学意义(P>0.05)。按照MMSE评分进行痴呆筛查后,AD组评分[(12.321±1.210)分]明显低于对照组[(24.654±1.543)分],差异具有显著统计学意义(P<0.01)。见表1。
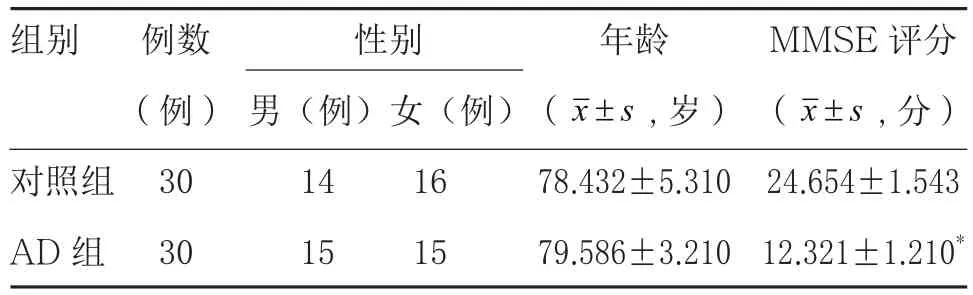
表1 对照组与AD组一般资料分析
2.2 对照组与AD组外周血Tregs数目与标志物的特点 AD组外周血Tregs数目[(1.321±0.231)×105/ml]明显低于对照组[(2.300±0.435)×105/ml],差异具有显著统计学意义(P<0.01)。与对照组比较,AD患者外周血Tregs特征性标志物Foxp-3[对照组(77.430±4.543)%比AD组(55.654±2.654)%]及细胞表面标志物CTLA-4[对照组(70.543±5.881)%比AD组(51.430±3.439)%]和膜相关TGF-β[对照组(57.057±4.697)%比AD组(47.597±3.836)%]表达水平均降低,差异有统计学意义(P<0.05或P<0.01)。见图1。
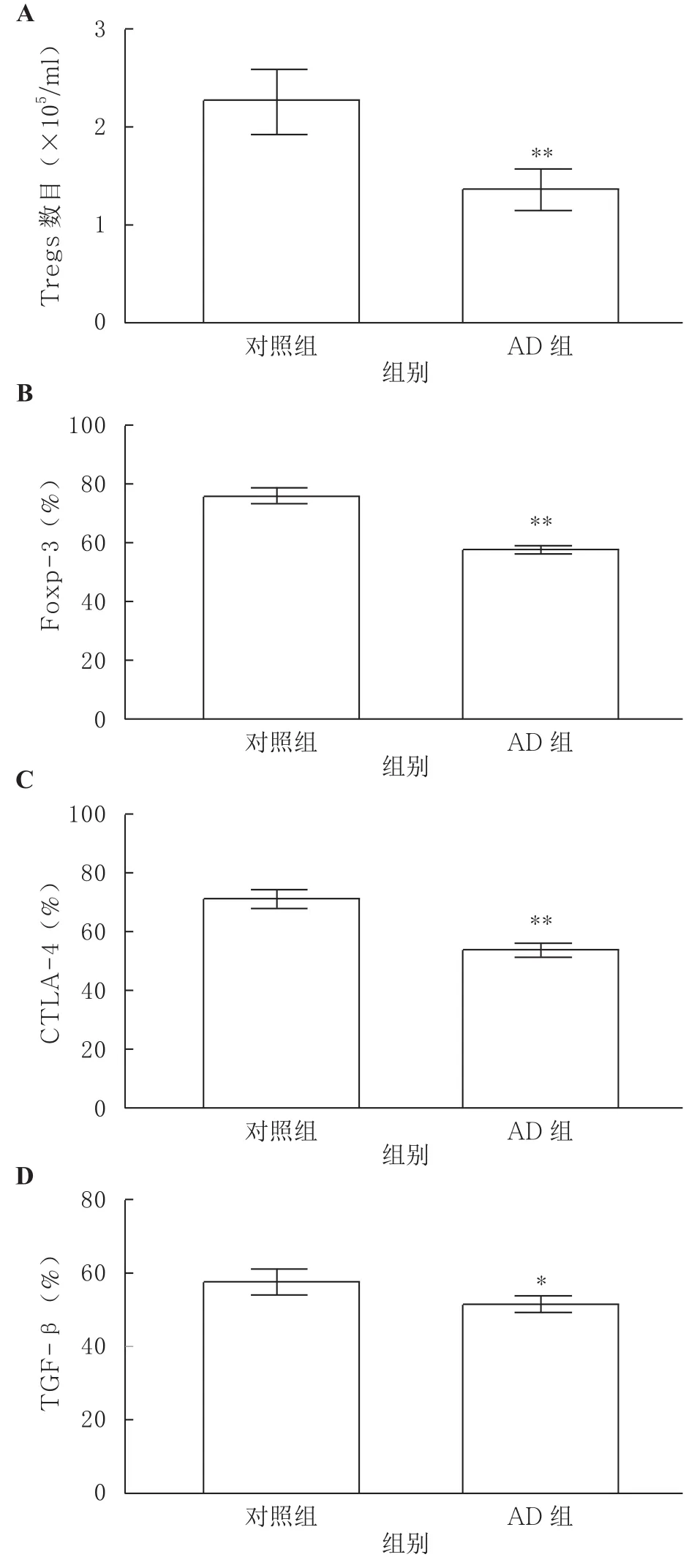
图1 AD对患者外周血Tregs数目(A)与标志物Foxp-3(B)、CTLA-4(C)和膜相关TGF-β(D)的影响
2.3 对照组与AD组外周血Tregs分泌游离细胞因子的特点 分选各组外周血Tregs,体外培养2 4 h后,T r e g s分泌T G F-β的水平[对照组(116.187±14.995)pg/ml比AD组(120.110±11.977)pg/ml]和IL-10的水平[对照组(91.283±8.448)pg/ml比AD组(87.120±13.613) pg/ml]差异均无统计学意义(P>0.05)。见图2。

图2 AD对患者外周血Tregs分泌游离细胞因子TGF-β(A)和IL-10(B)的影响
2.4 对照组与AD组外周血Tregs免疫抑制功能的特点 分选各组外周血Tregs,分别使用普通培养板和Transwell培养板,体外按照细胞数为1:1的比例与正常CD4+CD25-T细胞共培养,培养24 h后,与单纯培养的正常CD4+CD25-T细胞组(A组,0.717±0.088)比较,其余各组Tregs均能抑制CD4+CD25-T细胞增殖功能(B组0.303±0.081, C组0.603±0.032, D组0.513±0.057和E组0.612±0.054),差异有统计学意义(P<0.05或P<0.01);经普通培养板培养后,AD组患者分选的Tregs对CD4+CD25-T细胞增殖功能的抑制作用(D组)明显弱于对照组患者(B组),差异有显著统计学意义(P<0.01);经Transwell培养板培养后,能够进一步降低AD患者外周血Tregs对CD4+CD25-T细胞增殖功能的抑制作用(E组),差异有统计学意义(P<0.05和(P<0.01)。见图3。
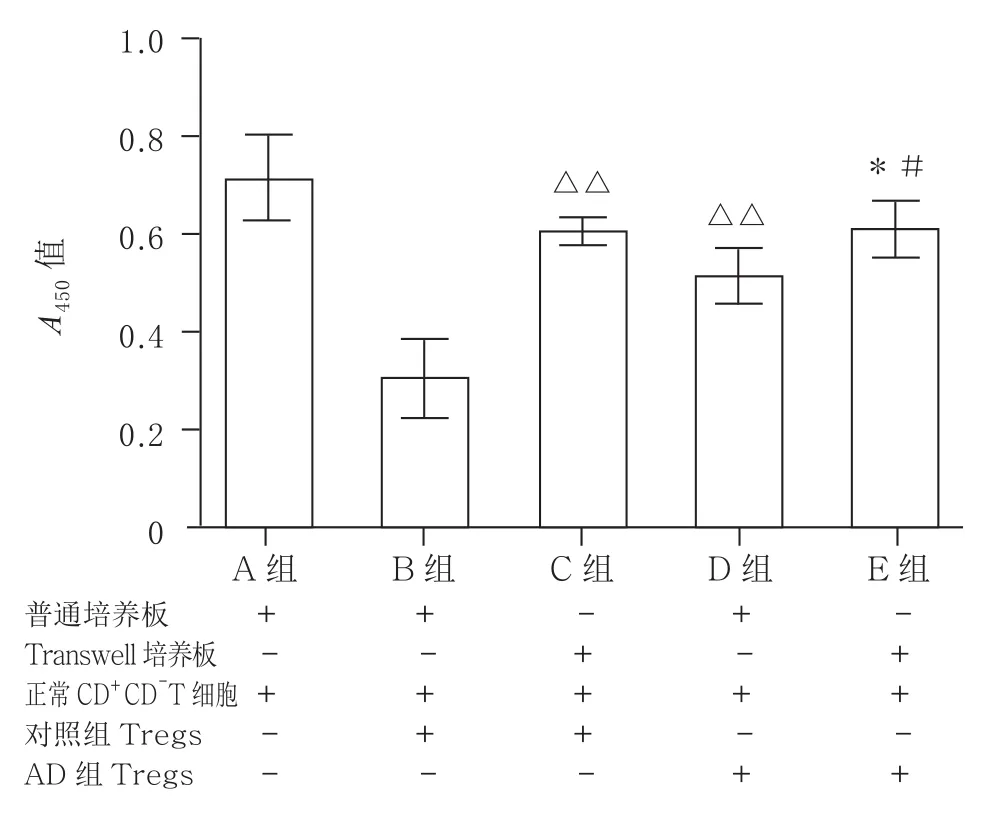
图3 AD对患者外周血Tregs免疫抑制功能的影响
3 讨 论
大量研究表明,过度的特异性T细胞活化和功能增强所引起的神经系统β淀粉样变性参与AD的发生发展过程,并且与年龄有明显的相关性[1-2]。研究者普遍认为,过度的自身免疫反应能够加重AD的病情,甚至使AD的发生趋于年轻化,给予免疫调节治疗,降低过度的特异性T细胞活化与功能增强能够缓解AD症状以及预防AD的发生[6]。
CD4+CD25+Tregs 以高表达CD25及特征性标志物Foxp-3 为主要特征,具有免疫无反应性和免疫抑制性。根据来源不同,Tregs主要分为胸腺中发育的自然性Tregs(nTregs) 和抗原诱导外周CD4+CD25-T淋巴细胞转化而来的诱导性Treg(iTregs),后者包括Tregs1/辅助性T细胞3(Tregs1/Th3),狭义上Tregs指nTregs。尽管CD4+CD25+Tregs在CD4+T淋巴细胞中比例为5%~10%,但其在自身免疫性疾病、严重感染及恶性肿瘤诱导的免疫抑制中扮演着关键性角色[7-9]。
既往研究表明,在AD小鼠模型脑内过表达Tregs膜相关TGF-β可以显著促进小胶质细胞对β淀粉样变性的清除,同时能够缓解特异性T细胞过度活化所引起的神经系统β淀粉样变性[10]。对多发性硬化患者的研究表明,增加外周Tregs分泌TGF-β和IL-10的水平,能够缓解病情的发展,然而对于具有类似发病机制的AD患者的相关研究中,尚未见相关报道[11]。本研究表明,AD组外周血Tregs数目、特征性标志物Foxp-3及细胞表面标志物CTLA-4和膜相关TGF-β表达水平均均降低,而特征性细胞因子TGF-β和IL-10分泌水平均无明显变化。本研究通过对AD患者外周血Tregs变化特点的分析,进一步验证了动物实验的结果,为AD免疫调节治疗提供了有力的依据,为探索AD免疫调节途径提供了线索。
既往徐俊等[12]研究发现,AD患者外周血CD4+CD25+Tregs细胞比例及对T细胞免疫抑制功能明显低于对照组,然而并未进一步分析Tregs发生该变化的具体原因。Tregs主要通过CTLA-4和膜相关TGF-β介导的细胞接触机制和分泌IL-10和TGF-β等抑制性细胞因子发挥免疫抑制效应,其对效应性T细胞主要表现为,抑制T细胞增殖、促进细胞凋亡以及抑制促炎性细胞因子分泌等[7-9]。AD患者外周主要表现为过度的特异性T细胞活化与功能增强,IL-2和干扰素(IFN)-γ等促炎性细胞因子分泌增加,同时结合既往动物实验表明特异性T细胞比例的升高与Foxp-3+Tregs比例及稳定性降低有关,我们推测AD能够降低患者外周血Tregs稳定性[1-3]。我们进一步的共培养结果也初步表明AD能够降低患者Tregs对正常CD4+CD25-T细胞的免疫抑制作用,Transwell细胞培养板的培养结果进一步表明,AD主要是降低了以CTLA-4和膜相关TGF-β介导的细胞接触机制为主的免疫调节作用。
[1]Hock C, Konietzko U, Papassotiropoulos A, Wollmer A, Streffer J, von Rotz RC, Davey G, Moritz E, Nitsch RM. Generation of antibodies specific for beta-amyloid by vaccination of patients with Alzheimer disease[J].Nat Med, 2002, 8(11):1270-1275.
[2]Crunkhorn S. Neurodegenerative disease: immunotherapy opportunity emerges for Alzheimer disease[J]. Nat Rev Drug Discov, 2016, 15(3):158.
[3]Baruch K, Rosenzweig N, Kertser A, Deczkowska A, Sharif AM, Spinrad A, Tsitsou-Kampeli A, Sarel A, Cahalon L, Schwartz M. Breaking immune tolerance by targeting Foxp3(+) regulatory T cells mitigates Alzheimer's disease pathology[J]. Nat Commun, 2015, 6:7967. doi: 10.1038/ncomms8967
[4]McKhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CR Jr, Kawas CH, Klunk WE, Koroshetz WJ, Manly JJ, Mayeux R, Mohs RC, Morris JC, Rossor MN, Scheltens P, Carrillo MC, Thies B, Weintraub S, Phelps CH. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Instituteon Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J]. Alzheimers Dement, 2011, 7(3):263-269.
[5]Tse CS, Chang JF, Leung GT, Fung AW, Hau KT, Chiu HF, Lam LC. Effects of education on very mild dementia among Chinese people in Hong Kong: potential mediators in the Cantonese Mini-Mental State Examination tasks[J]. Aging Ment Health, 2013, 17(3): 310-318.
[6]Saresella M, Calabrese E,Marventano I, Piancone F, Gatti A, Calvo MG, Nemni R, Clerici M. PD1 negative and PD1 positive CD4+ T regulatory cells in mild cognitive impairment and Alzheimer's disease[J]. J Alzheimers Dis, 2010, 21(3):927-938.
[7]Gao YL, Chai YF, Qi AL, Yao Y, Liu YC, Dong N, Wang LJ, Yao YM. Neuropilin-1(high)CD4(+)CD25(+) regulatory T cells exhibit primary negative immunoregulation in sepsis[J]. Mediators Inflamm, 2016:7132158. doi: 10.1155/2016/7132158
[8]Gao YL, Chai YF, Dong N, Han S, Zhu XM, Zhang QH, Yao YM. Tuftsin-derived T-peptide prevents cellular immunosuppression and improves survival rate in septic mice[J]. Sci Rep, 2015, 5:16725. doi: 10.1038/srep16725
[9]张雷, 周荣斌, 姚咏明, 甘乐文. 信号转导和转录激活因子-5在小鼠CD4+CD25+调节性T细胞中的表达[J]. 感染、炎症、修复, 2011, 12(1):7-10.
[10]Dansokho C, Ait Ahmed D, Aid S, Toly-Ndour C, Chaigneau T, Calle V, Cagnard N, Holzenberger M, Piaggio E, Aucouturier P, Dorothée G. Regulatory T cells delay disease progression in Alzheimer-like pathology[J]. Brain, 2016, 139(4):1237-1251.
[11]李金凤, 王运良. 基质金属蛋白酶在多发性硬化中作用的研究进展[J]. 感染、炎症、修复, 2013, 14(2):123-125.
[12]徐俊, 徐武华, 吴剑芸, 杜南进, 秦琴保, 郑志平, 王敏健. 阿尔茨海默病的调节性T细胞功能检测[J]. 中国医药, 2006, 1 (8):459-461.
Analysis of the stability of regulatory T cells in peripheral blood of patients with Alzheimer's disease
Gao Yulei*, Zhai Jianhua, Liu Bin, Chai Yanfen.
*Emergency Department, General Hospital of Tianjin Medical University, Tianjin 300052, China
Chai Yanfen (E-mail: chaiyanfen2012@126.com)
Objective: To investigate the stability of regulatory T cells (Tregs) in peripheral blood of patients with Alzheimer's disease (AD). Methods: The peripheral blood Tregs were isolated from AD patients. Flow cytometry was performed to detect the expressions of forkhead/winged helix transcription factor-3 (Foxp-3), the surface molecular cytotoxic T lymphocyte associated antigen-4 (CTLA-4) and membrane associated transforming growth factor-β (TGF-β); ELISA was employed to determine the secretion levels of TGF-β and interleukin-10 (IL-10); and furthermore, Transwell culture plate was used to initially identify the immunosuppressive function of Tregs in AD patients. Results: Compared with the control group, the mini-mental state examination (MMSE) score of AD group was significantly lower (P<0.01). The Tregs number, the expression levels of Foxp-3, CTLA-4 and membrane associated TGF-β were significantly lower in AD group than in control group (P< 0.05 or P<0.01), but there were no obvious changes in the secretion levels of TGF-β and IL-10 (P>0.05). The immunosuppressive function of Tregs to CD4+CD25- T cells was reduced in AD patients after Transwell culture for 24 hours (P<0.05). Conclusions: AD can decrease the stability of Tregs in peripheral blood of patients, the mechanism might mainly be the decrease of immunoregulation mediated by cell contact pathway.
Alzheimer's disease; Regulatory T cells; Immunosuppression; Stability
2016-07-14)
10. 3969/j. issn. 1672-8521. 2016. 03. 006
天津医科大学总医院青年孵育基金 (ZYYFY2015020);北京协和医学基金会“睿E(睿意)急诊医学研究专项基金”(201617)
柴艳芬,主任医师(E-mail:chaiyanfen2012@126.com)

