广西省2013~2015年ALV-J分离株gp85基因序列分析
杨永立,王培坤,邹广珍,林璐璐,韦 平
(广西大学养禽与禽病学研究所,南宁 530004)
·研究论文·
广西省2013~2015年ALV-J分离株gp85基因序列分析
杨永立,王培坤,邹广珍,林璐璐,韦 平
(广西大学养禽与禽病学研究所,南宁 530004)
为了解J亚群禽白血病病毒(subgroup J Avian leukosis virus,ALV-J)在广西省鸡群中的变异趋势,对2013~2015年现场分离到的8株ALV-J毒株的gp85基因进行PCR扩增、克隆、测序及分析比较。结果表明,8株分离病毒核苷酸及氨基酸序列同源性依次为92.5%~99.8%和89.2%~100%,与原型株HPRS-103的同源性依次为92.8%~98.1%和88.6%~97.1%,与国内外其他分离株的同源性为92.9%~99.9%和87.6%~99.4%。位点的有义突变和沉默突变的比例显示,除了2014年的1个分离株GX14YY17的高变区(hypervariable region 1,hr1)外,均未发现选择压对连续几年的分离株的gp85基因有明显的作用。
J亚群禽白血病病毒;gp85基因;序列分析;突变;选择压
禽白血病病毒(Avian leukosis virus,ALV)属于反转录病毒科、α反转录病毒属[1]。ALV在鸡中主要有A、B、C、D、E和J共6个亚群,致病性外源性病毒以A、B和J为主,目前ALV-A、ALV-B的流行虽偶有报道[2],但已基本得到控制。J亚群ALV (Subgroup J,ALV-J)是Payne等[3]1989年首次从肉种鸡群中分离出来的新亚群,该病毒迅速传播至世界各地,我国在1999年从市场上的商品代肉鸡中首次分离检测到ALV-J[4],随后,在我国各省均有ALV-J感染的报道,ALV-J的致病性与传染性高于其他亚型,给我国的养禽业造成了严重的经济损失[5,6]。广西省是我国地方品种鸡资源最丰富的省份之一,流行病学调查显示,该省鸡群ALV的感染率较高,尤其是ALV-J[7,8]。本研究对2013~2015年从广西省各养殖场分离的ALV-J的gp85基因进行PCR扩增、克隆、测序与分析比较,探究ALV-J在广西省鸡群中的流行趋势及gp85基因变异特征。
1 材料与方法
1.1材料
1.1.1病料来源 8株分离株为2013~2015年期间分离自广西省各地的养殖场,详细背景见表1。
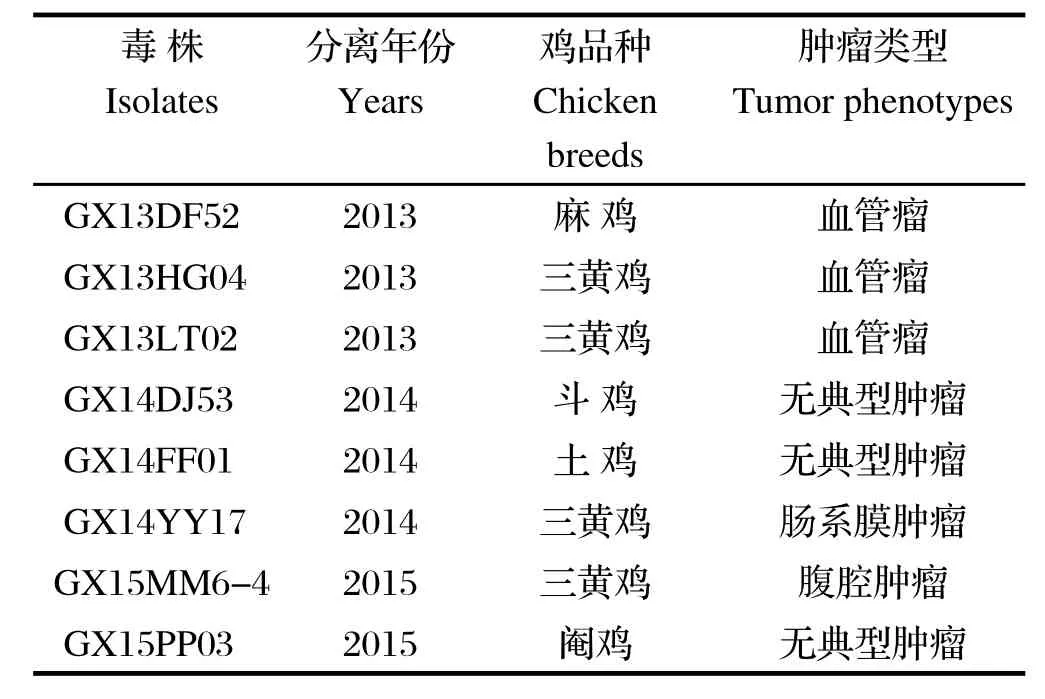
表1 8株ALV-J广西分离株Table 1 The background of 8 ALV-J strains in Guangxi
1.1.2主要仪器和试剂 DF-1细胞由广西大学养禽与禽病学研究所保存;DL2000 DNA Marker、2× Taq PCR Mix购自天根生化科技有限公司;通用型柱式基因组DNA抽提试剂盒、大肠埃希菌DH5α购自康为世纪生物科技有限公司;pMD18-T vector购自TaKaRa公司;禽白血病病毒p27抗原检测试剂盒购于美国IDEXX公司;胎牛血清和DMEM购自GIBCO公司。
1.2方法
1.2.1体外培养及培养物中前病毒DNA的提取 取送检病鸡的心脏、肝脏、脾脏、腺胃,加入5倍病变组织容积的灭菌生理盐水,混合研磨成浆并冻融3次后获得组织匀浆,离心取上清,经0.22 μm滤器过滤除菌后,置于-80℃保存备用。待DF-1细胞长至80%单层左右,吸弃培养基,接种病料的滤过液,吸附1 h以后,换为1%胎牛血清的DMEM培养基,9 d后收集培养细胞按试剂盒说明书提取DNA,置于-20℃保存备用。取细胞培养上清置于-80℃保存待测ALV-p27抗原。
1.2.2引物设计与合成 参照文献[9,10],设计合成J亚群鉴定引物,J亚群gp85基因序列引物,引物由华大基因公司合成。引物名称、序列以及目的片段大小见表2。
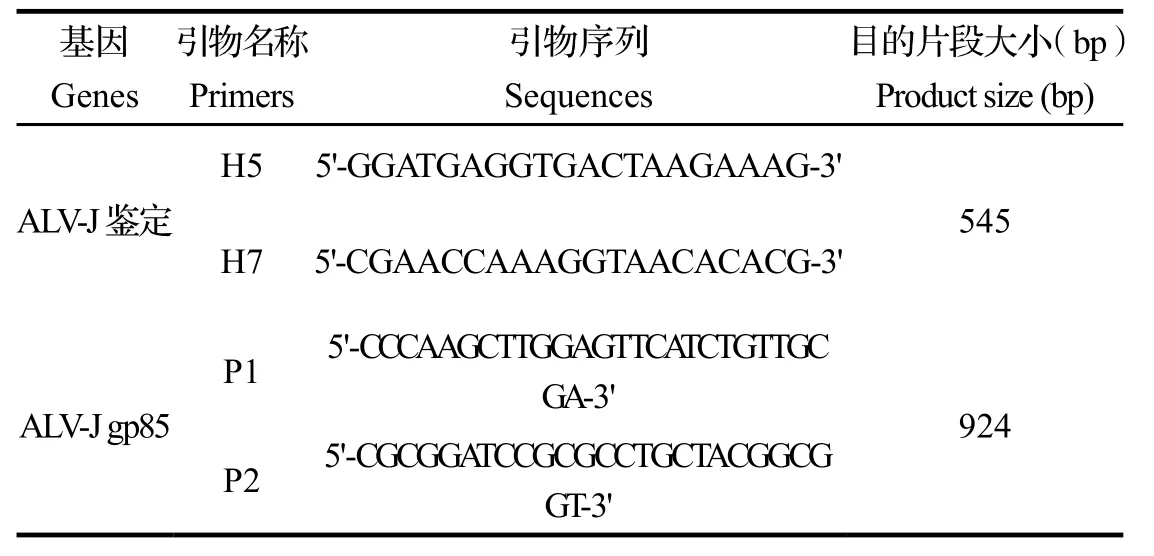
表2 本研究中PCR引物设计Table 2 PCR primers in the study
1.2.3病原鉴定 收集培养的DF-1细胞上清用IDEXX公司禽白血病病毒p27抗原检测试剂盒进行检测。另以提取的培养细胞前病毒DNA为模板,用ALV-J鉴定引物H5/H7进行PCR扩增。反应程序:95℃预变性5 min;95℃变性30 s,56℃退火45 s,72℃延伸90 s,35个循环;72℃再延伸5 min。1%琼脂糖凝胶电泳鉴定PCR产物。
1.2.4gp85基因的扩增、克隆和测序 以病毒分离细胞提取的前病毒DNA为模板,采用P1/P2进行PCR扩增。反应程序:72℃ 5 min;95℃ 5 min;94℃40 s,60℃ 30 s,72℃ 1 min,35个循环;72℃10 min。1% 琼脂凝胶电泳鉴定PCR产物。按照琼脂凝胶回收试剂盒说明书对PCR产物进行回收,连接至pMD18-T载体,转入DH5α感受态细胞,鉴定的阳性菌液送测序公司测序。
1.2.5基因序列分析 采用DNAStar 等软件,对测序所得的gp85基因序列与GenBank上相关病毒参考株的gp85基因序列进行同源性比较和遗传进化树分析,并对分离株gp85基因序列变异情况进行分析。
2 结果
2.1分离株细胞培养物ALV-p27抗原ELISA检测结果对收集的DF-1上清进行ALV-p27抗原检测。结果表明,接种病料的DF-1细胞上清检测结果均为阳性,而对照组DF-1细胞上清为阴性。
2.2分离株PCR检测结果 以病毒分离细胞提取的前病毒DNA为模板,进行PCR鉴定和gp85基因扩增,PCR产物经琼脂糖凝胶电泳检测,在545 bp和924 bp处有特异性条带(图1),与预期片段大小一致,说明分离株为ALV-J,并且gp85基因得到扩增。将分离的8株ALV-J分别命名为GX13DF52、GX13HG04、GX13LT02、GX14DJ53、GX14FF01、GX14YY17、GX15MM6-4和GX15PP03。

图1 分离株的PCR鉴定(A)及gp85基因的扩增结果(B)Fig. 1 PCR identifi cation of the virus isolates (A) and amplifi cation result of gp85 (B)
2.3分离株gp85基因测序结果与同源性分析 分离到的8株病毒之间的核苷酸同源性为93.1%~100%,氨基酸同源性为89.2%~100%,其中氨基酸同源性最高的是GX14DJ53株与GX15PP03株(同源性100%),最低的是GX14YY17株与GX14FF01株(同源性89.20%);与国内外分离株的核苷酸同源性为92.9%~99.9%,氨基酸同源性为87.6%~994%,其中氨基酸同源性最高的是分离株GX13LT02、 GX14DJ53、GX15PP03与参考株HUB09JY04(同源性99.4%),最低的是分离株GX14YY17与参考株NX0101(同源性87.6%)。
2.4分离株gp85氨基酸序列系统进化分析 通过与国内外分离株gp85氨基酸序列对比,构建遗传进化树(图2)。分析表明,分离株GX14DJ53、GX14FF01、GX15PP03、GX13LT02与参考株HuB09JY04处于同一进化分支,说明这4株的亲缘关系较近。同时,这4株分离株与原型株处于同一分支,说明他们与原型株都有保持较近的亲缘关系。分离株GX13DF52虽然与以上4株分离株处于同一分支,但亲缘关系相对较远。GX13HG04、GX14YY17、GX15MM6-4则同属于另一个分支。
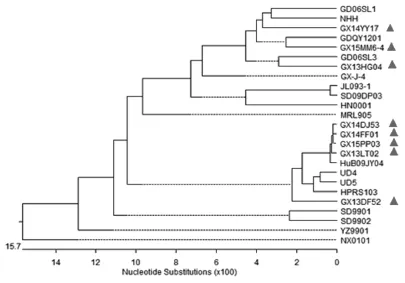
图2 分离株与其他参考株gp85氨基酸序列的系统进化树Fig. 2 Phylogenetic tree of the isolates and reference strains based on gp85
2.5分离株gp85基因序列变异情况分析 gp85基因高变区核苷酸序列中有义突变(nonsynonymous, NS)和沉默突变(synonymous,S)的比例显著升高是选择压发挥作用的一个重要指标,根据NS/S的比值来判断高低,一般NS/S大于2.5就认为有选择压起作用,否则就是随机突变[11]。为探究分离株gp85基因的变异情况,将分离到的8株ALV-J的gp85基因相对变异性高的hr1(hypervariable regions 1)、hr2 (hypervariable regions 2)和vr3(variable regions 3)区域与原型株HPRS-103比较,对其NS/S比值进行分析。结果显示,广西省2013~2015年的ALV-J分离株与ALV-J原型株HPRS-103相比,核苷酸变异数和氨基酸变异数并无规律,8个ALV-J分离株的gp85基因的NS/S比值均小于2.5,说明选择压对分离株的整个gp85区域没有明显的作用,但分离株GX14YY17、GX15MM6-4 gp85的hr1、hr2部分的NS/S比值均增大,尤其是分离株GX14YY17的hr1大于2.5,说明选择压在该分离株中的hr1区域发挥了作用(表3、图3、图4)。
3 讨论
ALV为典型的反转录病毒,由于基因组二聚体结构和反转录酶活性的作用,反转录病毒通常有很高的突变频率和重组率,从而造成了遗传上的不稳定性和多样性[9]。ALV-J的前病毒基因组主要含有gag、pol和env基因,gag和pol基因与A、B、C、D亚群有较高的同源性,而env基因差异较大,env基因的变异决定ALV-J毒株的变异,env基因编码gp85 和gp37两个糖蛋白,其中gp85是病毒抗原的主要成分,具有高度的可变性。ALV-J的gp85蛋白比其他亚型更易发生变异,其高变区主要集中在hr1、hr2和vr3三个区域,尤其是hr1和hr2区域更是变异集中区域[12]。
从gp85基因进化树分析可以看出,分离株GX14DJ53、GX14FF01、GX15PP03、GX13LT02 和GX13DF52处于同一进化分支,说明这4株的亲缘关系较近。这4株分离株与原型株处于同一分支,其中分离株GX14DJ53、GX14FF01、GX15PP03与参考株HuB09JY04同源性很高,都在99.0%以上;GX13HG04、GX14YY17、GX15MM6-4则同属于另一个进化分支。将8株分离株与原型株进行同源性分析,GX14DJ53、GX14FF01、GX15PP03、GX13LT02和GX13DF52与原型株的同源性很高,均在95%以上,说明广西省近几年的ALV-J毒株的变异都是围绕着原型株HPRS-103改变的。8株广西省ALV-J分离株间的氨基酸同源性为89.2%~100%,其中分离株GX14DJ53和GX15PP03的同源性为100%,这2株分离株分离自不同地域、不同品种的鸡体,推测可能是它们通过相同来源的污染活疫苗或者存在血缘关系(引种)而导致的ALV-J感染[13-15]。分离株GX14FF01、GX15PP03分离自广西省不同地域的病鸡,但其gp85氨基酸序列同源性为99.7%,经核查发现两病鸡种苗来自同一家育种公司,推测种苗在该公司已感染ALV,从而导致鸡发病。这就提醒养殖户在购买鸡苗时选择有信誉的育种公司,同时育种公司应做好禽白血病的净化工作。
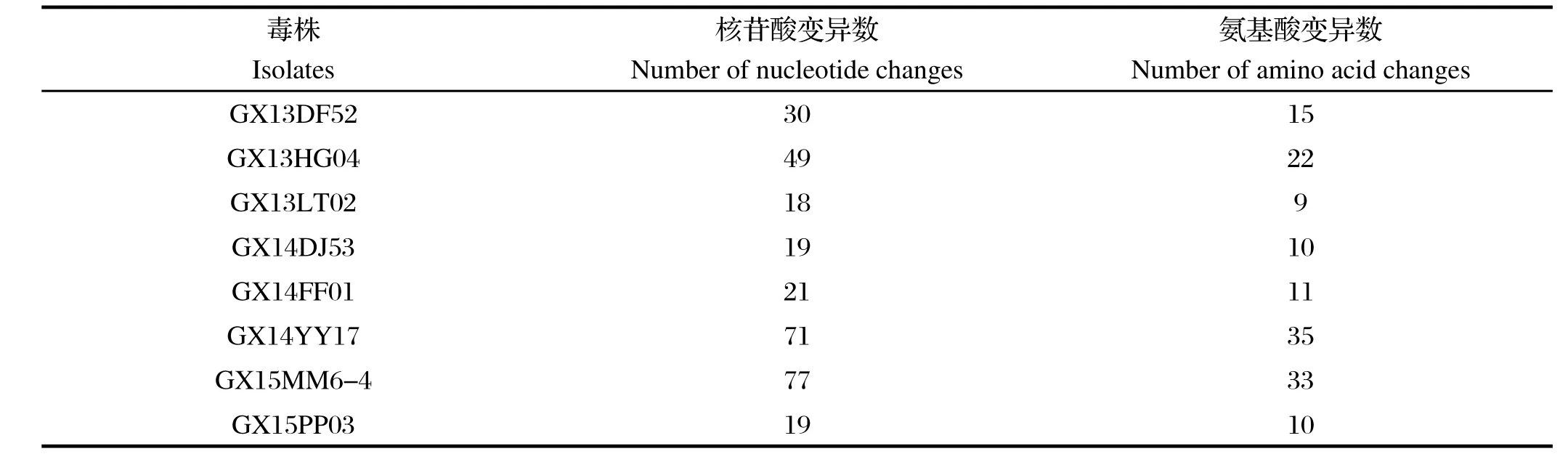
表3 分离株与ALV-J原型株HPRS-103基因变异比较Table 3 Genetic variations of the isolates compared with ALV-J prototype strain HPRS-103
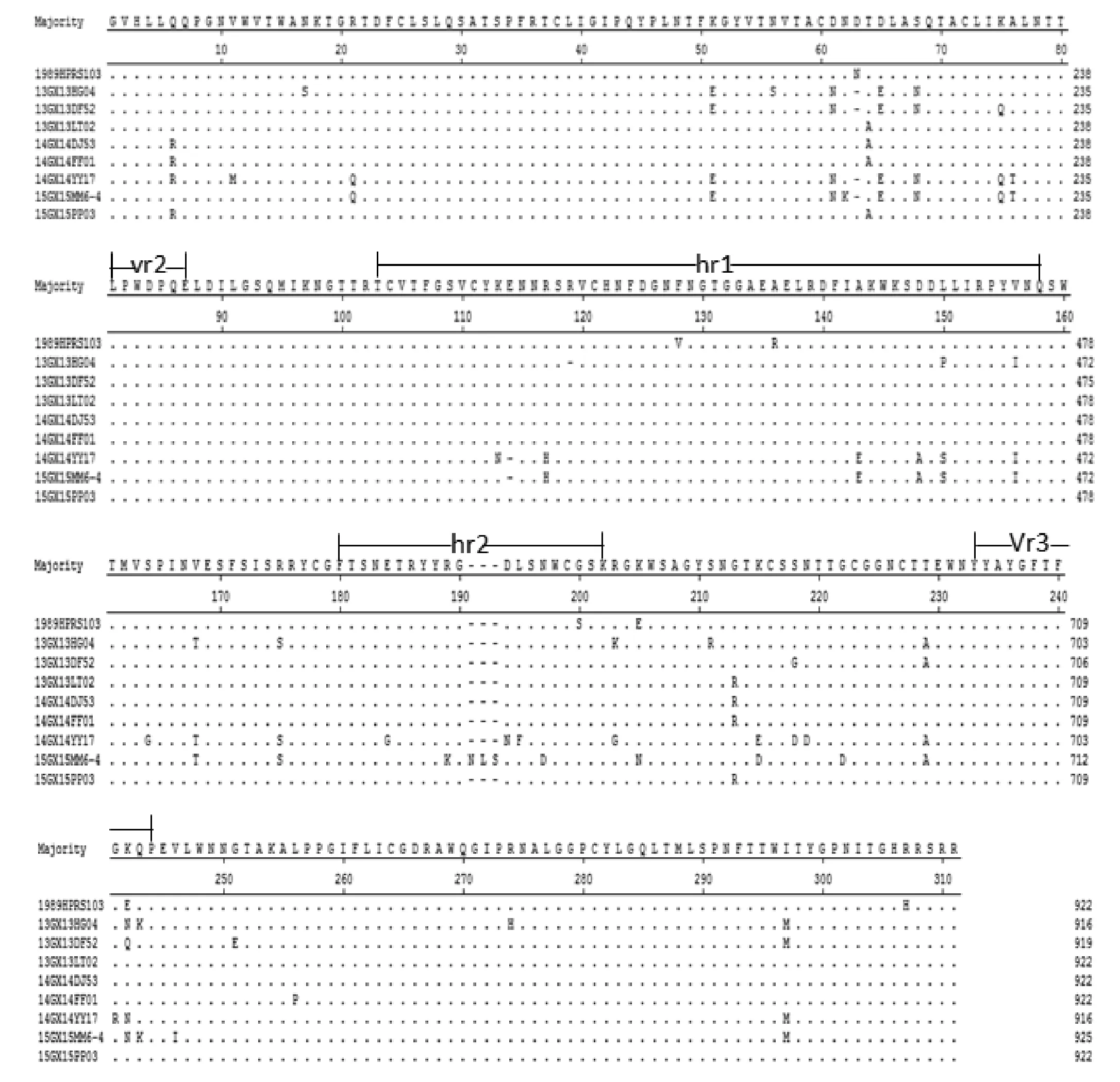
图3 分离株与ALV-J原型株HPRS-103 gp85氨基酸序列对比Fig. 3 Alignment of amino acid sequences of gp85 of the isolates and ALV-J prototype strain HPR-103
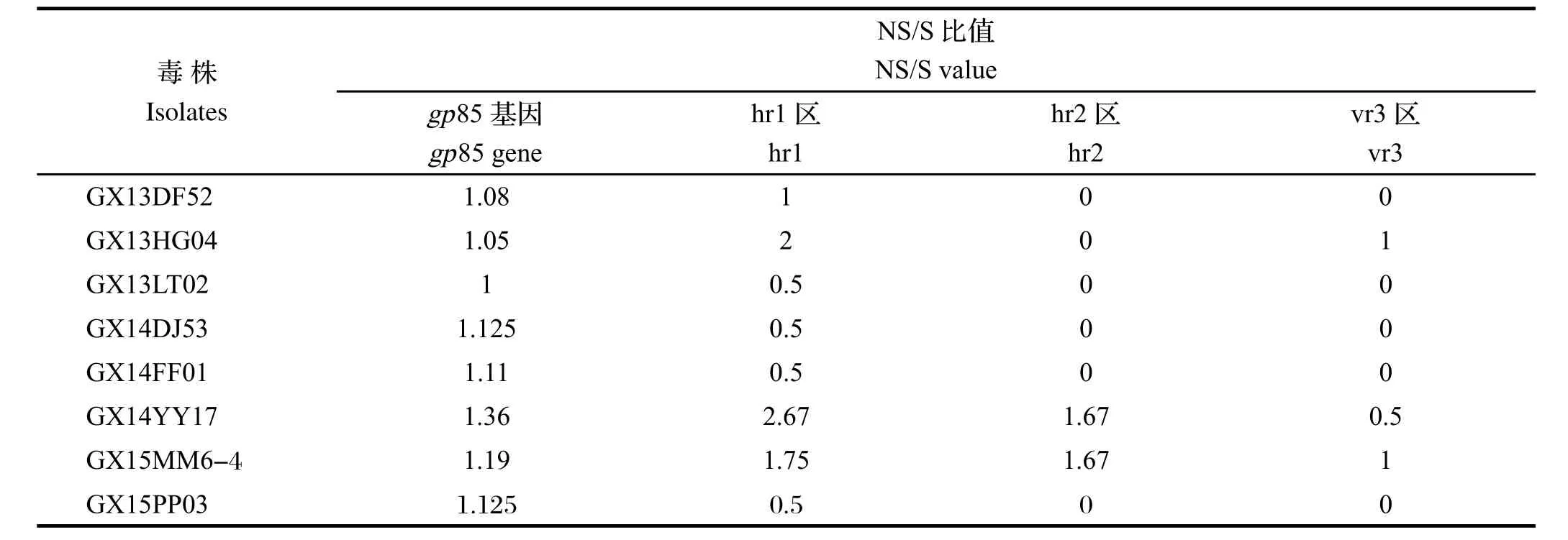
表4 分离株gp85基因NS/S比值分析结果Table 4 The ratio of NS/S of gp85 genes of the isolates
从分离株的ALV-J gp85与ALV-J原型株HPRS-103的氨基酸序列对比图上可以看出,gp85蛋白的变异主要集中在hr1、hr2和vr3,vr2相对保守,在高变区hr2的181、182、183的位置有4株分离株(GX13HG04、GX14YY17、GX15MM6-4、GX13DF52)均出现了氨基酸的缺失。在RNA病毒、反转录病毒的研究中,核苷酸突变和NS/S比值是研究抗原变异和选择压力强度的两大最基本参数。从表3中可以看出,每株病毒中都存在沉默突变,说明ALV-J毒株存在很高的不稳定性。8株分离株的gp85基因的NS/S比值都小于2.5,但分离株GX14YY17的hr1区域的NS/S为2.67,说明选择压对该分离株产生了作用,导致该分离株与原型株相比产生较大变异,同源性仅为88.6%。同时也表明选择压不一定对整个gp85区域都产生作用,可作用于高变区hr1和hr2,使这些区域的NS/S比值增大。说明这些区域是形成gp85蛋白上与病毒中和反应相关的抗原表位的核心区域[16]。
近年来,国内外对ALV-J的流行病学调查表明ALV-J的gp85基因有较高的变异速度,也有研究表明中国分离株的gp85与原型株HPRS-103的差异发生了同源回归现象,近几年的变化都是以原型株为原点在变异[17-19]。本研究发现,广西省2013~2015年的ALV-J分离株主要是围绕原型株在变异,同时广西省是中国主要的禽类饲养地区,地方品种资源尤为丰富,ALV-J处于复杂的养殖环境中,在选择压的作用下再加上其本身的不稳定性,ALV-J病毒分离株也发生了变异。
[1] Saif Y M. 禽病学[M]. 苏敬良, 高福, 索勋, 译. 北京: 中国农业出版社, 2005.
[2] 朱美真, 吴玉宝, 崔治中. 地方品系鸡中一株A亚群鸡白血病病毒的分离和鉴定[J]. 中国动物传染病学报, 2009,17(4): 31-35.
[3] Payne L N, Brown S R, Bumstead N, et al. A novel subgroup of exogenous avian leukosis virus in chickens[J]. J Gen Virol, 1991, 72(Pt4): 801-807.
[4] 张志, 崔治中, 赵宏坤, 等. 商品代肉鸡J亚群禽白血病的病理及病毒分离鉴定[J]. 中国兽医杂志, 2002, 38(6): 6-8.
[5] 冷毕丹, 吴元俊, 秦丽莉, 等. 广西主要地方优良品种鸡禽白血病的感染情况调查[J]. 广西畜牧兽医, 2013,29(3): 148-149.
[6] 余松城, 任雅, 牛婷, 等. 2011年~2012年四川地区J亚型禽白血病分子流行病学调查[J]. 中国预防兽医学报,2014, 36(5): 404-406.
[7] 王培坤, 秦丽莉, 毕玉彧, 等. 广西麻鸡感染A亚群与J亚群禽白血病病毒的诊断[J]. 中国家禽, 2015, 37(5): 56-58.
[8] 彭昊, 吴元俊, 秦丽莉, 等. 不同品种禽类ALV和REV感染情况调查[J]. 畜牧兽医学报, 2013, 44(12): 1989-1993. [9] 张青婵. A亚群禽白血病病毒不同分离株的基因组和生物学特性比较[D]. 泰安: 山东农业大学, 2010.
[10] Smith E J, Williams S M, Fadly A M. Detection of Avian Leukosis Virus Subgroup J Using the Polymerase Chain Reaction[J]. Avian Dis, 1998, 42(2): 375-380.
[11] Venugopal K, Smith L, Howes K, et al. Antigenic variants of J subgroup avian leukosis virus: Sequence analysis reveals multiple changes in the env gene[J]. Avian Pathology, 1998, 79: S91-S92.
[12] Silva R F, Fadly A M, Hunt H D. Hypervariability in the envelope genes of subgroup J avian leukosis viruses obtained from different farms in the United States.[J]. Virology, 2000, 272(1): 106-111.
[13] 李慧姣. 禽用病毒性活疫苗外源病毒污染现状[J]. 中国家禽, 2010, 32(22): 37-38.
[14] 庄金秋, 梅建国, 刘晓倩, 等. 部分禽源生物制品外源病毒的检测[J]. 动物医学进展, 2011, 33(4): 121-125.
[15] 胡晓苗, 沈学怀, 戴银, 等. PCR法检测活毒疫苗中禽白血病病毒污染[J]. 中国兽医杂志, 2014, 50(9): 23-25.
[16] 王增福, 崔治中. 在抗体免疫选择压作用下鸡J亚群白血病病毒gp85基因的变异[J]. 中国科学C辑: 生命科学,2006, 36(1): 9-16.
[17] 吴永平, 王增福, 崔治中, 等. 我国1999-2003年间ALV-J野毒株gp85基因变异趋势[J]. 中国病毒学, 2005, 20(4): 393-398.
[18] 陈静, 王波, 王海明, 等. 山东五大地方鸡禽白血病病毒主要流行亚型鉴定及其分离株gp85基因的分子特征分析[J]. 畜牧兽医学报, 2014, 45(3): 451-457.
[19] Xu B, Dong W, Yu C, et al. Occurrence of avian leukosis virus subgroup J in commercial layer flocks in China.[J]. Avian Pathol, 2004, 33(1): 13-17.
SEQUENCE ANALYSIS OF THE GP85 GENE OF GUANGXI ALV-J FIELD STRAINS COLLECTED DURING 2013-2015
YANG Yong-li, WANG Pei-kun, ZOU Guang-zhen, LIN Lu-lu, WEI Ping
(Institute for Poultry Science and Health, Guangxi University, Nanning 530004, China)
To investigate into the mutation tendency of subgroup J Avian leukosis virus (ALV-J) in chicken populations from Guangxi province, the gp85 gene of 8 fi eld strains of ALV-J isolated during 2013-2015 were amplifi ed, cloned, sequenced and compared with the reference strains. Sequencing results revealed that the sequence similarities at nucleotide and amino acid levels were 92.5%-99.8% and 89.2%-100% among these 8 field strains, 92.8%-98.1%, 88.6%-97.1% between these 8 filed strains and the prototype ALV-J strains HPRS-103 and 92.9%-99.9% and 87.6%-99.4% with other ALV-J isolates of both domestic and international. The number of nonsynonymous and synonymous changes in gp85 gene indicated the selective pressure did not have apparent effect on the whole gene except the hypervariable variable region (hr1) of GX14YY17 strain.
Avian leukosis virus subgroup J; gp85 gene; sequence analysis; mutation; selective pressure
S852.659.3
A
1674-6422(2016)04-0019-07
2016-01-18
国家公益性(农业)行业科研专项(201203055);国家现代农业产业技术体系广西肉鸡产业创新团队建设项目(nycytxgxcxtd-04-20-2)
杨永立,女,硕士,主要从事禽病学研究
韦平,E-mail:pingwei8@126.com

