新型鸡心包炎—包涵体肝炎病毒的分离及鉴定
汪 凯,蔡骁垚,叶建强,刘红梅,张 泉,刘芹防,李泽君,陈鸿军(. 中国农业科学院上海兽医研究所,上海 004;. 安徽农业大学动物科技学院,合肥 006;. 扬州大学兽医学院,扬州 5009)
·研究论文·
新型鸡心包炎—包涵体肝炎病毒的分离及鉴定
汪 凯1,2,蔡骁垚1,3,叶建强3,刘红梅2,张 泉3,刘芹防1,李泽君1,陈鸿军1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 安徽农业大学动物科技学院,合肥 230036;3. 扬州大学兽医学院,扬州 225009)
2015年在江苏省某养鸡场疑似心包炎-包涵体肝炎病死鸡肝脏中分离获得1株病毒,经SPF鸡胚4代纯化,并针对其hexon基因设计特异性引物进行PCR扩增,测序结果表明该分离株属于I群禽腺病毒(Fowl adenovirus,FAdV)血清4型,命名为JS7株。ORF29和fiber2基因测序分析表明,该毒株为最近在国内流行的新型突变株。JS7株以1000 ELD50病毒量肌肉接种21日龄雏鸡,5 d内呈现80%死亡率,剖检可见典型的心包炎、肝炎症状,在心脏、肝脏、脾脏、肺脏、肾脏、气管、法氏囊、脑、小肠、盲肠、腺胃、胸腺、胰脏中均能检测到病毒分布;H&E染色结果显示,在组织切片中,肝脏呈现典型的嗜碱性核染色,其他组织脏器也呈现不同程度的病理变化。可见JS7株在雏鸡中具有较强的致病性及广泛的组织嗜性。
包涵体肝炎;禽腺病毒;fi ber2;分离;鉴定
禽腺病毒(Fowl adenovirus,FAdV)属腺病毒科,根据抗原性可分为A~E群。从鸡分离的I群FAdV有12个血清型(FAdV1~12)[1],是鸡、鸭、鹅等禽类常见的传染病病原之一[2]。FAdV感染呈全球流行,可引起非典型病变和亚临床症状,表现为肝炎、再生障碍性贫血、出血、轻度呼吸道疾病和产蛋量下降,严重的可造成鸡包涵体肝炎(inclusion body hepatitis in chicken,IBH)、心包炎综合征(hydropericardium syndrome,HPS)、肌胃糜烂和溃疡(gizzard erosion and ulceration,GEU)等[3-7]。
2013年,中国爆发了一种可引起IBH和HPS的高致病性FAdV感染,主要侵害3~5周龄肉雏鸡和10~20周龄蛋鸡。至2015年6月,该病在全国大范围流行,多呈急性发病,且多发生于20~30日龄肉鸡,发病后d 4~8为死亡高峰,病程8~15 d,死亡率为20%~80%,给养鸡业造成严重的经济损失[8,9]。本研究从疑似心包炎-包涵体肝炎病死鸡肝脏病料中分离一种新型病毒,经PCR和动物回归实验,鉴定出该毒株为I群FAdV血清4型新型变异株,动物攻毒试验证实,该毒株对雏鸡具有强致病力。
1 材料与方法
1.1主要试剂 Phanta®Max Super-Fidelity DNA聚合酶购自南京诺唯赞生物公司;基因组DNA提取试剂盒购自上海生工生物工程技术有限公司;pGEM-T easy载体购自美国Promega公司。
1.2病料和鸡胚 2015年8月在江苏省某疑似心包炎-包涵体肝炎的肉鸡群中采集病变肝脏,保存备用;SPF鸡胚及SPF鸡购于北京梅里亚维通有限公司。
1.3病毒分离与纯化 取疑似心包炎-包涵体肝炎的病死鸡肝脏作为病料,将组织剪碎,加入钢珠,用含有2000 IU青霉素和2000 μ g链霉素无菌生理盐水稀释,在组织研磨器上震荡(70 Hz,5 min),8000×g离心10 min,取上清液置室温作用30 min,取0.2 mL经卵黄囊途径接种7日龄SPF鸡胚,收获接种24 h后死亡鸡胚的尿囊液,观察鸡胚肝脏病变。收获的尿囊液按有限稀释法再次经卵黄囊接种7日龄鸡胚,连续传3次,进行有限稀释纯化。
1.4分离株血凝特性及理化特性 配制1%的鸡、小鼠、绵羊或兔红细胞,检测分离株是否具有凝集红细胞的能力。对病毒尿囊液分别以氯仿、乙醚、盐酸(pH3)、5-溴尿嘧啶-2-脱氧核苷酸(BUDR)、NaOH(pH10)和60℃处理1 h,接种鸡胚死亡情况,观察7 d,采集鸡胚肝脏和尿囊液进行PCR检测。
1.5PCR鉴定 取上述研磨液或尿囊液0.2 mL,利用上海生工的基因组D N A试剂盒提取总D N A,测定浓度,-2 0℃冻存备用。参考GenBank中O N 1毒株hexon基因(登录号:GU188428)的852~1518 bp处设计特异性引物,FAdV-F1:5'-CAACTACATCGGGTTCAGGGA TAACTTC-3';FAdV-766R:5'-CCAGTTTCTGT GGTGGTTGAAGGGGTT-3',扩增目的片段为766 bp。用超纯水稀释上述提取的总DNA至50 ng/μL,作为PCR模板。PCR反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃再延伸10 min。PCR产物经电泳鉴定,回收目的条带,送苏州金唯智公司测序。
1.6ORF29全基因扩增及测序鉴定 参考ON1毒株ORF29序列(登录号:GU188428)的全基因设计引物。ORF29-F:5'-ATGGTGATTTTCTTCAATC-3',ORF29-R:5'-TCAATGGATGGGATCCCA-3',扩增目的片段在150~200 bp不等。PCR反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃再延伸10 min。PCR产物经电泳鉴定,回收目的条带,连接至pGEM-T easy载体,转化DH5α感受态细胞,然后进行蓝白斑筛选,挑取白斑,PCR鉴定阳性的质粒送苏州金唯智公司测序。
1.7fiber2全基因扩增及序列比对 根据GenBank已公布的f i b e r2全基因设计引物(登录号: GU188428),以病毒总DNA为模板扩增,fiber2全基因为1425 bp,其引物由苏州金唯智生物科技有限公司合成。fiber2序列如下,FAdV-F2-1F:5'-AAGGGGTACCATGCTCCGAGCCCCT-3'(下划线为Kpn I酶切位点);FAdV-F2-1425R:5'-CCCAAGCTTTTACGGGACGGAGGCCG-3'(下划线为Hind III酶切位点)。使用基因组DNA提取试剂盒对收获的病毒进行DNA提取,扩增fiber2全基因片段,回收纯化PCR产物,并连接到pGEM-T easy载体,PCR鉴定阳性的质粒送苏州金唯智公司测序。测序结果与其他腺病毒fiber2全基因序列进行同源性对比。
1.8病毒含量测定 取传代第三次的鸡胚尿囊液进行有限稀释,卵黄囊接种7日龄鸡胚,放置37℃温箱中,每天照胚2次,记录胚死亡时间。在接种后d 7,对未致死的鸡胚各收获200 μL尿囊液,分别提取DNA,应用PCR方法鉴定hexon基因。根据Reed-Muench方法分别计算病毒含量,以半数鸡胚致死量(ELD50/mL)计算。
1.9动物攻毒试验 用无菌PBS稀释纯化的JS7病毒至103ELD50/100μL,经胸部肌肉注射3周龄SPF鸡,之后置于正压隔离器中,观察14 d,记录攻毒组发病情况和致死率。取病死鸡的心脏、肝脏、脑、脾脏、肺脏、肾脏、胰脏、法氏囊、十二指肠、盲肠、胸腺等组织,分别称取100μg组织样品,利用上海生工DNA试剂盒提取病毒基因组DNA,PCR方法鉴定hexon基因,确定病毒在鸡体内的分布;另取1份组织用10%中性福尔马林固定,制作H&E切片,观察各脏器病变。
2 结果
2.1鸡胚分离结果 将疑似心包炎-包涵体肝炎发病鸡群中的肝脏样品经RT-PCR和PCR鉴定,排除禽流感、新城疫、产蛋下降综合征、鸡传染性贫血、马立克氏病、鸡传染性支气管炎等病毒感染,仅hexon基因PCR为阳性,条带大小为766 bp(图1)。经测序证明,该分离株为I群腺病毒(FAdV)血清4型,命名为JS7株。
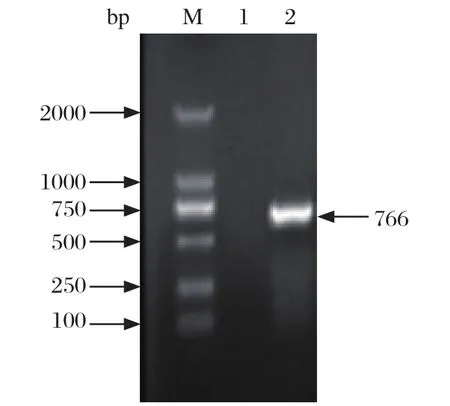
图1 hexon基因PCR结果Fig. 1 Amplifi cation of hexon gene by PCR
分离株经60℃和BUDR、NaOH(pH10)处理1 h后,接种鸡胚,鸡胚无死亡,正常发育,肝脏DNA检测PCR为阴性,表明分离株核酸类型为DNA,病毒不耐碱,对热敏感,60℃ 1 h可灭活病毒。然而,经乙醚、氯仿和盐酸(pH3)处理的毒株,不影响病毒在鸡胚中的增殖,出现鸡胚死亡,肝脏明显病变,PCR检测为阳性。这表明该分离株无脂质囊膜,耐酸,对乙醚和氯仿有抵抗力。
将该病料接种SPF鸡胚,d5出现死亡,d6~7死亡达到高峰。死亡鸡胚的胚体与正常鸡胚相比,显得瘦小、发育不良、体表潮红,胚体有大量出血点;绒毛尿囊膜有不同程度地增厚,呈灰白色云雾状;鸡胚肝脏出血,有的肝脏呈黄褐色,表面有坏死灶(图2)。

图2 鸡胚死亡及病变结果Fig. 2 The challenge results in embryonated SPF eggs
2.2ORF29基因序列比对 与2013年国内分离的强毒株JSJ13株相比,JS7分离株ORF29基因有33 nt的缺失,该段缺失与经典毒株ON1毒株相同(图3)。
2.3fiber2全序列比对分析 对经尿囊液纯化的病毒提取DNA,PCR扩增fiber2基因,对该基因进行测序,将序列与GenBank中登录的部分同源序列进行BLAST比对。结果发现,该基因与I群禽腺病毒C亚群血清4型同源性较高,再次证明该分离株属于FAdV-C血清4型。利用Mega6软件绘制fiber2的系统进化树,由图4可见,FAdV-C血清4型病毒的fiber2基因可分为2个分支,与JSJ3相似的是,该分离株位于Group II分支上(图4)。
2.4动物攻毒试验 取经4次传代纯化的鸡胚尿囊液,病毒滴定结果显示,效价为1.58×105ELD50/mL。将该病毒稀释成1×103ELD50/100μL,经胸肌注射5只3周龄SPF鸡,在攻毒后d 3,所有鸡均开始发病,表现为精神萎靡,羽毛蓬乱无光泽,白色水样下痢。4~7 d内,4只死亡,1只康复。对4只病死鸡进行剖检,结果可见,所有病死鸡肝脏质脆、肿大;心包积有淡黄色清亮透明渗出液;脾脏发黑,出血严重;腺胃粘膜脱落、糜烂;十二指肠粘膜脱落、出血;盲肠出血严重,肾脏肿大、出血。部分肝脏呈现土黄色,表面有出血斑或出血点(图5)。
2.5PCR检测组织脏器分布 采集病死鸡的脏器组织,提取基因组DNA,经hexon特异性PCR检测发现,该毒株在雏鸡体内分布广泛,能侵染雏鸡心脏、肝脏、脾脏、肺脏、肾脏、气管、法氏囊、脑、十二指肠、盲肠、腺胃、胸腺、胰脏等内脏器官(图6)。
2.6肝脏组织病理变化 对正常鸡和病死鸡肝脏组织分别进行固定、包埋、切片、H&E染色,在显微镜下观察。结果显示,正常鸡肝脏细胞纹理清晰,核致密,分布均匀;病死鸡的肝脏组织无正常纹理,核浓染,大量肝细胞核内出现典型的嗜碱性包涵体(图7)。肺脏、肾脏、脾脏、腺胃等其他组织脏器也有程度不同的病变(数据未显示)。

图3 FAdV JS7株与其他毒株的ORF29基因序列对比结果Fig. 3 The alignment of ORF29 gene between JS7 and other FAdV strains
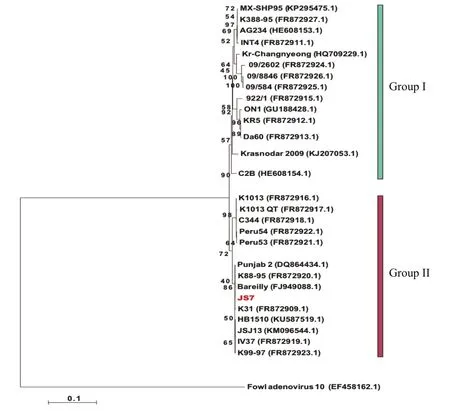
图4 基于FAdV血清4型fi ber2基因构建的系统进化树Fig. 4 Phylogenetic tree based on the fi ber2 gene sequence of serotype 4 FAdV
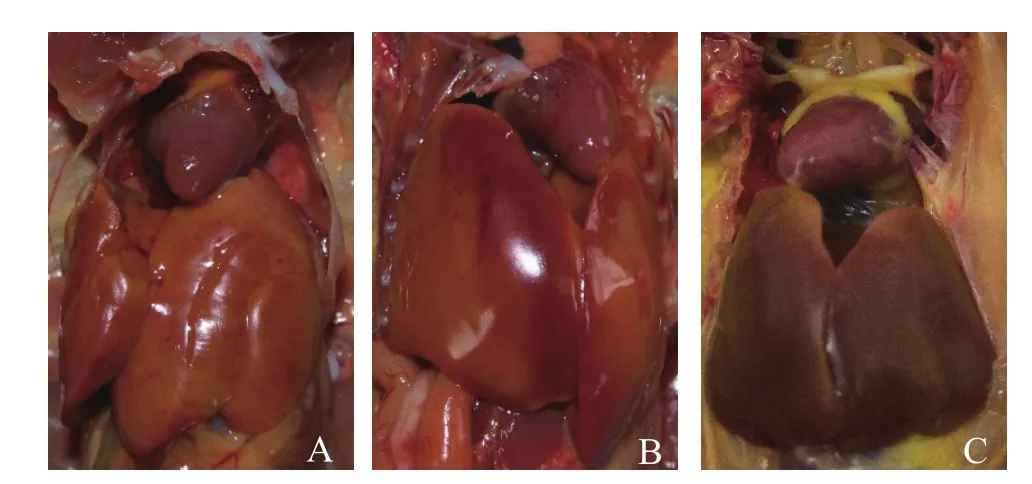
图5 JS7分离株感染SPF鸡产生的心包炎-包涵体肝炎病变Fig. 5 The lesions of hydropericardium-hepatitis syndrome in chickens infected with JS7

图6 JS7分离株感染SPF鸡后各组织脏器的PCR鉴定结果Fig. 6 Amplifi cation of hexon gene from the tissue samples
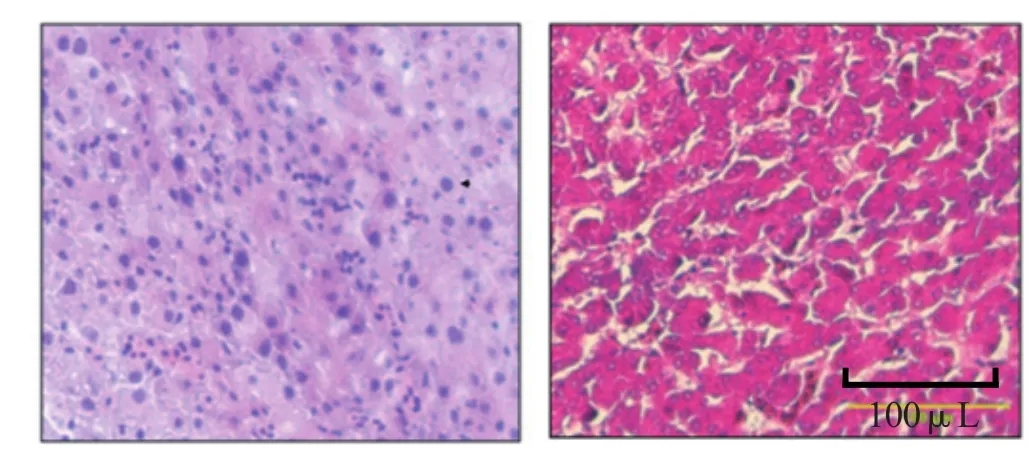
图7 JS7分离株感染SPF鸡后肝脏组织的病理变化Fig. 7 Hisopathological changes in the liver of SPF chickens infected with strain JS7
3 讨论
I群禽腺病毒共有12个血清型,能引发鸡包涵体肝炎的多见于血清1~5、7、8、10型。不同血清型对禽类的致病性各不相同[8-11]。一直以来,禽腺病毒被认为是一种条件性致病病毒,并不能单独引起包涵体肝炎和心包炎症状。然而,自2013年以来,尤其是2015年夏秋季,国内养鸡场出现大量类似病例[5]。
本研究从江苏省某养鸡场分离获得1株可导致鸡心包炎-包涵体肝炎症状的新型禽腺病毒,该分离株不具备凝集鸡、鸭、鼠、兔、绵羊红细胞的能力,耐酸、不耐碱,对热敏感,基本特征符合禽腺病毒的生物学特性。随后,经鸡胚卵黄囊接种增殖和纯化该病毒,能够造成鸡胚停止发育、出血、死亡,引发明显的鸡胚肝脏损伤,出现黄白色坏死或明显出血症状。对其中3种基因(hexon、ORF29和fiber2)进行PCR扩增,对比GenBank已经登录的I群禽腺病毒相关序列,鉴定出该病毒为I群禽腺病毒血清4型分离株。
通过比对fiber2基因全长序列,该分离株与最近在国内流行的强毒株均属于一个簇(Group II)中。ORF29基因测序发现,该分离株与最近流行的国内强毒株不一致,而与早期分离的ON1毒株缺失位置完全相同。动物回归试验结果显示完全复制出临床上的包涵体肝炎、心包炎等症状,且病毒在组织脏器中分布广泛,致死率为80%,发病率为100%。这些生物学特性及分子生物学特征表明,该分离株为I群禽腺病毒血清4型新型变异株,这一结果为下一步研制新型疫苗,并用于诊断和防控该病蔓延发挥了重要的作用。
[1] 殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 科学出版社,1997.
[2] Choi K S, Kye S J, Kim J Y, et al. Epidemiological investigation of outbreaks of fowl adenovirus infection in commercial chickens in Korea[J]. Poult Sci, 2012, 91(10): 2502-2506.
[3] Reece R L, Barr D A, Grix D C. Pathogenicity studieswith a strain of fowl adenovirus serotype 8 (VRI-33) in chickens[J]. Aust Vet J, 1987, 64(12): 365-367.
[4] Okuda Y, Ono M, Yazawa S, et al. Experimental infection of specific-pathogen-free chickens with serotype-1 fowl adenovirus isolated from a broiler chicken with gizzard erosions[J]. Avian Dis, 2001, 45(1): 19-25.
[5] Grgic H, Yang D H, Nagy E. Pathogenicity and complete genome sequence of a fowl adenovirus serotype 8 isolate[J]. Virus Res, 2011, 156(1-2): 91-97.
[6] Asthana M, Chandra R, Kumar R. Hydropericardium syndrome: current state and future developments[J]. Arch Virol, 2013, 158(5): 921-931.
[7] Zhao J, Zhong Q, Zhao Y, et al. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China[J]. PLoS One, 2015, 10(7): e0133073.
[8] Ye J, Liang G, Zhang J, et al. Outbreaks of serotype 4 fowl adenovirus with novel genotype, China[J]. Emerg Microbes Infect, 2016, (5): e50.
[9] 袁万哲, 李玉保, 王建昌, 等. 鸡心包积液-肝炎综合征的初步研究[J]. 中国兽医科学, 2016, 46(2): 157-160.
[10] 国纪垒, 刁有祥, 薛耳兑, 等. I群腺病毒山东株的分离鉴定及hexon基因的克隆与分析[J]. 中国兽医学报, 2012,32(12): 1773-1774.
[11] 国纪垒, 刁有祥, 程彦丽, 等. I群禽腺病毒血清10型的致病性[J]. 中国兽医学报, 2013, 33(8): 1179-1183.
ISOLATION AND CHARACTERIZATION OF GROUP I FOWL ADENOVIRUS SEROTYPE 4 VARIANT STRAIN OF INCLUSION BODY HEPATITIS VIRUS
IN CHICKENS
WANG Kai1,2, CAI Xiao-yao1,3, YE Jian-qiang3, LIU Hong-mei2, ZHANG Quan3,LIU Qin-fang1, LI Ze-jun1, CHEN Hong-jun1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036, China; 3. Veterinary Medicine College, Yangzhou University, Yangzhou 225009, China)
In this study, a new strain of Fowl adenovirus (FAdV) was isolated in chickens with the lesion of the Hydropericardiumhepatitis syndrome (HHS), which spread in China and had a great loss in chickens in 2015. The liver samples were collected and the genomic DNAs were extracted and identified by polymerase chain reaction (PCR). Then, the samples were passaged in 7 days-old specifi c-pathogen-free (SPF) chicken embryonated eggs for four times. By sequencing the specifi c PCR product of hexon fragment, the virus was characterized as FAdV, designated as JS7 strain, which was classifi ed into group I Fowl adenovirus serotype 4 (FAdV-4). The analysis of ORF29 and the full length of fi ber2 confi rmed that the isolate was a novel variant strain. To check the pathogenicity of the virus in chickens, 21-days-old SPF chickens were challenged with 1000 ELD50 of strain JS7 intramuscularly. At 5 days-post-challenge (dpc), it caused 4 out of 5 chickens dead, which showed that the mortality rate had reached 80 %. The samples from heart, liver, spleen,lung, kidney, trachea, bursa, brain, duodenum, colon, glandular stomach, thymus and pancreas were collected and the DNAs were extracted, respectively. All of them were positive by PCR method. The tissues above were fi xed and identifi ed with Hematoxylin& Eosin (H & E) staining. Compared to the slices of normal chickens, a lot of typical basophilic nuclear inclusion bodies were shown in hepatic cells of dead chickens. These data demonstrated that strain JS7 had a high pathogenicity and extensive tissue tropism in chickens.
Inclusion body hepatitis; Fowl adenovirus(FAdV); fi ber2; isolation; identifi cation
S852.659.1
A
1674-6422(2016)04-0001-06
2016-05-03
国家自然基金面上项目(31572502);中国农业科学院动物流感病毒病原生态学创新团队专项经费
汪凯,男,学士,动物医学专业
陈鸿军,E-mail:vetchj@shvri.ac.cn

