HPLC-ELSD法测定黄精炮制过程中四种糖的含量△
常亮,陈珍珍,吴毅,丁银平
(江西省药品检验检测研究院,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029)
HPLC-ELSD法测定黄精炮制过程中四种糖的含量△
常亮,陈珍珍,吴毅*,丁银平
(江西省药品检验检测研究院,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029)
目的:比较三种黄精炮制过程中四种糖的含量变化。方法:采用HPLC-ELSD法对三种黄精不同炮制过程中果糖、葡萄糖、蔗糖、水苏糖含量进行测定。色谱柱为奥泰PrevailTMCarbohydrate ES柱(250 mm × 4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱;流速为0.9 mL·min-1;柱温为35 ℃;漂移管温度为105 ℃;载气流速为2.5 L·min-1。结果:果糖和葡萄糖含量随炮制时间增加而增加,蔗糖含量基本不变,水苏糖含量随炮制时间增加而减少。结论:不同炮制方法炮制过程中糖类成分的变化有差异,为进一步揭示黄精的炮制机理提供参考。
黄精;炮制过程;糖;高效液相色谱-蒸发光散射法
黄精(Polygonati Rhizoma)为百合科黄精属植物的根茎,具有补气养阴、健脾、润肺、益肾等功能,是中医临床上常用的补虚药。《中华人民共和国药典》2010版一部收载了黄精的三个来源,分别为滇黄精PolygonatumkingianumColl et Hemsl.、黄精P.sibiricumRed.或多花黄精P.cyrtonemaHua的干燥根茎,按形状不同分别习称为大黄精、鸡头黄精、姜形黄精[1]。黄精所含化学成分丰富,主要有黄精多糖[2]、甾体皂苷[3]和木脂素类[4]等成分。亦有文献[5]研究了黄精中小分子糖的分离纯化的相关技术。传统认为,黄精如果不炮制或炮制不合理,很可能就会引起某些副作用,临床上不应使用生黄精,而应用制黄精或酒黄精。通过炮制,一方面可制其副作用,消除麻味,减轻对咽喉的刺激;另一方面可提高黄精的临床疗效,增强药物补脾润肺、益肾的作用。黄精的炮制方法主要有《中华人民共和国药典》收载的酒蒸法或酒炖法,而江西建昌药帮则采用传统的炆法进行黄精的炮制。有文献[6]认为,黄精在炮制过程中粘液质被大量除去,水解生产了葡萄糖和果糖。为了研究黄精炮制过程中糖类成分的变化情况,本文采用HPLC-ELSD法测定酒蒸法和炆法两种炮制过程中果糖、葡萄糖、蔗糖和水苏糖4种糖的含量,以进一步证实黄精炮制的机理。
1 仪器和试药
1.1 仪器
Agilent 1100高效液相色谱仪(G1311A四元泵、G1313A标准自动进样器、G1316A柱温箱);Alltech ELSD 2000ES型蒸发光散射检测器(Allchrom Plus Client/sever 工作站);Sartorius BT25S型十万分之一电子天平;KQ-500E型超声波清洗仪(昆山市超声仪器有限公司,功率250 W,频率25 kHz)。
1.2 试药
3个品种的黄精药材均购自江西省樟树市药材市场,经江西中医药大学药学院付小梅副教授鉴定,分别为百合科植物滇黄精PolygonatumkingianumColl et Hemsl.、黄精P.sibiricumRed.或多花黄精P.cyrtonemaHua的干燥根茎。
果糖对照品、葡萄糖对照品、蔗糖对照品(中国食品药品检定研究院,批号分别为100231-200904,110833-201205,111507-201303);水苏糖对照品(天津一方科技有限公司,批号:BBT0176,含量>98%);乙腈(HPLC级,美国SPS公司);娃哈哈纯净水;其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱为奥泰PrevailTMCarbohydrate ES柱(250 mm × 4.6 mm,5 μm);流动相A为乙腈,流动相B为水,梯度洗脱程序:0~10 min:75%A,10~35 min:75%~60%A,35~35.01 min:60%~0%A,35.01~45 min:0%A,45~45.01 min:0%~75%A,45.01~55 min:75%A;流速:0.9 mL·min-1;柱温:35 ℃;进样量:5 μL。ELSD条件:漂移管温度为105 ℃;载气流速为2.5 L·min-1。
2.2 不同黄精炮制品的制备
炆法黄精:取净黄精药材,用清水漂1 d,取出,沥干,放入炆药罐内炆24 h(此处考察炆法时间),至药熟透汁尽,取出,50 ℃干燥,加20%黄酒喷洒均匀,闷润,待酒吸尽,蒸制4 h,焖一夜,取出,放入烘箱内50 ℃干燥,低温粉碎,过40目筛,备用[7]。
蒸法黄精:取黄精药材,净选后,加20%黄酒喷洒均匀,闷润,待酒吸尽,蒸制24 h(此处考察蒸法时间),取出,稍晾,拌回蒸液,再晾至六成干,放入烘箱内50 ℃干燥,低温粉碎,过40目筛,备用[7]。
2.3 溶液的制备
2.3.1 对照品溶液制备 取果糖、葡萄糖、蔗糖、水苏糖对照品,加水制成每毫升含果糖2.0 mg,葡萄糖、蔗糖、水苏糖各0.4 mg的混合溶液。
2.3.2 供试品溶液制备 分别取上述两种不同炮制方法炮制一定时间后的黄精粉末约1 g,精密称定,加水50 mL,称定重量,超声处理(功率500 W,频率40 kHz)40 min,取出,放冷,用水补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4 系统适用性试验
按2.1项下色谱条件,分别精密吸取对照品溶液和供试品溶液(鸡头黄精,蒸法2 h)各5 μL,注入高效液相色谱仪,测定,记录色谱图,见图1。供试品色谱图中呈现与对照品色谱峰保留时间一致的色谱峰,分离度良好,色谱条件可行。
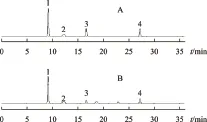
注:A.对照品;B.供试品(鸡头黄精,蒸法2 h);1.果糖;2.葡萄糖;3.蔗糖;4.水苏糖。图1 黄精高效液相色谱图
2.5 线性关系考察
精密吸取2.3.1项下对照品溶液,按进样体积2、3、5、7、10 μL,依次进样,测得色谱峰面积,以进样量(μg)的对数(Lg值)为横坐标,峰面积的对数(Lg值)为纵坐标进行线性回归,得曲线方程,果糖:Y=1.498 1X+5.688 4,r=0.994 2;葡萄糖:Y=1.538 5X+5.948 4,r=0.998 6;蔗糖:Y=1.758 9X+6.159 1,r=0.996 1;水苏糖:Y=1.720 6X+6.144 3,r=0.995 7,各标准曲线在线性范围内线性关系良好。
2.6 精密度试验
精密吸取2.3.1项下对照品溶液各5 μL,连续进样6次,在2.1项下色谱条件测定,记录峰面积,测得峰面积对数值的RSD分别为果糖1.5%、葡萄糖1.2%、蔗糖2.3%、水苏糖2.1%。
2.7 稳定性试验
精密吸取同一供试品(鸡头黄精,蒸法2 h)溶液5 μL,分别在0、3、6、9、12、15 h进样,测定峰面积,测得峰面积对数值的RSD分别为果糖1.1%、葡萄糖1.6%、蔗糖2.0%、水苏糖2.6%,表明供试品溶液15 h内稳定。
2.8 重复性试验
取同一黄精样品(鸡头黄精,蒸法2 h)各5份,按照2.3.2项下方法制备供试品溶液,按2.1项下色谱条件测定,记录峰面积,根据标准曲线计算含量,结果RSD分别为果糖1.8%、葡萄糖2.0%、蔗糖1.3%、水苏糖3.2%,表明该方法重复性良好。果糖、葡萄糖、蔗糖、水苏糖的平均质量分数分别为55.2、13.8、11.1、8.4 mg·g-1。
2.9 检测限
取对照品溶液,分别按适当比例逐级稀释后进行测定。当信噪比为3时,果糖的检测限为0.3 μg、葡萄糖为0.4 μg、蔗糖为0.2 μg、水苏糖为0.2 μg。
2.10 加样回收试验
取已知含量的黄精样品(鸡头黄精,蒸法2 h)各6份,精密称定,分别精密加入混合对照品溶液(质量浓度分别为果糖1.10 mg·mL-1、葡萄糖0.25 mg·mL-1、蔗糖0.22 mg·mL-1、水苏糖0.16 mg·mL-1)各10 mL,加水40 mL,称定重量,超声处理40 min,取出,放冷,用水补足减失的重量,摇匀,滤过,取续滤液,按照2.1项下色谱条件进样,测定各糖含量,并计算加样回收率,结果见表1。表明此方法准确度较好。
2.11 样品测定结果
2.11.1 炆法 分别取炮制时间为0、2、4、8、12、16、24 h的三种黄精样品,按照2.3.2项下方法制备供试品溶液,在2.1项下色谱条件测定,记录峰面积,根据标准曲线计算含量,结果见表2。
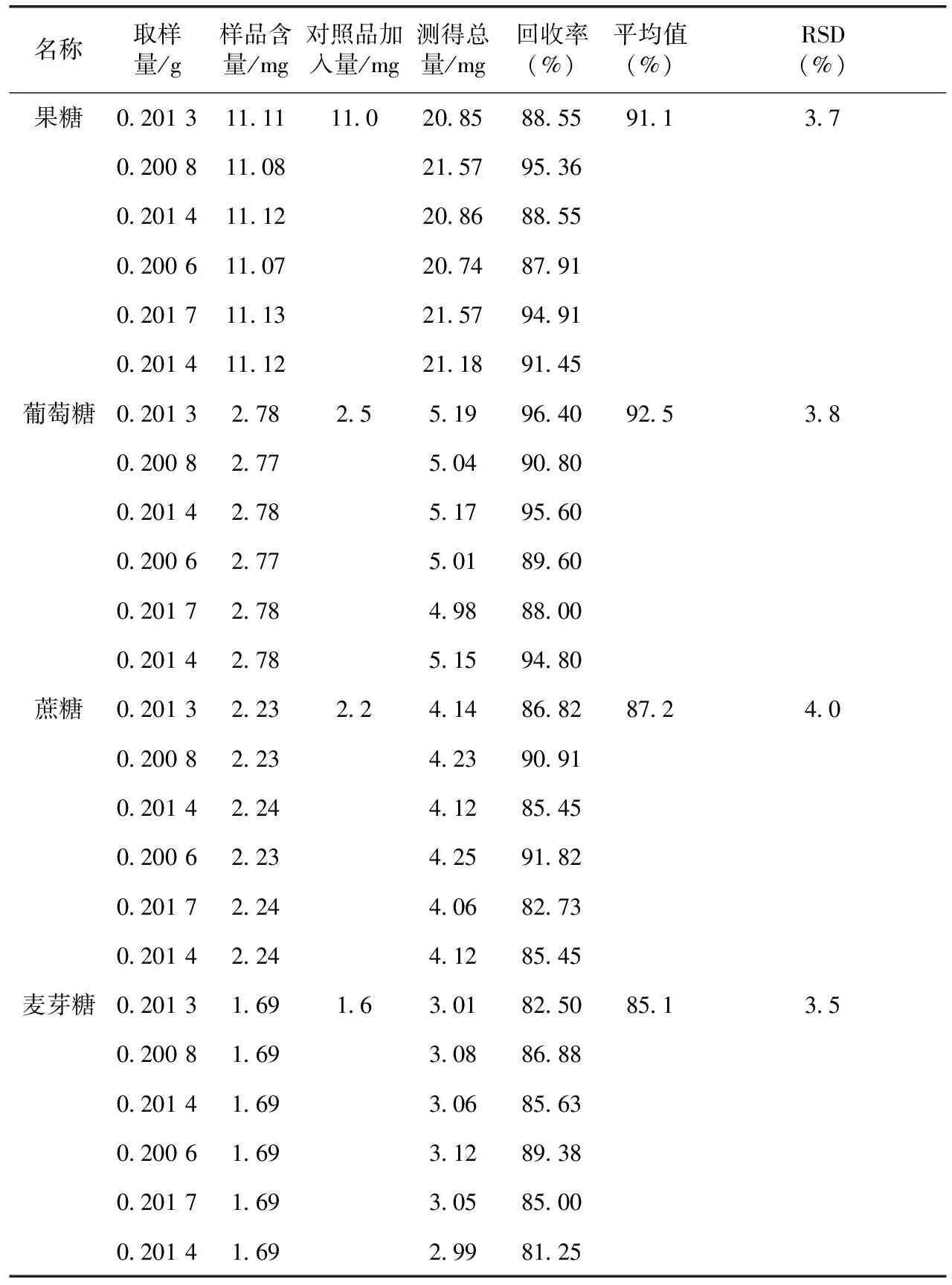
表1 4种糖的回收率试验(n=6)
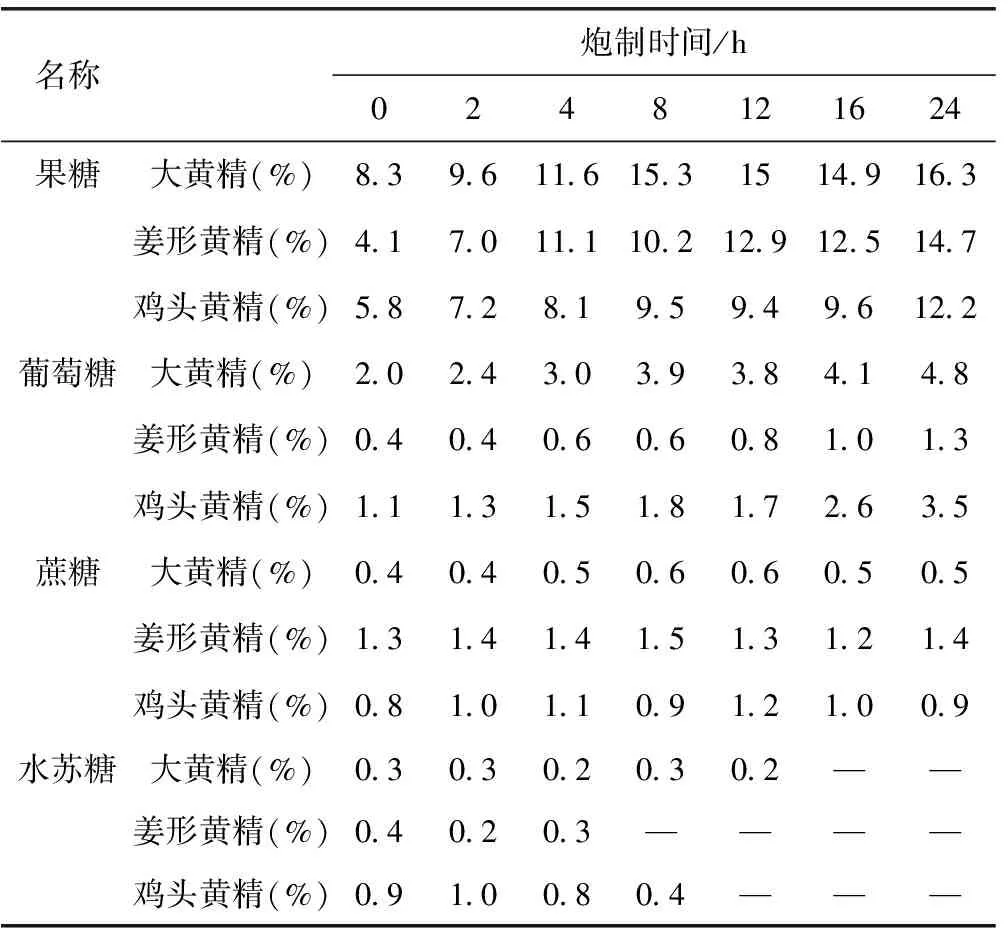
表2 炆法炮制三种黄精中四种糖含量
2.11.2 蒸法 分别取炮制时间为0、2、4、8、12、16、24 h的三种黄精样品,按照2.3.2项下方法制备供试品溶液,在2.1项下色谱条件测定,记录峰面积,根据标准曲线计算含量,结果见表3。
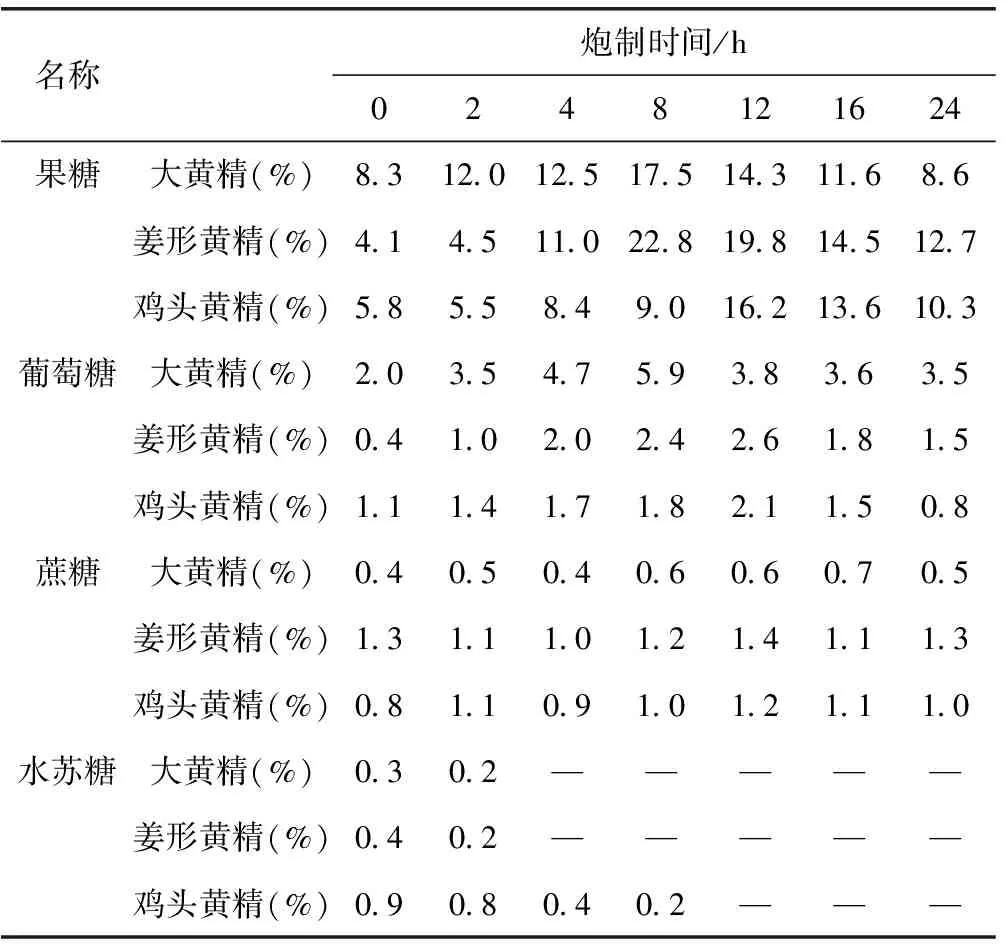
表3 蒸法炮制三种黄精中四种糖含量
2.12 黄精炮制前后色谱图
三种黄精在炮制前后色谱情况见图2。
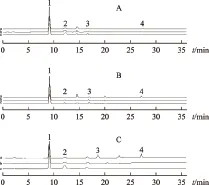
注:A.大黄精;B.姜形黄精;C.鸡头黄精;a.炮制前;b.蒸法24 h;c.炆法24 h;1.果糖;2.葡萄糖;3.蔗糖;4.水苏糖。图2 三种黄精炮制前后色谱图
3 讨论
3.1 色谱条件选择
3.1.1 色谱柱选择 以2.1项下色谱条件考察2根糖分析色谱柱,色谱柱1:Waters -NH2柱(250 mm×4.6 mm,5 μm),色谱柱2:奥泰PrevailTMCarbohydrate ES柱(250 mm×4.6 mm,5 μm),结果色谱柱2基线平稳,色谱峰形态和分离较好。
3.1.2 流速选择 以2.1项下色谱条件考察流动相流速,分别为1.0、0.9、0.8 mL·min-1。结果当流速为1.0 mL·min-1时,柱压较大,葡萄糖、果糖、蔗糖色谱峰较靠近,影响积分结果;当流速为0.8 mL·min-1时,所需分离时间长,峰宽增加,综合分析将流速定为0.9 mL·min-1。
3.2 供试品溶液制备条件选择
由于小分子糖在水中溶解度高,多以水作为提取溶剂。本文考察了水作为提取溶剂,体积分别为25、50、100 mL时,按2.3.2项下制备条件制备并测定,结果含量基本一致。由于提取溶剂为25 mL时,制备的溶液较为黏稠,不易滤过;提取溶剂为100 mL时,一些峰面积过小,不易积分或积分误差大,故选择50 mL作为提取溶剂体积。
3.3 蒸法炮制和炆法炮制过程中单糖含量变化
在蒸法炮制过程中,随炮制时间增加,果糖含量往往先上升,在炮制8~12 h左右达到峰值,随后出现含量下降;大黄精及鸡头黄精的葡萄糖含量与果糖变化趋势类似,但姜形黄精中葡萄糖含量则为一个先上升后下降再上升复下降的波浪过程。说明黄精在高温加热的炮制环境中,一方面,含有的粘液质等多糖类成分发生水解,变成了果糖、葡萄糖等单糖类成分;另一方面,含有的单糖类成分与氨基酸类成分发生Maillard(美拉德)反应。Maillard反应又称为非酶褐变反应,它是指羰基化合物(主要为还原糖类)与氨基化合物(如氨基酸、蛋白质等)之间发生的反应,造成了单糖含量先增加后减少的变化过程。而炆法炮制过程中,果糖和葡萄糖均表现为随炮制时间增加含量也相应增加,说明粘液质等多糖成分发生水解,变成了果糖、葡萄糖等单糖类成分。从而说明蒸法炮制和炆法炮制过程中发生的化学反应有差异。
3.4 蒸法炮制和炆法炮制过程中双糖及四糖含量变化
三种黄精在两种炮制方法中,作为二糖的蔗糖含量变化均不大,可能是未参与反应;作为四糖的水苏糖含量呈下降趋势,则进一步证明了黄精炮制过程中多糖水解生成单糖,一方面制其副作用,消除麻味,减轻对咽喉的刺激;另一方面增加黄精的药物补脾润肺、益肾的作用。通过上述研究,说明了黄精通过炮制达到减毒增效目的的物质变化过程,进一步揭示了黄精的炮制机理。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010.
[2] 方圆.黄精多糖和低聚糖的分离与结构解析[M].无锡:江南大学:2011.
[3] 王冬梅,朱玮,张存莉,等.卷叶黄精总皂苷含量测定方法及提取工艺研究[J].西北林学院学报,2006,21(3):107-110.
[4] 孙隆儒,李铣.黄精化学成分的研究(Ⅱ)[J].中草药,2001,32(7):586-588.
[5] 王彦志,董晶晶,杨云,等.黄精低聚糖的分离纯化及理化性质研究[J].中成药,2011,33(10):1831-1833.
[6] 钟凌云,龚千峰,张的凤,等.黄精炮制研究现状分析[J].中药材,2007,30(12):1618-1621.
[7] 江西省食品药品监督管理局.江西省中药饮片炮制规范[S].上海科学技术出版社,2009.
DeterminationofFourSaccharidesinPolygonatumProcessingbyHPLC-ELSD
CHANG Liang,CHENZhenzhen,WUYi*,DINGYinping
(JiangxiProvincialInstituteforDrugControl,JiangxiProvincialEngineeringResearchCenterforDrugandMedicinalDeviceQuality,Nanchang330029,China)
Objective:To compare the contents of four saccharides in three speciesPolygonatumin processing.Methods:An analytical method for determination of four saccharides inPolygonatumprocessing by HPLC-ELSD was established.The chromatographic separation was achieved on a PrevailWTCarbohydrate ES column with a mobile phase which was composed of acetonitrile(A)and water(B)for gradient elution.The flow rate was 0.9 mL·min-1.The column temperature was 35 ℃.The ELSD drift tube temperature was set at 105 ℃,and nitrogen flow was maintained at 2.5 L·min-1.Results:The contents of fructose and glucose increased with the increase of processing time,sucrose content remained unchanged,stachyose content decreased with the increase of processing time.Conclusion:The changes of saccharides in three speciesPolygonatumsin two processing methods are different,this can provide scientific basis for the processing mechanism forPolygonatums.
Polygonatum;processing method;saccharide;HPLC-ELSD
2015-09-02)
江西省科技厅自然科学基金项目(20122BAB205075)
*
吴毅,博士,副主任中药师,研究方向:药品质量控制与安全性研究;Tel:(0791)86217386,E-mail:wuyijx@126.com
10.13313/j.issn.1673-4890.2016.12.027

