Ca2+对酸橙幼苗低温胁迫下抗逆生理指标的影响△
梁永富,王康才,隋利,薛启,叶军,陈兴忠
(1.南京农业大学 园艺学院,江苏 南京 210095;2.泰州市林业技术指导站,江苏 泰州 225300)
Ca2+对酸橙幼苗低温胁迫下抗逆生理指标的影响△
梁永富1,王康才,隋利1,薛启1,叶军2,陈兴忠2
(1.南京农业大学 园艺学院,江苏 南京 210095;2.泰州市林业技术指导站,江苏 泰州 225300)
分析Ca(NO3)2对低温胁迫下酸橙幼苗抗逆生理指标的影响,探讨Ca(NO3)2对酸橙幼苗低温胁迫调控的可行性。该实验以盆栽酸橙幼苗为材料,叶面喷施5、10、15、20、25mmol·L-1的Ca(NO3)2溶液,置于4℃/0℃(昼/夜),光照为600 μmol·m-2·s-1的人工气候箱内,以常温25℃喷施蒸馏水和低温胁迫下喷施蒸馏水为对照,处理3d后,测定酸橙幼苗POD、SOD和CAT酶活性、可溶性蛋白含量、脯氨酸含量、MDA含量、相对电导率和叶绿素含量。结果表明,低温胁迫下叶面喷施Ca(NO3)2溶液可提高酸橙幼苗叶片POD、SOD和CAT酶活性,显著提高可溶性蛋白和脯氨酸等渗透调节物质的含量,降低细胞MDA含量和相对电导率,减缓叶绿素下降的趋势,提高了叶片光合效率。叶面喷施一定浓度Ca(NO3)2溶液可减轻低温胁迫对酸橙幼苗叶片的伤害。
Ca(NO3)2;酸橙;低温胁迫
芸香科植物酸橙CitrusaurantiumL.是中药材枳壳的基原植物,也是一种经济及观赏价值较高的果树。枳壳类药材以枳实之名始载于《神农本草经》[1],具有理气宽中、行滞消胀的功效,为常用理气药。现代医学研究表明,枳壳粗提物具有抗肿瘤[2]、降血脂[3]等作用。酸橙主要分布于浙江、贵州、江西、四川、江苏等长江以南各省[4],现市场上流通的酸橙类枳壳主产于江西、浙江和四川等地。枳壳依产地分为川枳壳、湘枳壳、江枳壳、苏枳壳、温枳壳五类[5]。苏枳壳主产于江苏,曾经有一定产量,现在在市场上基本消失。为了让苏枳壳重新形成产量,江苏泰州对酸橙进行引种,但在引种的过程中发现,酸橙叶片受冬季低温的影响,会出现枯黄掉落的现象,低温还影响了初春时节酸橙的花芽分化,导致枳壳类药材产量下降。因此,如何减轻低温对酸橙造成的伤害,增强酸橙对低温胁迫的抗逆性,对提高枳壳类药材产量具有重要意义。
Ca2+作为细胞信号传导过程中的第二信使,在植物细胞膜感受到寒冷胁迫信号后,能够将信号快速传递到胞内,并引起胞内相应的生理化学反应,减轻低温对植物的伤害[6-8]。研究表明,喷施外源Ca2+可以提高植物的抗逆性,增强植物对低温环境的适应性[9-11]。CaCl2作为Ca2+的常用钙盐,其在低温环境下对植物抗寒性的提高已得到了证实[12],但酸橙是中度耐盐植物,Cl-对其会造成阴离子伤害[13-15]。Ca(NO3)2可以代替CaCl2处理柑橘类植物,提高其抗寒性[16-17]。本文根据酸橙栽培过程中遇到的实际问题,研究低温胁迫下,叶面喷施不同浓度Ca(NO3)2对酸橙幼苗叶片生理生化特性的影响,包括细胞膜透性、膜脂过氧化产物丙二醛含量和渗透物质含量等,以探讨Ca(NO3)2与酸橙幼苗抗寒能力的关系,以期为酸橙栽培技术的改进提供依据。
1 材料
供试材料由湖南程锦农业科技开发有限公司提供,经南京农业大学中药材科学系王康才教授鉴定为芸香科植物酸橙CitrusaurantiumL.
2 方法
2.1 实验设计
试验于2015年9月至11月在南京农业大学温室内进行。于2015年9月1日选取生长基本一致、无病虫害、高10 cm左右的酸橙幼苗进行盆栽,盆高16 cm×直径14 cm的塑胶盆中。栽培基质是蛭石:营养土为2∶1的混合物,基质体积约为花盆体积的80%,每盆4株。常规水肥管理,每5 d浇水一次,每次浇水量为150 mL,缓苗1个月后进行外源Ca2+和低温胁迫处理。选用Ca(NO3)2代替Ca2+处理酸橙幼苗,Ca(NO3)2设计5,10,15,20,25 mmol·L-15个浓度。于2015年10月1日至3日18∶00对酸橙进行叶面喷施,以叶面的正反面浸润、向下滴液为度,每处理4盆。连续喷施3 d,第3 d喷施生长调节剂2h后,将幼苗连同塑胶盆放入人工气候箱(QHX-800L人工气候箱,金坛市良友仪器有限公司)中进行低温胁迫处理,温度为4 ℃/0 ℃(昼/夜),光照为600 μmol·m-2·s-1,同时设置2组对照,对照CK1为置于温度为25 ℃/23 ℃(昼/夜),喷施蒸馏水;CK2为低温胁迫,喷施蒸馏水。低温处理3 d后,于2015年10月3日取出苗木在室温下恢复24 h后进行相关生理指标测定。
2.2 相关生理指标
测定可溶性蛋白含量测定采用Bradford考马斯亮蓝G-250染色法;脯氨酸含量测定采用茚三酮法;丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法;超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性测定分别采用氮蓝四唑(NBT)法和高锰酸钾滴定法;过氧化物酶(POD)活性测定采用愈创木酚法;叶绿素含量采用乙醇提取分光光度法;相对电导率采用电导仪法[18]。
2.3 数据统计与分析
采用Excel 2010和统计软件SPSS 20.0进行统计分析,LSD法检验差异显著性。
3 结果与分析
3.1 Ca(NO3)2对低温胁迫下酸橙幼苗叶片MDA含量和相对电导率的影响
由图1可知,与常温对照CK1相比,低温胁迫下,酸橙幼苗叶片的MDA含量均显著升高,说明细胞膜遭到不同程度低温伤害。而与低温胁迫对照CK2相比,叶面喷施浓度为5,10,15,20和25 mmol·L-1的Ca(NO3)2溶液均显著降低了叶片MDA含量,分别降低了11.35%、16.47%、28.38%、62.43%、35.41%。其中,以浓度为20 mmol·L-1的Ca(NO3)2喷施效果最好,与CK2相比,差异极显著。
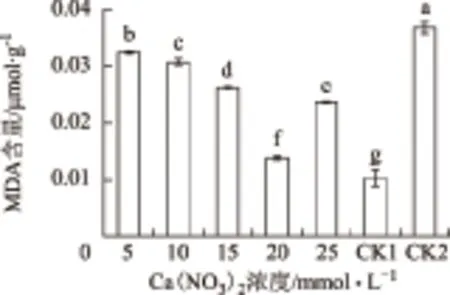
图1-1 Ca(NO3)2对低温胁迫下酸橙幼苗MDA含量的影响

图1-2 Ca(NO3)2对低温胁迫下酸橙幼苗相对电导率的影响
从表1可以看出,与常温对照CK1相比,CK2的相对电导率显著升高了124.23%,说明低温胁迫破坏了酸橙幼苗叶片细胞膜系统的结构与功能,致使相对电导率急剧上升。叶面喷施不同浓度的Ca(NO3)2后,与CK2相比,均出现不同程度的降低了相对电导率,且相对电导率随着Ca(NO3)2浓度的升高而出现呈先升高后降低的趋势。在Ca(NO3)2浓度为20 mmol·L-1时,喷施效果最好,相对电导率较CK2降低45.02%。
3.2 Ca(NO3)2对低温胁迫下酸橙幼苗叶片SOD、POD、CAT活性的影响
由表1可知,经低温胁迫处理后,CK2酸橙幼苗叶片的POD、SOD酶活性较CK1明显降低,分别降低33.17%和13.51%,说明低温胁迫显著抑制了酸橙幼苗叶片的抗氧化酶活性。与CK2相比,叶面喷施不同浓度的Ca(NO3)2溶液,均能显著提高酸橙幼苗叶片POD、SOD、CAT的酶活性。其中以20mmol·L-1的Ca(NO3)2溶液叶面喷施的效果最好,POD、SOD、CAT的酶活性增加率最大,与CK2相比,分别增加了76.95%,16.65%,30.00%。

表1 生长调节剂对低温胁迫下酸橙幼苗叶片抗氧化酶活性的影响
注:同一列不同小写字母表示显著差异,P<0.05(表2同)
3.3 Ca(NO3)2对低温胁迫下酸橙幼苗叶片脯氨酸和可溶性蛋白含量的影响
可溶性蛋白是植物体内重要的渗透调节物质,参与植物的渗透调节过程,低温胁迫下其含量的多少反映了植物对逆境的适应能力。由图2-1可知,低温胁迫下,CK2可溶性蛋白含量明显高于CK1,较CK1提高15.98%,说明低温胁迫下,酸橙可以自发产生某种机制,积累可溶性蛋白,以适应低温环境。与CK2相比,叶面喷施Ca(NO3)2溶液可以进一步提高酸橙幼苗叶片可溶性蛋白含量,且可溶性蛋白含量随着Ca(NO3)2浓度的升高而呈现先升高后降低的趋势。相对于低温处理CK2来说,叶面喷施20 mmol·L-1的Ca(NO3)2效果最好,可溶性蛋白含量增加了68.86%。
脯氨酸也是植物体内重要的调节物质之一,当植物受到环境胁迫时,植物体内的脯氨酸含量就会迅速增加,以减轻环境胁迫对植物造成的伤害,所以脯氨酸的含量在一定程度上反映了植物的抗逆性。由图2-2可以看出,经过低温胁迫处理后,CK2脯氨酸含量较CK1增加了16.11%,说明酸橙幼苗对低温伤害有一定的抵抗力。与CK2相比,叶面喷施10,15,20,25 mmol·L-1的Ca(NO3)2溶液均显著显著提高植物体内脯氨酸含量,分别提高9.90%、15.93%、39.45%、27.07%。其中,以20 mmol·L-1的Ca(NO3)2的喷施效果最好。

图2-1 Ca(NO3)2对低温胁迫下酸橙幼苗可溶性蛋白含量的影响

图2-2 Ca(NO3)2对低温胁迫下酸橙幼苗脯氨酸含量的影响
3.4 Ca(NO3)2对低温胁迫下酸橙幼苗叶片叶绿素含量的影响
由表2可知,经低温处理后,CK2酸橙幼苗光合色素均明显下降,叶片中叶绿素a、叶绿素b、类胡萝卜素和叶绿素总量较CK1分别下降了18.39%、18.78%、26.46%、18.46%,均达显著水平。经不同浓度的Ca(NO3)2处理的酸橙幼苗叶片,相对于低温处理CK2来说,光合色素含量均明显提高,其中以20 mmol·L-1的Ca(NO3)2的处理效果最好,显著减缓了酸橙幼苗光合色素下降的趋势。叶片中叶绿素a,叶绿素b,类胡萝卜素和叶绿素总量较CK2分别提高了22.39%、21.54%、36.30%、27.47%。

表2 生长调节剂对低温胁迫下酸橙幼苗叶片叶绿素含量的影响
4 讨论
4.1 Ca2+对酸橙幼苗渗透调节物质的调节作用
低温伤害是环境胁迫之一,限制了植物的生长。农林业生产中常因低温伤害而导致农作物大幅减产,使生产者蒙受巨大损失。在受到低温胁迫时,植物感受外界环境的低温信号后,通过自身的低温信号转导系统调控植物的生理生化代谢途径,合成有关物质,以减轻低温伤害[19]。脯氨酸和可溶性蛋白是植物体内重要的渗透调节物质,可以增加植物细胞质浓度,降低细胞渗透势和冰点,防止细胞脱水和胞内结冰,从而减轻植物的低温伤害[20]。本研究发现,经过3 d的低温胁迫处理,与CK1相比,CK2酸橙幼苗叶片中可溶性蛋白和脯氨酸含量均显著提高,说明低温对酸橙幼苗造成了伤害,触发了酸橙幼苗的抗冷机制,促使酸橙主动积累可溶性蛋白和脯氨酸,降低细胞渗透势,缓减了酸橙幼苗因低温而导致的细胞失水,一定程度上解轻了酸橙幼苗的低温伤害[19-20]。本实验研究表明,低温胁迫下,与CK2相比,叶面喷施一定浓度的Ca2+溶液,可进一步提高酸橙幼苗叶片可溶性蛋白和脯氨酸含量,有效减轻了低温伤害。这可能是因为Ca2+是第二信使,能够传导低温信息而促进植物抗寒基因的表达[21-24],进而促进植物合成可溶性蛋白和脯氨酸,增加植物抵御低温的能力,这与李国新[25],耿广东[26]等的研究相一致。
4.2 Ca2+对酸橙幼苗抗氧化酶和细胞膜的调节作用
SOP、SOD和CAT是植物体内抗氧化酶,能够快速清除植物体内活性氧(ROS)。正常生长条件下植物体内ROS的产生与其清除系统会保持动态平衡,体内ROS水平低,不会引起细胞膜系统的氧化伤害[27]。本研究发现,在低温胁迫下,与CK1相比,CK2酸橙幼苗叶片中MDA含量和相对电导率显著上升,可能的原因是低温抑制了POD和SOD抗氧化酶活性,致使细胞内ROS的清除机制遭到破坏,导致细胞内ROS含量上升,当ROS的积累超过一定阈值时,就会发生膜脂过氧化,细胞膜的完整性遭到破坏,细胞膜系统的半透性逐步丧失,依赖于膜系统的代谢系统发生紊乱[27],致使细胞内电解质外流,MDA含量和相对电导率显著上升。与CK2相比,叶面喷施浓度为20 mmol·L-1的Ca(NO3)2溶液可以提高POD、SOD和CAT抗氧化酶活性,降低MDA含量和相对电导率。一方面可能是因为Ca2+能够稳定细胞壁、细胞膜和膜蛋白,使细胞膜的代谢系统趋于正常[11],另一方面Ca2+是低温信号转导重要的第二信使,通过与细胞内钙调素(CaM)等钙离子感应器结合,改变不同蛋白质的磷酸化状态,引发各种细胞反应,如合成各种抗氧化酶等生物大分子,从而提高了抗氧化酶活性,加快了细胞内活性氧的清除,增强了植物适应低温环境的能力[21-24]。
4.3 Ca2+对酸橙幼苗叶绿素的调节作用
光合色素是绿色植物进行光合作用的物质基础,光合色素含量的多少一定程度上决定了绿色植物对光的转化效率能的高低。本研究发现,低温胁迫下,与常温对照CK1相比,CK2酸橙幼苗叶片中叶绿素和类胡萝卜素含量显著下降,一方面可能是低温抑制了光合色素合成酶的活性,致使光合色素的合成受阻;另一方面,低温导致光抑制现象的发生,产生的活性氧破坏了叶绿体双层膜和内囊体结构,导致光合色素的分解[28-29]。此外,低温引起的植物代谢缓慢可能会导致合成光合色素的原料减少,造成叶绿素含量的减少[30]。与CK2相比,叶面喷施Ca(NO3)2溶液可提高叶片中光合色素的含量。究其原因,可能是因为Ca2+能够稳定叶绿体双层膜及内囊体结构,同时诱导了光合色素合成酶和抗寒基因的表达,从而使光合色素含量提高。这与邵怡若[31]等的研究相一致。
综上所述,叶面喷施一定浓度的Ca(NO3)2溶液能够提高酸橙幼苗叶片POD、SOD和CAT酶活性,显著提高可溶性蛋白和脯氨酸等渗透调节物质的含量,降低细胞中MDA含量和相对电导率,减缓叶绿素下降的趋势,并最终提高低温胁迫下酸橙幼苗的抗逆性。用Ca(NO3)2溶液处理酸橙幼苗适宜的适宜浓度为20 mmol·L-1。
[1] 中国科学院药物研究所.中药志:第三册[M].北京:人民卫生出版社,1984:42,48.
[2] Sato T,Koike L,Miyata Y,et al.Inhibition of activatorprotein-1 binding activity and phosphatidylinositol 3-Kinase pathway by nobiletin,apolymethoxy flavonoid,results in augmentation of tissue inhibitor ofmetalloproteinases-1 production and suppression ofproduction of matrixmetalloproteinases-1 and-9 in humanfibrosarcoma HT-1080 Cells[J].Cancer Res,2002,62(4):1025-1029.
[3] 周燕文,时雪峰.柚皮苷对实验性2 型糖尿病大鼠的作用研究[J].中国药师,2012,15(4):471-474.
[4] 宋立人,洪恂,丁绪亮,等.现代中药学大辞典[M].北京:人民卫生出版社,2001.
[5] 蔡逸平,陈有根,范崔生.中药枳壳、枳实类原植物调查及商品药材的鉴定[J].中国中药杂志,1999,24(5):259-262.
[6] 陈立松,刘星辉.果树逆境生理[M].北京:中国农业出版社,2003.
[7] 利容千,王建波.植物逆境细胞及生物学[M].武汉:武汉大学出版社,2002.
[8] Medvedev S S.Calcium signaling system in plants[J].Russian Journal of Plant Physiology,2005,52:249-270.
[9] Gao H B,Chen G L,Han L H,et al.Calcium influence on chilling resistance of grafting eggplant seedlings[J].Journal of Plant Nutrition,2004,27:1327-1339.
[10] 蒋廷惠,占新华,徐阳春,等.钙对植物抗逆能力的影响及其生态学意义[J].西北植物学报,2005,16(5):971-976.
[11] 康国章,陶均,孙谷涛,等.H2O2和Ca2+对低温胁迫香蕉幼苗抗冷性的影响[J].园艺学报,2002,29(2):119-122.
[12] Lin S Z,Zhang Z Y,Lin Y Z,et al.The role of calcium and calmodulin in freezing-induced freezing resistance of Populustomentosa cuttings[J].Journal of Plant Physiology and Molecular Biology,2004,38:59-68.
[13] Mass E V.Salinity and citriculture[J].Tree Physiology,1993,12(2):195-216.
[14] 陈竹生,聂华堂,计玉,等.柑桔种质的耐盐性鉴定[J].园艺学报,1992,19(4):289-295.
[15] Storey R,Walker R R.Citrus and salinity[J].ScientiaHorticulturae,1999,78(4):39-81.
[16] Lin S Z,Zhang Z Y.Role of CaCl2in cold acclimation-induced freezing resistance of Populustomentosa cuttings[J].Forestry Studies in China,2002,4:38-42.
[17] Bar Y,Apelbaum A,Kafkafi U,et al.Ethylene association with chloride stress in citrus plants[J].Scientia Horticulturae,1998,73:99-109.
[18] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:134-263.
[19] 吴凤章,王贺新,徐国辉,等.木本植物低温胁迫生理及分子机制研究进展[J].林业科学,2015,51(7):116-128.
[20] 刘文英.植物逆境与基因[M].北京理工大学出版社,2015:41-76.
[21] Kingston-Smith A H,Foyer C H.Bundle-sheath proteins are more sensitive to oxidative damage than those of the mesophyll in maizeleaves exposed to paraquat or low temperatures[J].Journal of Experimental Botany,2000,51(342):123-130.
[22] Reddy V S,Reddy A S.Proteomics of calcium-signaling components in plants[J].Phytochemistry,2004,65(12):1745-1776.
[23] Sathyanarayanan P V,Poovaiah B W.Decoding Ca2+signals inplants[J].Critical Reviews in Plant Sciences,2004,23(1):1-11.
[24] Yang T,Poovaiah B W.Calcium/calmodulin-mediated signal network in plants[J].Trends in Plant Science,2003,8(10):505-512.
[25] 李国新,曾斌,杨晓红,等.不同钙盐对温州蜜柑抗冻性的影响[J].应用生态学报,2008,19(8):1665-1669.
[26] 耿广东,程智慧,张素勤.外源Ca2+对茄子幼苗抗寒性的影响[J].西南农业大学学报:自然科学版2006,28(3):432-435
[27] Liu W Y,Yu K M,He T F,et al.The low-temperature induced physiological responses ofAvenanudaL.,a cold tolerant plant species[J].The Scientific World Journal,2013,658-793.
[28] Wang Y,Yang H F,Li S D.Studies on chilling injury and cold hardiness of horticultural crops:a literature review[J].Acta Horticulturae Sinica,1994,21(3):239-244.
[29] Liang L H,Mei X,Lin F,et al.Effect of low temperature stress on tissue structure and physiological index of cashew young leaves[J].Ecology and Environmental Sciences,2009,18(l):317-320.
[30] Wang C G,Wang X,Cang J,et al.Effect of low temperature stress on cold resistance ability of rice seedlings[J].Journal of Northeast Agricultural University,2004,35(2):205-207.
[31] 邵怡若,徐建新,薛立,等.低温胁迫时间对4种幼苗生理生化及光合特性的影响[J].生态学报,2013,33(14):4237-4247.
EffectsofExogenousCa(NO3)2onPhysiologicalofCitrusaurantiumunderLowTemperatureStress
LIANG Yongfu1,WANGKangcai1*,SUILi1,XUEQi1,YEJun2,CHENXinzhong2
(1.CollegeofHorticulture,NanjingAgriculturalUniversity,Nanjing210095,China;2.ForestrytechnicalguidanceStationofTaizhou,Taizhou225300,China)
In order to reveal feasibility of the regulation of Ca(NO3)2onCitrusaurantiumunder low temperaturestress,the effects of Ca(NO3)2on physiological index were studied.Pot culturedCitrusaurantiumleaves under the same outdoor conditions were sprayed with 5,10,15,20,25mmol·L-1Ca(NO3)2separately,and then placed in the low incubator[0℃/4℃(day/night),light intensity 600 μmol·m-2·s-1],and sprayed with distilled water at 25 ℃ and under low temperature stress were set as the control.The related relative conductivity,contents of proline,malondialdehyde,soluble protein,chlorophyll,activities of SOD,POD and CAT,were measured.The results showed that the exogenous Ca(NO3)2enhanced the activities of SOD and POD,the contentsofproline and soluble protein,and effectively reduces the damage of heat stress on cell membrane.At the sametime,the exogenous Ca(NO3)2increases the contents of chlorophyll,the efficiency of leaf photosynthesis.In conclusion,the foliage spraying Ca(NO3)2could reduce the damage of low temperature stress onCitrusaurantiumleaves.
Ca(NO3)2;Citrusaurantiumseedlings;low temperature stress
2016-03-25)
江苏省林业三新工程项目(LYSX[2014]48)
*
王康才,教授,研究方向:药用植物栽培与生理;E-mail:wangkc@njau.edu.cn
10.13313/j.issn.1673-4890.2016.12.022

