Mcl-1小分子抑制剂在肿瘤治疗中的应用进展
姚佳慧,王义仁,周 楠,冯 甜,陈 惠
(第四军医大学药学院药物化学教研室,西安 710032)
·综述·
Mcl-1小分子抑制剂在肿瘤治疗中的应用进展
姚佳慧,王义仁,周楠,冯甜,陈惠*
(第四军医大学药学院药物化学教研室,西安710032)
目的 阐述近年来Mcl-1小分子抑制剂的结构及在肿瘤治疗中的应用。方法归纳国内外的最新研究进展报道,按照分子结构类型,对主要的、具有发展潜力的重要分子抑制剂进行综述。结果采用计算机分子模拟、对接、活性预测,进一步通过毒性和活性测定,各种分子具有大小不等的抑制活性,并在肿瘤治疗中取得了较好的效果。结论Mcl-1有望作为一种开发前景广阔的肿瘤治疗靶点。
抗凋亡蛋白;Mcl-1;小分子抑制剂
细胞凋亡 (apoptosis)又称程序性细胞死亡,是生物体对细胞死亡进行精确调控的一种机制,可促进体内无用或受损细胞死亡。细胞凋亡机制对胚胎发育、维持细胞形态具有重要的作用。与细胞凋亡功能密切有关的B细胞白血病-2(Bcellleukemia-2,Bcl-2)蛋白家族,是细胞凋亡中一类重要的调节蛋白[1]。Bcl-2蛋白家族分为抗凋亡蛋白和促凋亡蛋白2类,见图1。前者包括Bcl-2,Bcl-xL,Bcl-x,A1和Mcl-1,它们能通过阻止细胞凋亡,保证其存活;后者包括Bim,tBid,Puma,Noxa,Bak和Bax,它们可促进受损细胞快速死亡[2]。Bcl-2蛋白家族成员大部分都具有结构高度保守的区域,被称为Bcl-2同源结构域(Bcl-2homology,BH) ,包括BH1~BH4,而少部分只具有BH3的同源结构域(如PUMA,Noxa,Bim和Bid)[3]。
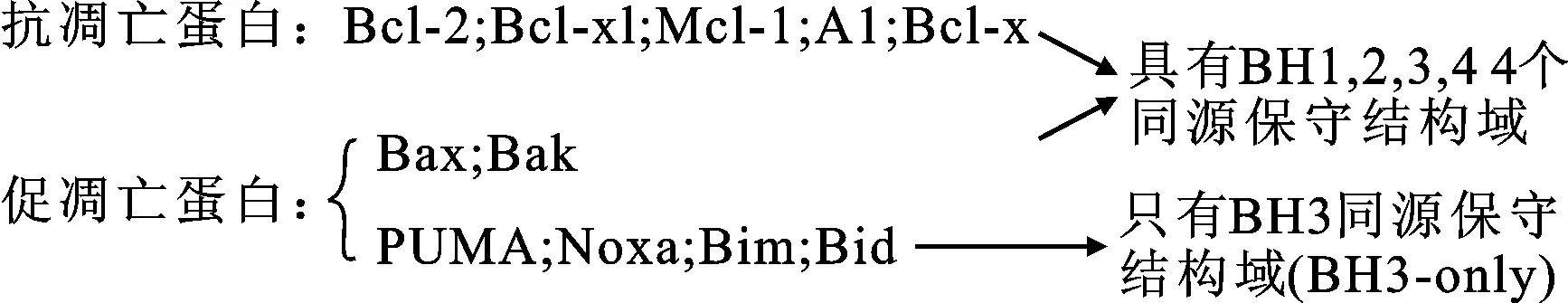
图1Bcl-2蛋白家族成员及结构特点
Fig.1Bcl-2familymembersandtheirspecialstructures
抗凋亡蛋白具有BH1~BH4 4个结构域,其表面可形成一段疏水凹槽,通过疏水作用和静电作用,与促凋亡蛋白的BH3结构域发生特异性结合,发挥抑制细胞死亡的作用[4]。同时,细胞可以通过信号传导,BH3-only蛋白可与抗凋亡蛋白发生竞争性的特异结合,诱导Bax等在线粒体膜上发生寡聚体化,并形成了孔道,导致细胞色素C释放到胞浆中,激活Caspase,从而导致细胞死亡[5],见图2。这2种发挥着截然相反作用的蛋白在体内维持动态平衡,共同决定细胞的生存。
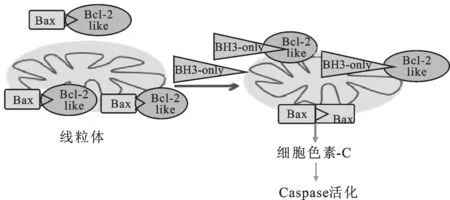
图2Bcl-2蛋白参与的细胞凋亡途径
Fig.2Bcl-2intheapoptosispathway
Mcl-1是Bcl-2家族的抗凋亡蛋白中功能强大、作用独特的一种抗凋亡蛋白[6]。Mcl-1在早期胚胎形成及淋巴细胞、神经细胞、纤维母细胞及肝脏干细胞的功能维持中发挥着举足轻重的作用[7]。而且Mcl-1半衰期短,可受多种信号通路调控转录、表达及降解[6]。就结构而言,Mcl-1与其他的抗凋亡蛋白不尽相同,尤其是其N端。Mcl-1的N末端有2个PEST序列(脯氨酸/谷氨酸/丝氨酸/苏氨酸)。这种结构特异的N端是Mcl-1的转化、定位与磷酸化的速度调控的关键区域,可使Mcl-1对环境和传入信号进行快速的应答[8]。
很多试验证明了Mcl-1是重要的肿瘤治疗靶点。在肺癌、乳腺癌、前列腺癌、胰腺癌、卵巢癌、宫颈癌黑色素瘤和白血病等许多肿瘤中,均发现了Mcl-1基因遗传变异[9-10]。此外,当Mcl-1过表达时,可以明显降低Bcl-2抑制剂的作用,如临床上广泛应用的抗肿瘤药物紫杉醇、长春新碱与吉西他滨等,过表达的Mcl-1可显著抑制其药效[11]。
本文重点回顾针对旨在模拟BH3的Mcl-1的小分子抑制剂。
根据活性化合物的来源途径,我们将目前的Mcl-1小分子抑制剂分为以下几类:
1 磺酰胺类小分子抑制剂
高通量的化合物筛选,一直是获得活性先导最直接、最常见的途径。通过对化合物库的理性药物筛选,结合荧光偏振法测定,已获得了一系列的与Mcl-1有亲和力的抑制剂结构。
Abulwerdi等[1]从可与Mcl-1发生亲和力作用的53 000个小分子中筛选并获得了化合物1,并通过核磁共振对接模型与结构-亲和力研究辅助技术,并以其作为先导化合物,进行结构优化,合成了与Mcl-1亲和力更高的化合物2(Kd=180nmol·L-1.Bid-BH3,FPA)[12]。将此化合物应用于白血病细胞后发现,它可激活半胱天冬酶3并抑制肿瘤细胞生长。此外,化合物2对Bak和Bax缺失的细胞具有细胞毒性,所以该化合物极有可能是依赖Bax或Bak而发挥其促凋亡作用的,但其确切机制仍在进一步研究中。化合物1~2的结构式见图3。

图3化合物1~2的结构式
Fig.3Structuresofcompound1-2
Abulwerdi等[12]通过高通量筛选得到3,对其进行结构优化,针对与Mcl-1的BH3区域的亲和力作用,获得了亲和力更大(Ki=490nmol·L-1)的化合物4。这种高亲和力促使细胞色素C释放,并同时激活Caspase3通路,从而诱导肿瘤细胞凋亡。共免疫沉淀反应显示,4可阻断Mcl-1与Bax/Bak的聚合,使Mcl-1无法发挥抗凋亡作用,而正是这种促凋亡的机制,使其对Bax和Bak双缺陷的细胞无能为力。临床前研究表明,4可显著减缓移植胰腺癌细胞株小鼠肿瘤的生长[13]。化合物3~4的结构式见图4。
在磺胺类化合物中,已有上市的Mcl-1蛋白抑制剂,其中BH3的模拟蛋白物5(ABT-737)、6(ABT-263)与7(ABT-199)等,可以通过与Bcl-2、Bcl-x等结合,而诱导肿瘤细胞凋亡[14]。临床试验证明,Navitoclax与7的促淋巴癌细胞凋亡作用显著。但多项研究证明,Mcl-1的上调抑制了5与6在多种肿瘤治疗中的活性,且Navitoclax等单独应用于肿瘤治疗的效果不甚理想[15]。化合物5~7的结构式见图5。
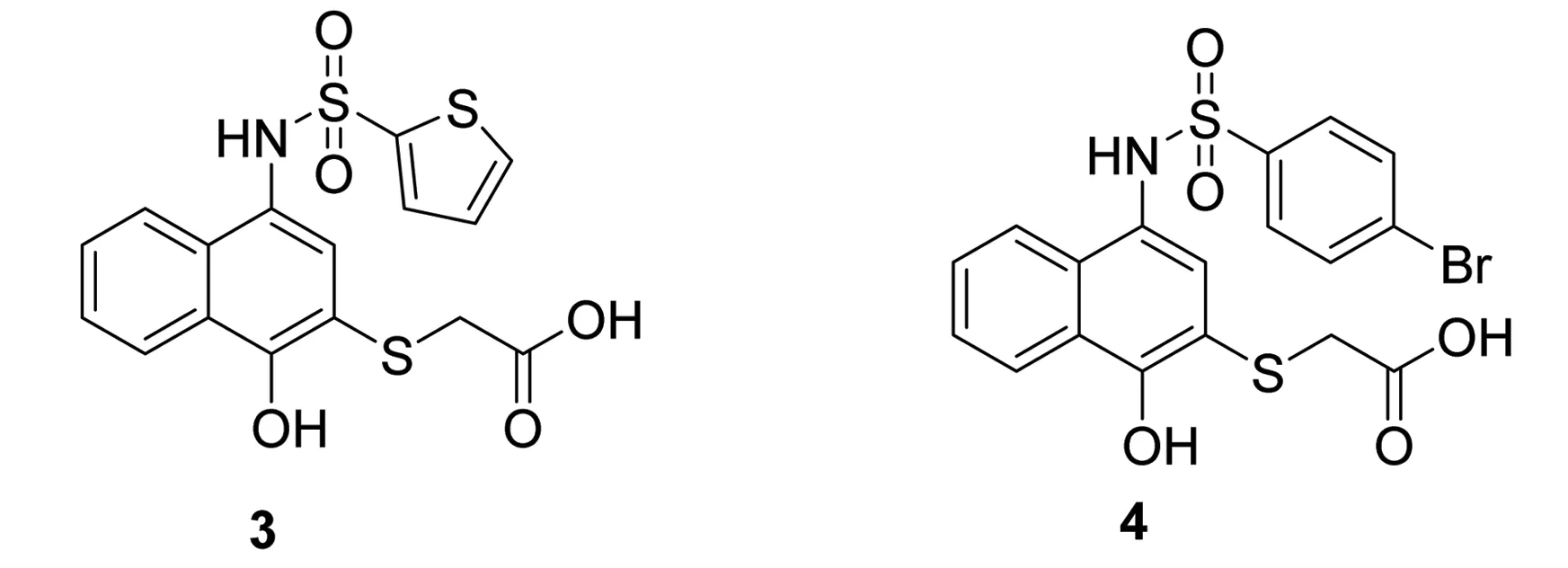
图4化合物3~4的结构式
Fig.4Structuresofcompound3-4
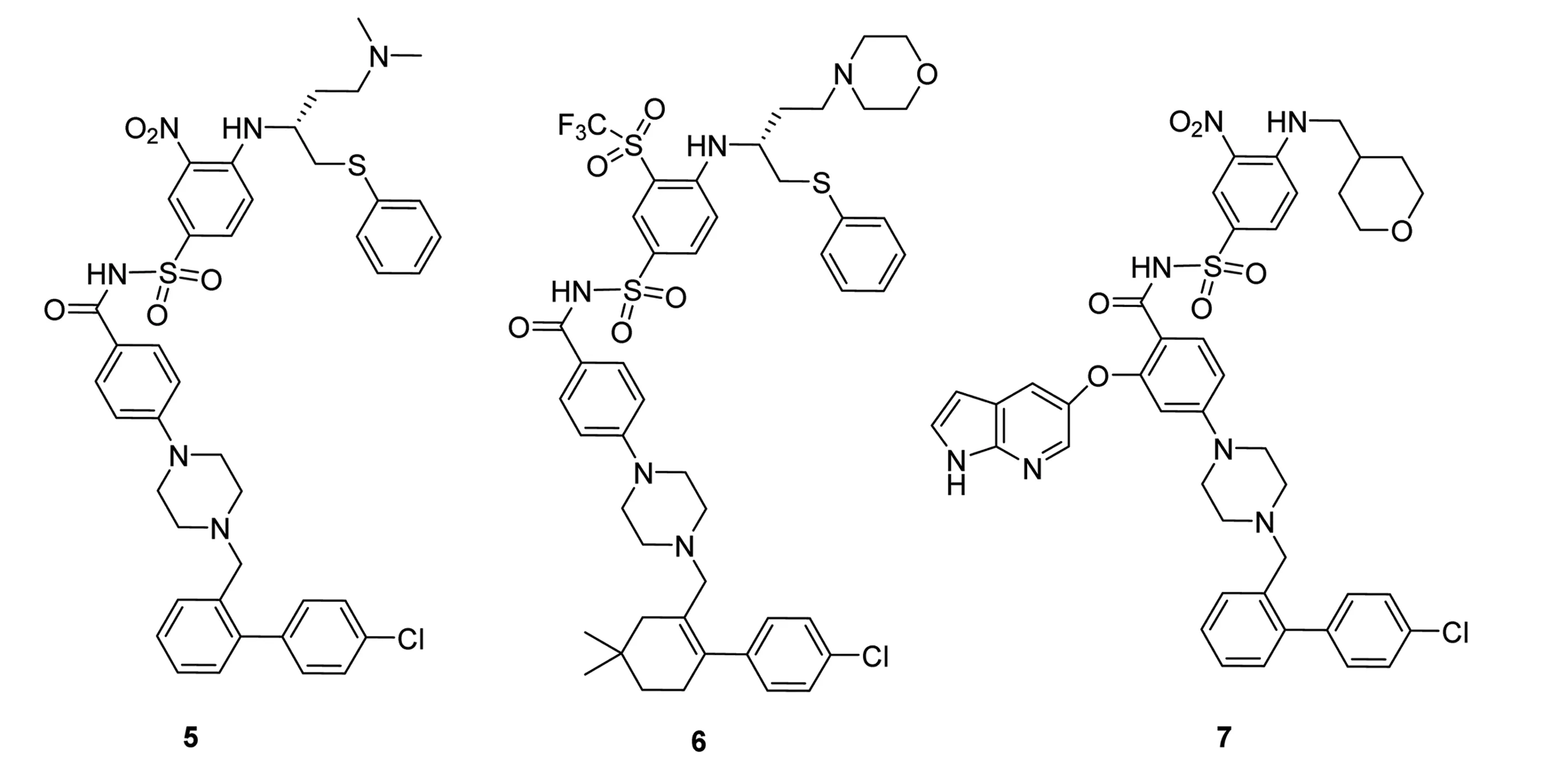
图5化合物5~7的结构式
Fig.5Structuresofcompound5-7
2 噻唑类抑制剂
BH31-1(8)是一个可与Bcl-2的BH3区域发生特异性结合的化合物,Bemardo等[16]通过与8有亲和力的各种小分子片段进行高通量筛选,获得了与Bcl-2的BH3区域特异结合化合物9及它的同分异构体10[17]。其中9只与Mcl-1结合(Kd=10μmol·L-1.ITC),而化合物10不仅与Mcl-1亲和力高(Kd=0.25μmol·L-1.ITC),还可与Bcl-XL结合(Kd=3.4μmol·L-1.ITC)[18]。但在后续研究中发现,不管在高浓度条件下单独使用化合物9和10,或是与5 (ABT-737)合用均没有表现出抑制肿瘤细胞的活性[19-20]。化合物8~10的结构式见图6。
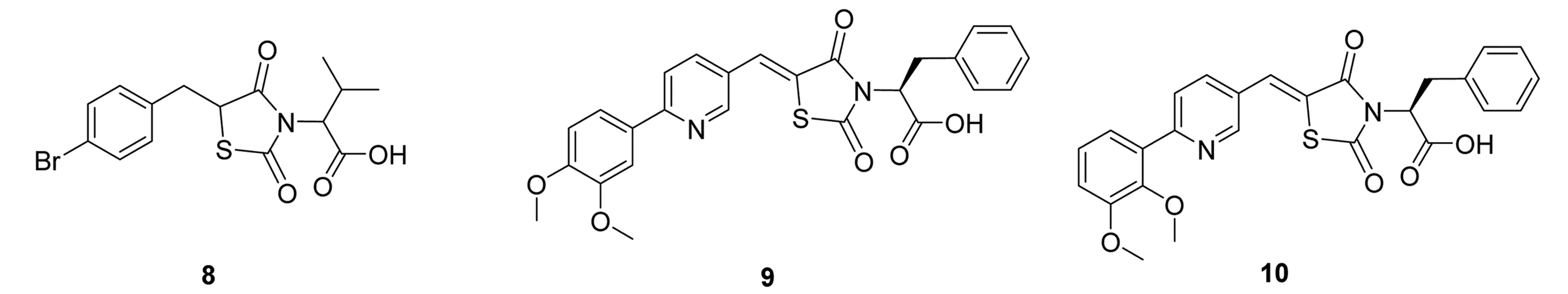
图6化合物8~10的结构式
Fig.6Structuresofcompound8-10
Cohen等[13]对具有α-螺旋结构的BH3肽亲和力高的小分子进行高通量筛选,得到化合物11(MIM1)。MIM1通过与Mcl-1结构特异性结合(IC50=4.78μmol·L-1,Bid-BH3,FPA),引发Bax/Bak的信号通路,促进细胞凋亡。以11为先导衍生而合成的化合物,均可与Mcl-1及Bcl-xL结合,但在白血病细胞系中却未表现出与Bcl-xL的亲和力。最新研究发现,11只在高浓度(>10μL)下对依赖于Mcl-1和Bcl-xL的细胞凋亡产生促进作用,且其结合位点仅限于Mcl-1的BH3区域,作用范围较窄。提示进一步对化合物11的合理结构优化,并增加合理药效团,有望提高其促凋亡活性。化合物11的结构式见图7。
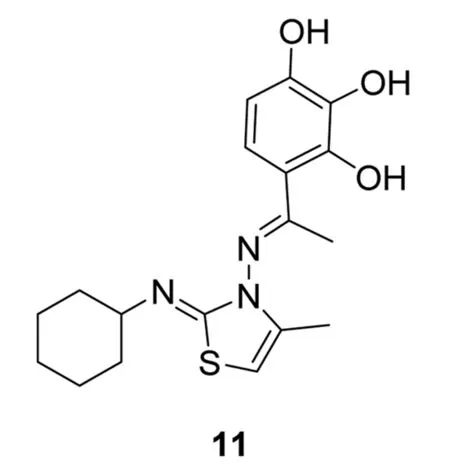
图7化合物11的结构式
Fig.7Structureofcompound11
3 羟基喹啉小分子化合物
基于荧光偏振法的高通量筛选,Richard等[21]得到1个具有抑制Mcl-1作用的小分子化合物12。以12为先导,结构优化获得化合物13(EU-5346)。在对13的构效关系研究中发现,该化合物对Mcl-1(IC50=310nmol·L-1,Bim-BH3,FPA)的选择性远高于Bcl-2(IC50=40μmol·L-1,Bim-BH3,
FPA)。进一步研究还发现,EU-5346通过诱导细胞色素C释放,引起半胱天冬酶级联反应,导致肿瘤细胞凋亡。作为发展潜力巨大的苗头药物,13正处于临床前的开发研究中。化合物12~13的结构式见图8。
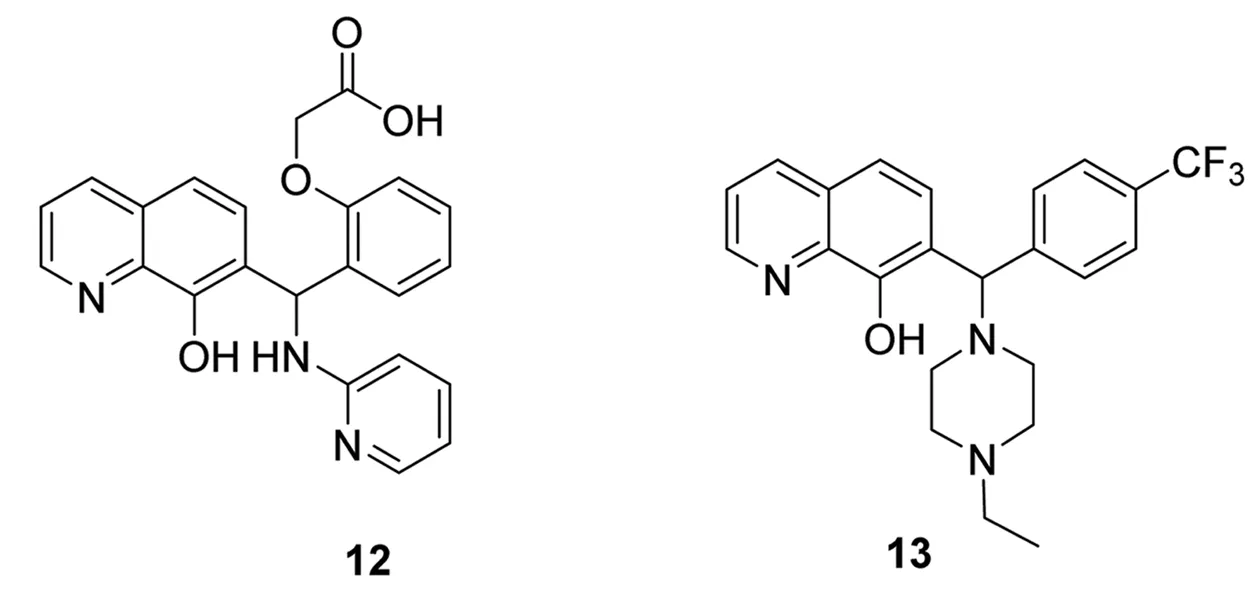
图8化合物12~13的结构式
Fig.8Structureofcompound12-13
4 苯并吡唑类小分子抑制剂
具有活性的小分子片段,可以通过一定的化学键的连接,从而获得亲和力更高、活性更强的新化合物,这也是药物发现的重要途径。武田制药研究所将已报道的小分子化合物14改造得到15[22]。将15与ABT-737的芳基磺胺相连得到化合物16,再将16甲基化得到17,从而获得了Mcl-1与Bcl-xL的双重抑制剂。16与Mcl-1与Bcl-xL的亲和力均呈较高水平,但Mcl-1的IC50为88nmol·L-1,而Bcl-xL的IC50为3.7nmol·L-1,提示16与Mcl-1间具有更高的亲和力作用。进一步的研究中,获得了化合物15可与Mcl-1和Bcl-xL的共结晶,表明结构中的2个结构片段可以各司其职,与相应的抗凋亡蛋白分别结合,从而发挥促凋亡作用[23]。反应方程式见图9。
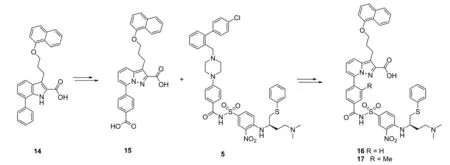
图9反应方程式
Fig.9Equationofthereaction
5 平面刚性结构的化合物
雅培公司[24]从17 000个抑制Mcl-1小分子中筛选出含有芳基磺胺结构的化合物,采用NuclearOverhauserEffect(NOE)效应产生的静电排斥作用,进行分子片段的结合,得到化合物18和19。把18的吡唑环取代为苯环,得到化合物20,IC50为30nmol·L-1(Noxa-BH3,FPA),具有较好的Mcl-1抑制作用。此外将19进行结构优化,得到化合物21。19和21与Mcl-1发生结合时,结合区域的位点相同。但由于20含疏水萘基,所以能与Mcl-1的BH3区域结合得更紧密、更稳定。化合物18~21的结构式见图10。
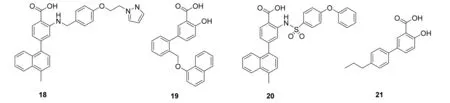
图10化合物18~21的结构式
Fig.10Structuresofcompound18-21
6 2-羧基吲哚(苯并噻吩)衍生物
Friberg等[25]首先获得22和23两个小分子片段,并进一步用核磁共振介导的分子片段对接技术,得到化合物24。24的Kd为0.32μmol·L-1,较单个分子片段的亲和力提高了100倍。Friberg等[25]通过与重组同位素标记的Mcl-1蛋白结合,从分子库中筛选出活性化合物25和26。通过双重标记(15N与13C)Mcl-1蛋白,观察分子片段与Mcl-1/Bim肽复合物的结合方式,见图11。发现25的苯环与A227、M231和F270产生了NOE效应,羧基指向R2563方向;23与Mcl-1结合紧密,羧基位于Mcl-1疏水区域表面指向R263,见图12。将片段23和25连接得到化合物26。在26的立体构型中,吲哚环的分子平面垂直于苯环的分子平面,见图13。化合物26的Ki=0.16μmol·L-1,Bak-BH3,FPA。将苯环4位Cl转移到6位后,得到的新化合物27,它对Mcl-1的选择性(Ki=55nmol·L-1,Bak-BH3,FPA)高于Bcl-xL约16倍,高于Bcl-2约270倍。化学反应方程式见图14。
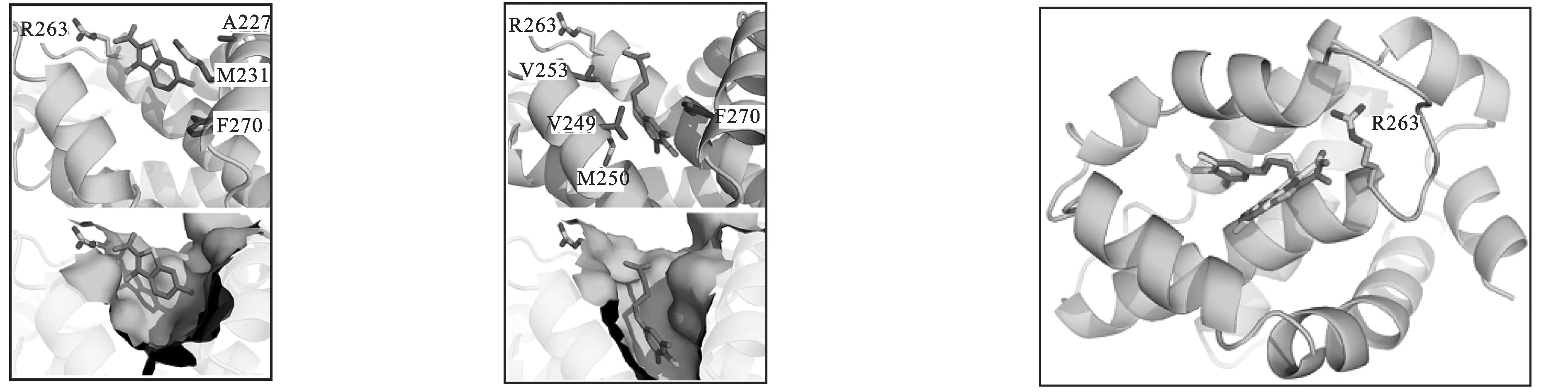
图11(23)与Mcl-1结合的构型 图12(25)与Mcl-1结合的构型图13(26)与Mcl-1结合的构型
Fig.11Dockingof23toMcl-1Fig.12Dockingof25toMcl-1Fig.13Dockingof26toMcl-1
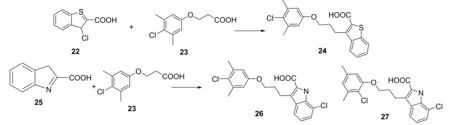
图14化学反应方程式
Fig.14Equationofchemicalreaction
Burke等[26]将高通量筛选得到的小分子片段,拼接而合成得到三环吲哚-2-羧酸化合物28,见图15。28具有与26相似的亲和力(Ki=3nmol·L-1),但其配合率(LE)更高,见图16。28对Mcl-1的选择性非常高,相比于和Bcl-2或Bcl-xL作用,28与Mcl-1的作用强100倍。28与Mcl-1结合后观察到A环的羧基指向R263,B环与A227、M231和F270产生NOE效应,C环与疏水区域P3相邻,见图17。此外,在R2的甲基取代表现出与T266较弱的NOE效应,R1指向P2疏水域深部。提示R1极可能是使小分子与Mcl-1的疏水区结合更深的理想位置。
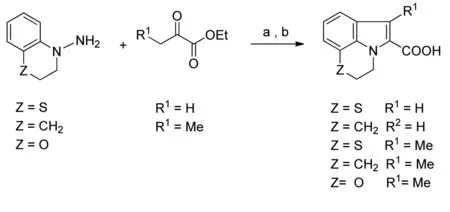
图15三环吲哚合成
Fig.15Synthesisoftricyclicindolederivatives
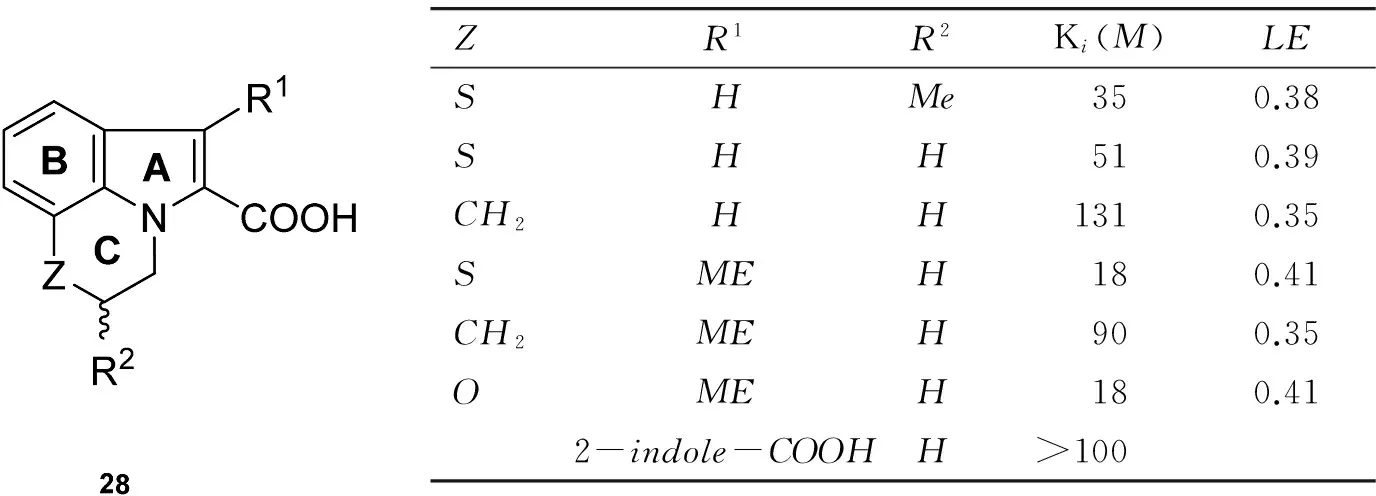
ZR1R2Ki(M)LESHMe350.38SHH510.39CH2HH1310.35SMEH180.41CH2MEH900.35OMEH180.412-indole-COOHH>100
图16三环吲哚的构效关系分析
Fig.16QSARoftricyclicindolederivatives
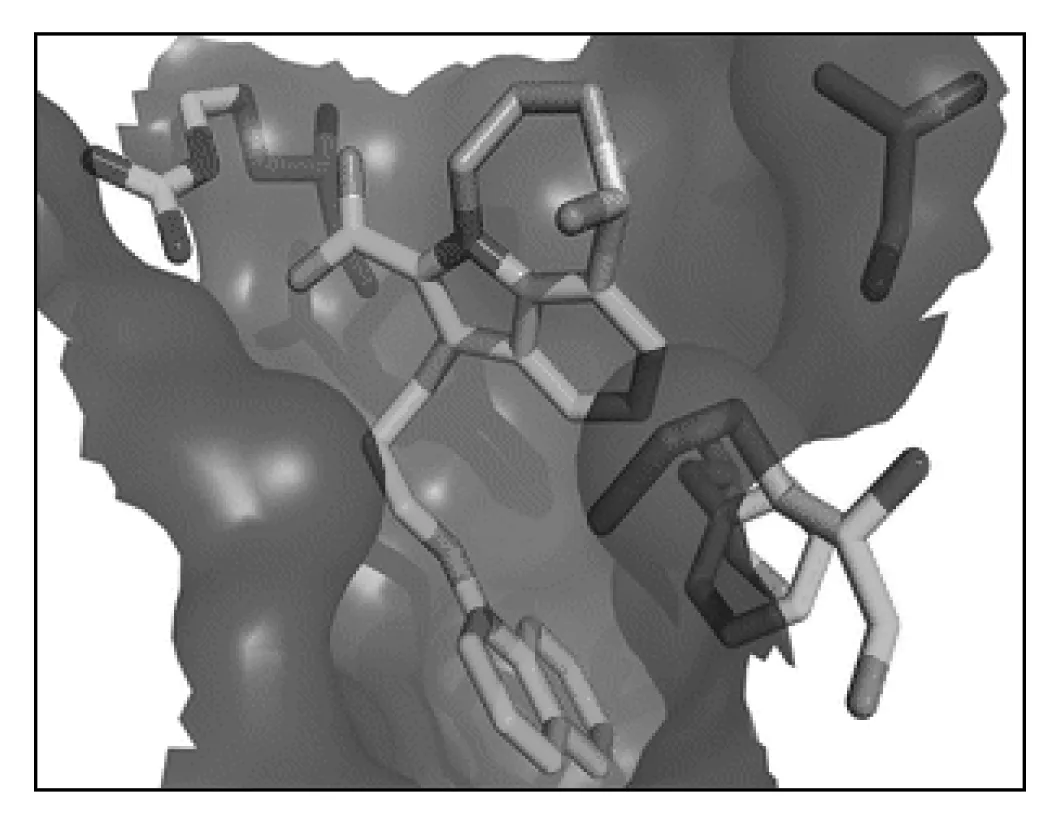
图17吲哚与Mcl-1结合的构型
Fig.17DockingofindolederivativestoMcl-1
7 非特异性的Mcl-1的小分子抑制剂
Zhang等[27]通过研究发现,具有平面刚性骨架的芳香杂环化合物29表现出了抗肿瘤活性。它与Mcl-1蛋白的亲和力(Kd=58nmol·L-1,Bid-BH3,FPA),比与Bcl-2(Kd=310nmol·L-1,Bid-BH3,FPA)的亲和力高。29是通过内质网介导的自吞噬作用和自吞噬基因Beclin1与Bcl-2的相互作用来诱导细胞死亡的。29改造结构得到化合物30,对整个Bcl-2家族成员均有抑制作用[28]。此外,通过29与Mcl-1结合的NMR衍生模型的研究表明,C3和C6位沿与BH3的疏水凹槽结合方向改造可得到31与32。初步细胞试验证明31的促细胞凋亡活性比29强6倍,而32与29的活性相近[29-30]。化合物29~32的结构式见图18。
图18化合物29~32的结构式
Fig.18Structuresofcompound29-32
8 天然提取物
MarinopyrroleA(Maritoclax) 33是从海洋链霉菌中提取而来,最初发现其对耐甲氧西林金黄色葡萄球菌 (MRSA) 菌株有抑制作用[31-32],后续研究发现,它还可以有效地抑制白血病细胞和黑色素瘤细胞的Mcl-1,干扰Mcl-1与Bim的相互作用,但对Bcl-xL却无影响[33-34]。最新研究表明,Maritoclax的衍生物34对Mcl-1/Bim复合物的干扰活性是Bcl-xL/Bim的16倍(IC50=6.1μmol·L-1),衍生物35的IC50为600nmol·L-1,在抑制Mcl-1/Bim复合物活性的表现上,比Maritoclax强15倍[35]。化合物33~35的结构式见图19。
图19化合物33~35的结构式
Fig.19Structuresofcompound33-35
综上所述,抑制过度表达Mcl-1蛋白已成为抗肿瘤研究的重要领域。研究Mcl-1抑制剂对抗肿瘤治疗药物的耐药性有重要的作用。不管是单一应用Mcl-1小分子抑制剂,还是与其他抗肿瘤药物合用均呈现较好的治疗作用。随着对Mcl-1抑制剂的研究也得到了不少成果,但目前的研究还未能实际应用于临床,为肿瘤患者带来福音,所以希望在以后的研究中能够出现更好的Mcl-1抑制剂,并应用于临床治疗。
[1]AbulwerdiFA,LiaoC,MadyAS,etal. 3-Substituted-N-(4-hydroxynaphthalen-1-yl)arylsulfonamidesasanovelclassofselectiveMcl-1inhibitors:structure-baseddesign,synthesis,SAR,andbiologicalevaluation[J].JMedChem,2014,57(10): 4111-4133.
[2]CohenNA,StewartML,GavathiotisE,etal.AcompetitivestapledpeptidescreenidentifiesaselectivesmallmoleculethatovercomesMcl-1-dependentleukemiacellsurvival[J].ChemBiol,2012,19(9): 1175-1186.
[3]LugovskoyA,DegterevAI,FahmyAF,etal.Anovelapproachforcharacterizingproteinligandcomplexes:molecularbasisforspecificityofsmall-moleculeBcl-2inhibitors[J].JAmChemSoc,2002,124(7): 1234-1240.
[4]AbulwerdiF,LiaoC,LiuM,etal.Anovelsmall-moleculeinhibitorofMcl-1blockspancreaticcancergrowthin vitroandin vivo[J].MolCancerTher,2014,13(3): 565-575.
[5]ChenL,WillisSN,WeiA,etal.DifferentialtargetingofprosurvivalBcl-2proteinsbytheirBH3-onlyligandsallowscomplementaryapoptoticfunction[J].MolCell, 2005,17(3): 393-403.
[6]TanakaY,AikawaK,NishidaG,etal.DiscoveryofpotentMcl-1/Bcl-xLdualinhibitorsbyusingahybridizationstrategybasedonstructuralanalysisoftargetproteins[J].JMedChem,2013, 56(23): 9635-9645.
[7]VaradarajanS,VoglerM,ButterworthM,etal.EvaluationandcriticalassessmentofputativeMcl-1inhibitors[J].CellDeathDiffer,2013,20(11): 1475-1484.
[8]HanahanD,WeinbergRA.Hallmarksofcancer:thenextgeneration[J].Cell,2011. 144(5): 646-674.
[9]RichardDJ,LenaR,BannisterT,etal.Hydroxyquinoline-derivedcompoundsandanaloguingofselectiveMcl-1inhibitorsusingafunctionalbiomarker[J].BioorgMedChem, 2013, 21(21): 6642-6649.
[10]WeiSH,DongK,LinF,etal.InducingapoptosisandenhancingchemosensitivitytogemcitabineviaRNAinterferencetargetingMcl-1geneinpancreaticcarcinomacell[J].CancerChemothPharm,2008,62(6): 1055-1064.
[11]MoldoveanuT,FollisAV,KriwackiRW,etal.ManyplayersinBcl-2familyaffairs[J].TrendsBiochemSci,2014,39(3): 101-111.
[12]AbulwerdiFA,LiaoC,MadyAS,etal. 3-Substituted-N-(4-hydroxynaphthalen-1-yl)arylsulfonamidesasanovelclassofselectiveMcl-1inhibitors:structure-baseddesign,synthesis,SAR,andbiologicalevaluation[J].JMedChem, 2014, 57(10): 4111-4133.
[13]CohenNA,StewartML,GavathiotisE,etal.AcompetitivestapledpeptidescreenidentifiesaselectivesmallmoleculethatovercomesMcl-1-dependentleukemiacellsurvival[J].ChemBiol, 2012, 19(9): 1175-1186.
[14]KeulingAM,FeltonKE,ParkerAA,etal.RNAsilencingofMcl-1enhancesABT-737-mediatedapoptosisinmelanoma:roleforacaspase-8-dependentpathway[J].PLoSOne,2009,4(8):e6651.
[15]GandhiL,CamidgeDR,OliveiraMR,etal.PhaseIstudyofNavitoclax(ABT-263),anovelBcl-2familyinhibitor,inpatientswithsmall-celllungcancerandothersolidtumors[J].JClinOncol,2011,29(7): 909-916.
[16]BemardoPH,SivaramanT,WanKF,etal.StructuralinsightsintothedesignofsmallmoleculeinhibitorsthatselectivelyantagonizeMcl-1[J].JMedChem,2010, 53(5):2314-2318.
[17]LiuH,EksarkoP,TemkinV,etal.Mcl-1isessentialforthesurvivalofsynovialfibroblastsinrheumatoidarthritis[J].JImmunol,2005,175(12): 8337-8345.
[18]ThomasLW,LamC,EdwardsSW.Mcl-1;themolecularregulationofproteinfunction[J].FEBSLett,2010,584(14): 2981-2989.
[19]LucasKM,Mohana-KumaranN,LauD,etal.ModulationofNOXAandMcl-1asastrategyforsensitizingmelanomacellstotheBH3-mimeticABT-737 [J].ClinCancerRes,2012,18(3): 783-795.
[20]BurlacuA.RegulationofapoptosisbyBcl-2familyproteins. [J].JCellMolMed,2003,7(3): 249-257.
[21]RichardDJ,LenaR,BannisterT,etal.Hydroxyquinoline-derivedcompoundsandanaloguingofselectiveMcl-1inhibitorsusingafunctionalbiomarker[J].BioorgMedChem, 2013, 21(21): 6642-6649.
[22]ElmoreSW,SouersAJ,BrunckoM,etal. 7-substitutedindolemcl-1inhibitors[P].WO2008,131000A2.
[23]GermainM,DuronioV.TheNterminusoftheanti-apoptoticBcl-2homologueMcl-1regulatesitslocalizationandfunction[J].JBiolChem,2007,282(44): 32233-32242.
[24]PetrosAM,SwannSL,SongD,etal.Fragment-baseddiscoveryofpotentinhibitorsoftheanti-apoptoticMcl-1protein[J].BioorgMedChemLett,2014,24(6): 1484-1488.
[25]FribergA,VigilD,ZhaoB,etal.Discoveryofpotentmyeloidcellleukemia1 (Mcl-1)inhibitorsusingfragment-basedmethodsandstructure-baseddesign[J].JMedChem,2013,56(1): 15-30.
[26]BurkeJP,BianZ,ShawS,etal.DiscoveryoftricyclicindolesthatpotentlyinhibitMcl-1usingfragment-basedmethodsandstructure-baseddesign[J].JMedChem,2015,58(9): 3794-3805.
[27]ZhangZ,SongT,ZhangT,etal.AnovelBH3mimeticS1potentlyinducesBax/Bak-dependentapoptosisbytargetingbothBcl-2andMcl-1 [J].Cancer,2011,128(7): 1724-1735.
[28]ZhangZ,WuG,XieF,etal. 3-Thiomorpholin-8-oxo-8H-acenaphtho[1,2-b]pyrrole-9-carbonitrile(S1)basedmoleculesaspotent,dualinhibitorsofB-celllymphoma2 (Bcl-2)andmyeloidcellleukemiasequence1 (Mcl-1):structure-baseddesignandstructure-activityrelationshipstudies[J].JMedChem,2011,54(4): 1101-1105.
[29]ZhangZ,LiuC,LiX,etal.Fragment-baseddesignsynthesisandbiologicalevaluationofN-substituted-5-(4-isopropylthiophenol)-2-hydroxynicotinamidederivativesasnovelMcl-1inhibitors[J].EurJMedChem,2013,60: 410-420.
[30]ZhangZ,SongT,LiX,etal.Novelsolublemyeloidcellleukemiasequence1 (Mcl-1)inhibitor(E,E)-2-(benzylaminocarbonyl)-3-styrylacrylonitrile(4g)developedusingafragment-basedapproach[J].EurJMedChem,2013,59: 141-149.
[31]HughesCC,YangYL,LiuWT.MarinopyrroleAtargetelucidationbyacyldyetransfer[J].JAmChemSoc,2009,131(34): 12094-12096.
[32]HasteNM,HughesCC,TranDN,etal.PharmacologicalpropertiesofthemarinenaturalproductMarinopyrroleAagainstmethicillin-resistantStaphylococcus aureus[J].AntimicrobAgentsChemother,2011,55(7): 3305-3312.
[33]DoiK,LiR,SungSS,etal.DiscoveryofmarinopyrroleA(maritoclax)asaselectiveMcl-1antagonistthatovercomesABT-737resistancebybindingtoandtargetingMcl-1forproteasomaldegradation[J].JBiolChem,2012,287(13): 10224-10235.
[34]PandeyMK,GowdaK,DoiK,etal.ProteasomaldegradationofMcl-1bymaritoclaxinducesapoptosisandenhancestheefficacyofABT-737inmelanomacells[J].PLoSOne,2013,8(11):e78570.
[35]LiR,ChengC,BalasisME,etal.Design,synthesisandevaluationofmarinopyrrolederivativesasselectiveinhibitorsofMcl-1bindingtopro-apoptoticBimanddualMcl-1/Bcl-xLinhibitors[J].EurJMedChem,2015,90: 315-331
Research progress of small-molecule Mcl-1 inhibitors on cancer therapy
YAO Jiahui,WANG Yiren,ZHOU Nan,FENG Tian,CHEN Hui*
(Department of Medicinal Chemistry,the Fourth Military Medical University, Xi′an 710032)
ObjectiveMcl-1isapromisingcancertarget.Thisreviewhighlightsthecurrentresearchprogressontheinhibitionofthistarget.MethodBaseontheinhibitors′structure,thisreviewfocusesonthecurrentstateofMcl-1inhibitors,especiallysomeimportantmembers.ResultAidedbydockingmodelsandhigh-throughputscreen,someinhibitorsshowedratherhighbioactivityandlowtoxicity,furtherinducedBcl-2dependentapoptosisinsometumorcells.ConclusionTherecenteffortswillleadtodiscoverynovelMcl-1inhibitorsforthetreatmentofcancer.
anti-apoptoticproteins;Mcl-1;smallmoleculeinhibitors
国家自然科学基金项目(编号:81573343)
姚佳慧,女,本科生
陈惠,女,副教授
10.3969/j.issn.1004-2407.2016.05.035
R979.1
A
1004-2407(2016)05-0547-06
2015-12-16)
——访谈法

