葛根素预防压力过载性心脏肥大的保护作用及机制
覃 华,张 琰,王四旺,王 茹*
(1.第四军医大学唐都医院药剂科,西安 710038;2.第四军医大学药学系,西安 710032)
葛根素预防压力过载性心脏肥大的保护作用及机制
覃华1,张琰1,王四旺2,王茹1*
(1.第四军医大学唐都医院药剂科,西安710038;2.第四军医大学药学系,西安710032)
目的 研究葛根素对心脏肥大大鼠的保护作用,并探讨其相关机制。方法将主动脉缩窄术(降主动脉结扎,aorticbanding,AB)所致心脏肥大的40只雄性SpragueeDawley大鼠(体质量80~100g),分为阳性对照组 (control组)、假手术组(sham-operated,SO组)、葛根素组(Pue组)和雷帕霉素组(RAPa组)。检测各组经相应药物治疗后,腺苷酸活化蛋白激酶(5′-adenosinemonophosphatekinase,AMPK)的活性及自噬功能。同时,体外检测异丙肾上腺素和3-甲基腺嘌呤所致的心肌影响。结果葛根素组治疗3周后,大鼠明显恢复自噬;葛根素治疗6周后,有效地限制大鼠心脏细胞肥大和细胞凋亡。雷帕霉素组具有相似作用。体外研究,葛根素对异丙肾上腺素所致的H9c2细胞也具有类似的抗肥大和抗细胞凋亡作用。用3-甲基腺嘌呤预处理H9c2细胞,抑制自噬功能后,葛根素的保护作用被阻断。结论葛根素通过AMPK/mTOR信号途径,部分恢复细胞自噬功能,发挥抗心脏细胞肥大和抗细胞凋亡作用。
葛根素;心脏肥大;自噬;AMPK
自噬促进受伤蛋白质和溶酶体细胞器的降解,与心血管疾病相关[1-2]。葛根素作为葛根的主要生物活性成分,已通过中国国家食品药品监督管理局批准,临床用于治疗心血管疾病和其他疾病[3-4]。然而,葛根素预防心脏肥大的详细机制仍不清楚,尤其是葛根素通过调节自噬影响心脏肥大的机制。本文以动物实验为基础,进行了相关研究。
1 仪器与材料
1.1仪器苏木精-伊红(HE)和Masson三色染色试剂盒 (Baso公司,中国广东);Bradford蛋白浓度测定试剂盒(Bio-Rad,美国);原位末端标记(TUNEL)染色试剂盒(Roche,美国);AnnexinV-FITC细胞凋亡检测试剂盒(eBioscience,美国);IE33超声心动图系统(飞利浦公司)。1.2试药异丙肾上腺素(ISO,国药准字H50020020,西南药业股份有限公司);葛根素注射液(国药准字H20055928,山东华信制药集团股份有限公司);3-甲基腺嘌呤(3-MA,IPA1009-0010MG,上海前尘生物科技有限公司);氯喹(CQ)试剂、Hoechst33342(Sigma-Aldrich公司);4′,6-二脒基-2-苯基吲哚盐酸盐(DAPI,上海研拓生物科技有限公司);注射用葛根素(浙江震元制药有限公司);雷帕霉素(上海蓝木化工有限公司);AMP依赖的蛋白激酶(AMPK)或负链对照siRNA(Thermo公司);LC3B抗体,抗体P62,Beclin1,AMPKα,Thr172,Thr389,p70S6激酶,4E结合蛋白1(Sigma-Aldrich公司);Thr37/46,雷帕霉素哺乳动物靶点 (mTOR),裂解半胱天冬酶-3(CellSignalingTechnology公司);AlexaFluor®555 鬼笔环肽 (Invitrogen公司)。1.3动物动物实验符合美国国立卫生研究院实验动物指导原则。所有大鼠均由南方医科大学动物保健服务中心饲养。
2 方法
2.1造模及给药方法40只雄性SpragueeDawley大鼠(体质量80~100g)经主动脉缩窄术(降主动脉结扎,aorticbanding,AB)引起心脏肥大后,分为阳性对照组(control组)、假手术组(sham-operated,SO组)、葛根素组(Pue组)和雷帕霉素组(RAPa组)。其中,SO组进行假手术处理,注射同等体积的生理盐水,Pue组和RAPa组分别皮下注射葛根素(100mg·kg-1·d-1)或雷帕霉素(1.2mg·kg-1·d-1)。
大鼠每周经水合氯醛麻醉,记录超声心动图。
2.2器官质量和免疫组织学分析计算心脏质量指数(HW/BW)和左心室质量指数(LWm/BW);用心肌细胞截面积评价左心室(LV)肥大程度;截面积染色(苏木精-伊红)后经光学显微镜检查并测量肌细胞面积;Masson三色染色评估纤维化。
组织或细胞溶解产物离心后收集上清液。用Bradford法测定蛋白浓度。利用Trizol试剂从左心室组织或H9c2细胞中提取RNA,进行实时逆转录聚合酶链定量反应。合成cDNA用以实时聚合酶链反应(PCR)分析。本研究中使用的PCR引物序列如下:18S,50-ACCGCAGCTAGGAATAATGGA-30,50-GCCTCAGTTCCGAAAACCA-30;ANP,50-GGGGGTAGGATTGACAGGAT-30,50-CTCCAGGAGGGTATTCACCA-30;b-MHC,50-CCTCGCAATATCAAGGGAAA-30,50-TACAGGTGCATCAGCTCCAG-30。
2.3体外细胞的培养和处理H9c2心脏成肌细胞培养在达尔伯克(氏)改良伊格尔(氏)培养基中。融合度达50%~60%,用ISO(1μmol·L-1)或不同葛根素浓度(1,5,10,20和40μmol·L-1)进行处理。阳性对照组经雷帕霉素100μmol·L-1处理,培养在正常培养基中(包含ISO100μmol·L-1)。
用TUNEL染色法测量心肌截面细胞凋亡;AnnexinV-FITC细胞凋亡检测试剂盒用以检测H9c2细胞凋亡;GFP-LC3质粒转染H9c2细胞;GFP-LC3阳性自噬空泡量化计算自噬情况。
3 结果
3.1体内LC3B表达和AMPK抑制术后第2~3周,阳性对照组LC3B-Ⅱ降低,而p62蛋白增加,见图1A和1B;术后第6周,阳性对照组LC3B-Ⅱ增加显著多于SO组,p62蛋白显著少于SO组,阳性对照组的AMPK-Thr172磷酸化变化情况与LC3B-Ⅱ变化相似,见图1C和1D。
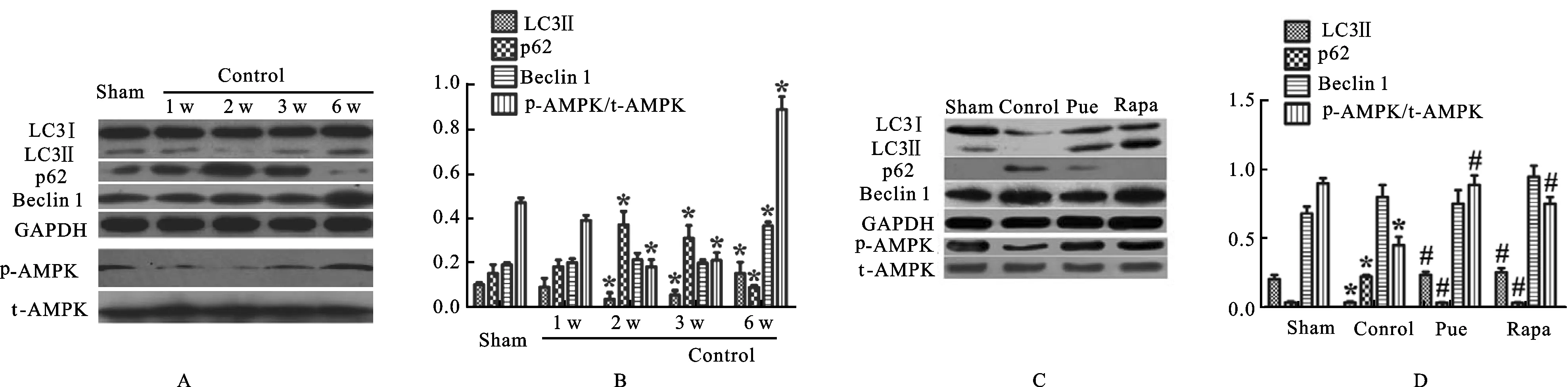
图1葛根素对体内自噬的影响
A.免疫分子在阳性对照组与假手术组的免疫印迹结果;B.阳性对照组与假手术组的相应免疫分子柱状图;C.免疫分子在4组的免疫印迹结果;D.4组的相应免疫分子柱状图
Fig.1Effectsofpuerarinonautophagyinin vivostudy
A.westernblotresultsofimmunemoleculesinpositivecontrolgroupandSOgroup;B.correspondinghistogramofimmunemoleculesinpositivecontrolgroupandtheSOgroup;C.westernblotresultsofimmunemoleculesinthe4groups;D.correspondinghistogramofimmunemoleculesinthe4groups
3.2葛根素通过激活AMPK恢复自噬术后第3周观察到阳性对照组AMPK-Thr172磷酸化减少。葛根素组治疗3周,LC3B-Ⅱ显著增加,同时p62蛋白下降。此外,葛根素组AMPK磷酸化增加。大鼠经雷帕霉素组治疗后,自噬变化情况与葛根素组相似。3.3葛根素预防心脏肥大和重构阳性对照组术后6周,未发现左心室功能受损,见图2A和2B。然而,肥厚性指标,如左心室后壁舒张末期厚度(LVPWd)、左心室后壁收缩末期厚度(LVPWs)、室间隔舒张末期厚度(IVSd)和室间隔厚度显著增加。葛根素组和雷帕霉素组以上指标显著降低,见图2C。苏木精-伊红染色发现,阳性对照组肌细胞染色截面积增多,而葛根素组和雷帕霉素组治疗后,染色截面积显著缩减,见图2D和2E。Masson染色证明,阳性对照组间质和血管周纤维化增加,葛根素组和雷帕霉素组治疗显著降低肌细胞面积和纤维化,见图2F和图2G。HW/BW和LVm/BW变化情况相似,见图2H。此外,阳性对照组ANP和β-MHCmRNA升高,葛根素组和雷帕霉素组显著降低,见图2I。
3.4葛根素保护心脏细胞凋亡相比SO组,阳性对照组术后6周心脏细胞凋亡明显增加,半胱天冬酶-3蛋白裂解增加,见图2J。SO组TUNEL-阳性细胞少于阳性对照组。葛根素组和雷帕霉素组少见心脏细胞凋亡,见图2K。

图2术后第6周AB诱导LV肥大和细胞凋亡
A.超声心动图;B.左心室功能;C.心脏结构指数;D.H&E染色;E.H&E染色;F.间质Masson染色,葛根素及雷帕霉素显著降低纤维化和肌细胞面积;G.血管周围Masson染色,葛根素及雷帕霉素显著降低纤维化和肌细胞面积;H.HW/BWa和LVm/BW;I:ANP和bMHC肥大相关基因定量逆转录PCR分析;J.阳性对照组半胱天冬酶-3蛋白裂解;K.葛根素组和雷帕霉素组心脏细胞凋亡
Fig.2EvidenceofattenuationofAB-inducedLVhypertrophyandapoptosisat6weeks
A.picturesofechocardiography;B.leftventricularfunction;C.indexesofcardiacstructure;D.H&Estaining;E.H&Estaining;F.Massontrichromestainingforinterstitialfibrosis,andbothpuerarinandrapamycintreatmentsignificantlyreducedmyocyteareaandfibrosis;G.Massontrichromestainingforperivascularfibrosisandbothpuerarinandrapamycintreatmentsignificantlyreducedmyocyteareaandfibrosis;H.HW/BWandLVm/BW;I.PCRanalysisofthehypertrophy-relatedgenesANPandbMHC;J.positivecontrolgroupcaspase-3proteincracking;k.cardiaccellapoptosisinpueraringroupandrapamycingroup
3.5自噬功能障碍与AMPK抑制体外研究用ISO处理H9c2细胞6h后,LC3B-Ⅱ和AMPK降低,见图3A;用ISO治疗H9c2细胞12h后,LC3B-Ⅱ增加,AMPK激活。
3.6葛根素恢复自噬活性体外研究发现,葛根素组与雷帕霉素组相似,预处理H9c2细胞24h后,再与ISO共同培养6h,LC3B-Ⅱ呈剂量依赖性增加,见图3B;葛根素可恢复siRNA转染的细胞LC3-Ⅱ水平,但不能恢复AMPK-Si转染的细胞LC3-Ⅱ水平,见图3C;氯喹预处理H9c2细胞16h,H9c2细胞中LC3B-Ⅱ增加,但此种效应能被ISO减弱。细胞经葛根素(20μmol·L-1)和CQ预处理,然后与ISO共同培养,增加GFP-LC3的数量。
3.7葛根素调节mTOR信号途径术后3周,阳性对照组mTOR磷酸化及其下游效应器S6K和4EBP1显著增加。葛根素组及雷帕霉素组治疗后,mTOR,S6K和4EBP1磷酸化明显减少,表明葛根素抑制mTOR磷酸化,从而恢复自噬活性。
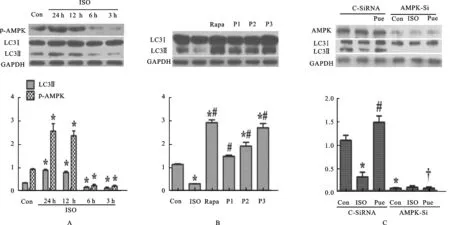
图3葛根素对自噬及心肌细胞肥大的影响
A.异丙肾上腺素对H9c2自噬的影响;B.葛根素对自噬活性的影响;C.葛根素不同影响CsiRNA及AMPK-si转染的细胞自噬活性
Fig.3Effectsofpuerarinonautophagyandcardiomyocytehypertrophy
A.effectsofisoprenalineonautophagyinH9c2withtime;B.puerarinpretreatmentfor24hfollowedbyco-culturewithISOfor6h;C.differentinfluencesofCsiRNAandAMDK-sitransfectioncellautophagyactivitybypuerarin
4 讨论
研究结果证明,葛根素调控AMPK/mTOR信号途径,参与自噬激活,发挥减缓心脏肥大和抑制心脏细胞凋亡作用。目前的研究结果与前人数据一致,大鼠经葛根素治疗6周后,心脏肥大和细胞凋亡指标明显好转。同样,葛根素治疗也能降低ANP和β-MHCmRNA的表达,减缓ISO引发的H9c2细胞凋亡。心脏细胞应对各种各样的压力反应时,自噬可以发挥重要的作用[5]。先前的心脏肥大动物模型数据已经表明,自噬是维持心脏细胞形态和心脏功能的关键,可消除受伤的细胞器和蛋白质,但过度自噬却能诱导心肌细胞死亡[6]。然而,心脏持续过载诱发心力衰竭,过度激活自噬,最终导致心脏细胞死亡[7]。因此,自噬水平的变化可反映心脏肥大的不同阶段。
研究发现,雷帕霉素治疗大鼠,可有效减轻阳性症状,包括预防心脏肥大恶化、迟滞心肌重构、抑制心脏细胞凋亡和激活自噬。葛根素治疗可产生类似的效果。3-甲基腺嘌呤预处理H9c2细胞,葛根素未能降低肥大和凋亡指标。结果表明,葛根素的保护作用与自噬有关。
WangXC等[8]研究葛根素治疗帕金森病,证明葛根素能够防止活性氧的增加,通过分子伴侣介导的自噬途径,防止氧化损伤。其次,AMPK/mTOR信号途径可能参与自噬分子机制。已有数据表明,AMPK/mTOR信号参与心脏肥大的发展[9]。本文体内研究观察表明,AMPK磷酸化水平下降,伴随LC3-Ⅱ减少。
雷帕霉素抑制mTOR从而阻断p70S6K激活和心脏肥大。目前的研究中,葛根素抑制mTOR信号途径,显著降低S6磷酸化和4EBP1磷酸化。这表明葛根素对mTOR发挥抑制作用,同时诱导活化自噬。
研究结果表明,葛根素促进自噬,刺激AMPK磷酸化,抑制mTOR磷酸化,最终发挥抗心脏肥大效应。
[1]邓玉杰,杨颖.自噬与能量代谢[J].中华内分泌代谢杂志,2014,30(4): 349-352.
[2]查勇,寸英丽,黄云超.苦参碱对肝癌细胞株SMMC-7721凋亡和自噬相关基因表达的影响[J].世界华人消化杂志,2010,18(29):3078-3083.
[3]罗敬华,曾晓艳,范桂香,等.葛根素对神经病理性痛模型小鼠的镇痛作用[J].西北药学杂志,2013,28(1):48-50.
[4]刘喜舞,叶惠煊,戴玲,等.泰国葛根化学成分研究[J].西北药学杂志, 2015,30(6):664-666.
[5]李婷婷,王维蓉,林蓉.Sirtuins去乙酰化修饰调控心血管疾病过程中的细胞自噬[J].生理科学进展,2014,45(6):425-428.
[6]焦慧,张志,马清华,等.Apelin-13对葡萄糖剥夺乳鼠心肌细胞自噬的影响及机制[J].解放军医学院学报,2013,34(2):167-171.
[7]NakaiA,YamaguchiO,TakedaT,etal.Theroleofautophagyincardiomyocytesinthebasalstateandinresponsetohemodynamicstress[J].NatMed,2007,13(5):619-624.
[8]WangXC,WangX,LiQL.Effectofchaperone-mediatedautophagyinMPP(+)-inducedSH-SY5Ycellsandinterventionaleffectofpuerarin[J].ChinaJChimatermed,2014,39(1): 106-112.
[9]AlersS,LöfflerAS,WesselborgS,etal.RoleofAMPK-mTOR-Ulk1/2intheregulationofautophagy:crosstalk,shortcuts,andfeedbacks[J].MolCellBiol,2012,32(1): 2-11.
Protective effect and mechanism of puerarin prevent cardiac hypertrophy from pressure overload
QIN Hua1,ZHANG Yan1,WANG Siwang2,WANG Ru1*
(DepartmentofPharmacy,TangduHospital,theFourthMilitaryMedicalUniversity,Xi′an710038,China;DepartmentofPharmacy,theFourthMilitaryMedicalUniversity,ShaanxiXi′an710032,China)
ObjectiveTocertifytheprotectiveeffectsofpuerarinoncardiachypertrophyinrats,andtostudytherelatedmechanism.Methods40maleSpragueeDawleyrats(weight80-100g)withmyocardialhypertrophycausedbyaortasurgery(descendingaortaligation,aorticbanding,AB),weredividedintothepositivecontrolgroup(con),sham-operatedgroup(SO),pueraringroup(Pue)andrapamycingroup(Rapa).Theactivatedproteinkinase(5′-adenosinemonophosphatekinase,AMPK)activityandthefunctionofautophagyweretested.Atthesametime,themyocardialeffectscausedbyisopropyladrenalineand3-methyladeninewerein vitrotested.ResultsAfter3weeks,theratstreatedwithpuerarinrecoveredautophagy.6weeksafterpuerarintreatment,themyocytehypertrophyandapoptosiswereeffectivelylimited.Rapamycingrouphadsimilarfunction.Inin vitrostudies,puerarinalsohadsimilarhypertrophyandapoptosisresistanceeffectsinH9c2cellspretreatedbyisopropyl.ButtheprotectionofpuerarinwasblockedinH9c2cellspretreatedby3-methyladenine.ConclusionAllthesedataindicatethatpuerarinexertsprotectiveeffectsagainstcardiomyocytehypertrophyandapoptosis,partlybyrestorationofautophagythroughAMPK/mTOR-mediatedsignaling.
puerarin;cardiachypertrophy;autophagy;AMPK
陕西省“13115”工程技术研究中心资助项目(编号:S2010ZDGC105)
覃华,女,主管药师
王茹,女,副主任药师
10.3969/j.issn.1004-2407.2016.05.012
R965
A
1004-2407(2016)05-0478-05
2016-02-20)
——雷帕霉素

