肝细胞癌组织中高尔基体蛋白73和转化生长因子β1及Smad2的表达水平及其意义
黄风玲,杨 颖,张瑞丽,毛 睿,刘 攀,孙 毅,张 华,包永星
肝细胞癌组织中高尔基体蛋白73和转化生长因子β1及Smad2的表达水平及其意义
黄风玲,杨 颖,张瑞丽,毛 睿,刘 攀,孙 毅,张 华,包永星
目的探讨高尔基体蛋白73(GP73)及转化生长因子β(TGF-β)/Smads信号通路与肝细胞癌(肝癌)的关系。方法选取2010年1月—2014年12月新疆医科大学第一附属医院病理科收集的80例肝癌患者的肝癌组织及癌旁组织蜡块标本,并从本院病案室调阅患者的临床病历资料,包括性别、年龄、乙型肝炎表面抗原(HBsAg)、血清甲胎蛋白(AFP)水平、有无肝硬化、有无门静脉癌栓、分化程度、TNM分期、有无血管侵犯。采用免疫组织化学EnVision二步法检测肝癌组织和癌旁组织GP73、TGF-β1和Smad2的阳性表达情况和积分光密度(IOD)。结果GP73定位于胞质,呈棕黄色颗粒。肝癌组织GP73阳性表达率为73.8%(59/80),高于癌旁组织的5.0%(4/80)(χ2=76.50,P<0.05)。TGF-β1和Smad2主要表达于胞质,偶见于胞核,为棕黄色深染颗粒。肝癌组织TGF-β1阳性表达率为81.2%(65/80),高于癌旁组织的6.2%(5/80)(χ2=65.67,P<0.05);肝癌组织Smad2阳性表达率为66.2%(53/80),高于癌旁组织的10.0%(8/80)(χ2=47.62,P<0.05)。Spearman相关分析结果显示,GP73与TGF-β1、Smad2呈正相关(rs=0.841、0.405,P<0.05)。不同性别患者肝癌组织GP73、Smad2表达水平比较,差异均无统计学意义(P>0.05),TGF-β1表达水平比较,差异有统计学意义(P<0.05);不同年龄、HBsAg、AFP、有无肝硬化及门静脉癌栓患者肝癌组织GP73、TGF-β1和Smad2表达水平比较,差异均无统计学意义(P>0.05);不同分化程度、TNM分期、有无血管侵犯患者肝癌组织GP73、TGF-β1和Smad2表达水平比较,差异均有统计学意义(P<0.05)。结论GP73在肝癌组织中多呈阳性表达,其可能通过调控TGF-β/Smads信号通路参与肝癌的发生与发展。
癌,肝细胞;转化生长因子β1;Smad2蛋白质;高尔基体蛋白73
黄风玲,杨颖,张瑞丽,等.肝细胞癌组织中高尔基体蛋白73和转化生长因子β1及Smad2的表达水平及其意义[J].中国全科医学,2016,19(26):3191-3195.[www.chinagp.net]
HUANG F L,YANG Y,ZHANG R L,et al.Expression level and significance of GP73,TGF-β1and Smad2 in hepatocellular carcinoma tissues[J].Chinese General Practice,2016,19(26):3191-3195.
肝细胞癌(肝癌)是人类最常见的恶性肿瘤之一,根据全球最新数据统计,肝癌发病率在全身恶性肿瘤中位居第6位,病死率位居第2位;在我国形势更加严峻,发病和死亡人数占全球50%以上,堪称肝癌大国[1]。高尔基体蛋白73(Golgi protein 73,GP73)是一种新颖的Ⅱ型高尔基体跨膜糖蛋白,是潜在的肝癌血清肿瘤标志物,然而其在肝癌发生、发展中的功能及调节机制尚罕见报道。转化生长因子β1(transforming growth factor β1,TGF-β1)是一种多功能的细胞因子,其介导的TGF-β/Smads信号通路与多种肿瘤的发生及侵袭、转移密切相关。本研究采用免疫组织化学染色的方法,对肝癌组织及癌旁组织中GP73、TGF-β1和Smad2的表达水平进行检测,从组织学水平上初步探讨GP73及TGF-β/Smads信号通路与肝癌发生/发展的可能机制,为进一步在分子学水平上探讨肝癌发病机制提供理论依据。
1 材料与方法
1.1组织标本经新疆医科大学第一附属医院伦理委员会批准,选取2010年1月—2014年12月新疆医科大学第一附属医院病理科收集的80例肝癌患者的肝癌组织及癌旁组织蜡块标本,并从本院病案室调阅该80例患者的临床病历资料,包括性别、年龄、乙型肝炎表面抗原(HBsAg)、血清甲胎蛋白(AFP)水平、有无肝硬化、有无门静脉癌栓、分化程度、TNM分期、有无血管侵犯。80例患者病历资料完整;术前均未行放疗、化疗、射频消融及生物治疗等内科治疗,术后病理学确诊为肝癌;组织蜡块均经病理科两名资深医生进行HE染色,形态符合肝癌确诊依据[2]。
1.2方法
1.2.1主要试剂与仪器兔抗人GP73多克隆抗体购自美国Proteintech Group公司,兔抗人TGF-β1多克隆抗体
1.2.2GP73、TGF-β1和Smad2检测采用免疫组织化学EnVision二步法检测肝癌组织和癌旁组织GP73、TGF-β1和Smad2的表达情况。组织标本常规石蜡包埋,5 μm厚连续切片。石蜡切片经烤箱脱蜡后水化,3% H2O2阻断内源性过氧化物酶,微波炉枸橼酸抗原修复液修复,冷却后滴加一抗4 ℃冰箱过夜。每批实验均设阳性和阴性对照,其中阳性对照为兔抗人GP73多克隆抗体、兔抗人TGF-β1多克隆抗体和兔抗人Smad2多克隆抗体,阴性对照为不加抗体的PBS;一抗工作液体浓度均为1∶50。次日滴加辣根过氧化物酶标记的二抗,37 ℃温箱孵育30 min,光镜下观察二氨基联苯胺(DAB)显色,苏木素复染,脱水,透明,中性树胶封固,镜下观察。
1.2.3结果判定(1)由两名病理科医生根据染色强度独立进行结果判定,以胞质显色为棕黄色至棕褐色颗粒为阳性细胞;按照着色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。使用ImageJ2x图像分析软件计算每个视野下阳性部位面积的百分比,每张切片随机选择5个视野,取其平均值为该张切片的阳性表达面积;按照阳性表达面积百分比评分:无阳性表达面积为0分,1%~20%为1分,21%~50%为2分,51%~80%为3分,>80%为4分。两项得分相乘,0~1分为“-”,2~4分为“+”,5~7分为“++”,8~12分为“+++”。将“-~+”定义为蛋白低表达即阴性表达,将“++~+++”定义为蛋白高表达即阳性表达。(2)应用CMIAS真彩色医学图像分析系统,每张切片随机选择5个高倍(×200)视野,分别对各组5个视野中的免疫组织化学结果进行积分光密度(integral optical density,IOD)测定,然后计算平均IOD。

2 结果
2.1肝癌组织和癌旁组织GP73、TGF-β1和Smad2阳性表达率比较GP73定位于胞质,呈棕黄色颗粒(见图1,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。肝癌组织GP73阳性表达率为73.8%(59/80),癌旁组织GP73阳性表达率为5.0%(4/80),两者GP73阳性表达率比较,差异有统计学意义(χ2=76.50,P<0.05)。TGF-β1和Smad2主要表达于胞质,偶见于胞核,为棕黄色深染颗粒(见图2、3)。肝癌组织TGF-β1阳性表达率为81.2%(65/80),癌旁组织TGF-β1阳性表达率为6.2%(5/80),两者TGF-β1阳性表达率比较,差异有统计学意义(χ2=65.67,P<0.05);肝癌组织Smad2阳性表达率为66.2%(53/80),癌旁组织Smad2阳性表达率为10.0%(8/80),两者Smad2阳性表达率比较,差异有统计学意义(χ2=47.62,P<0.05)。
2.2肝癌组织GP73与TGF-β1、Smad2的相关性Spearman相关分析结果显示,GP73与TGF-β1、Smad2呈正相关(rs=0.841、0.405,P<0.05)。
2.3不同临床特征患者肝癌组织GP73、TGF-β1和Smad2表达水平比较不同性别患者肝癌组织GP73、Smad2表达水平比较,差异均无统计学意义(P>0.05),TGF-β1表达水平比较,差异有统计学意义(P<0.05);不同年龄、HBsAg、AFP、有无肝硬化及门静脉癌栓患者肝癌组织GP73、TGF-β1和Smad2表达水平比较,差异均无统计学意义(P>0.05);不同分化程度、TNM分期、有无血管侵犯患者肝癌组织GP73、TGF-β1和Smad2表达水平比较,差异均有统计学意义(P<0.05,见表1)。

图1 GP73在肝癌组织及癌旁组织中的表达(免疫组织化学DAB显色,×400)
Figure1ExpressionofGP73inhepatocellularcarcinomatissuesandpara-carcinomatissues

图2 TGF-β1在肝癌组织及癌旁组织中的表达(免疫组织化学DAB显色,×400)
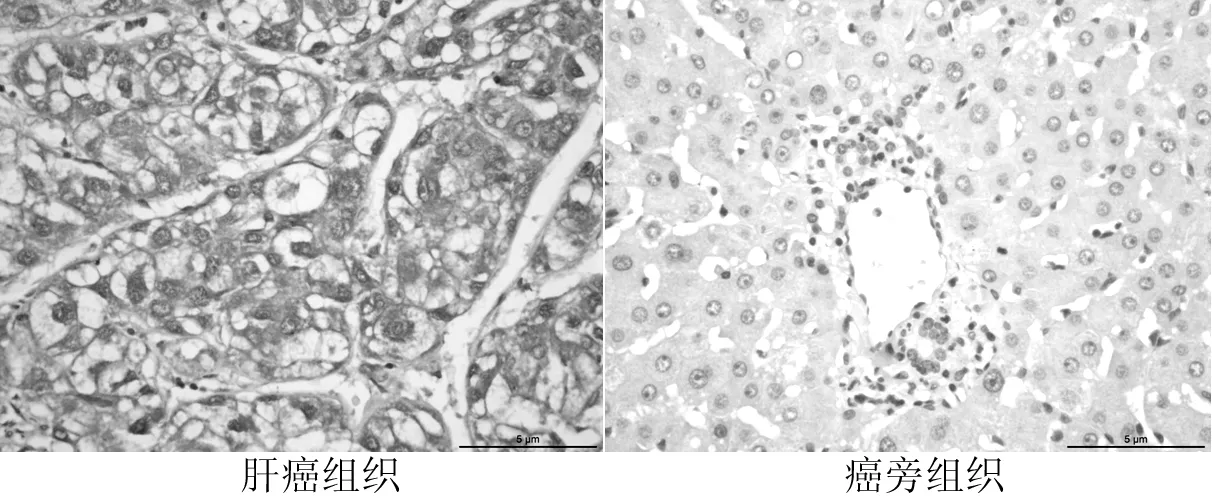
图3 Smad2在肝癌组织及癌旁组织中的表达(免疫组织化学DAB显色,×400)
3 讨论

表1 不同临床特征患者肝癌组织GP73、TGF-β1和Smad2表达水平比较±s)
注:IOD=积分光密度,GP-73=高尔基体蛋白73,TGF-β1=转化生长因子β1,HBsAg=乙型肝炎表面抗原,AFP=甲胎蛋白
GP73是一种新近发现的Ⅱ型高尔基体跨膜糖蛋白,因其在十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳中显示相对分子量为7.3×104而得名。2000年,KLADNEY等[3]在构建成人巨大细胞性肝炎(giant cell hepatitis,GCH)时首次发现GP73,进一步研究发现,在病毒性肝炎、自身免疫性肝炎、酒精性肝硬化患者肝组织中GP73的表达明显高于正常组[4]。2004年,MAITRA等[5]研究发现GP73可以在血清中检测到,并认为GP73可以作为肝脏疾病的标志物。在亚洲人群的研究中,毛一雷等[6]初步确立了我国正常人GP73参考范围,并说明GP73不但可以作为诊断肝癌的敏感性指标,而且对预测预后有一定的价值。同时,本课题组前期研究也证实血清GP73水平在肝癌患者中升高最为明显,临床上认为其可能成为肝癌早期诊断的理想标志物[7-9]。
2011年肿瘤权威教授CHAFFER等[10]指出肿瘤细胞只有发生上皮-间质转化(epithelial-mesenchymal transition,EMT)具备了运动侵袭能力,才能进行局部浸润和远处转移。因此研究肝癌发生EMT的关键分子及信号通路对阻断肝癌细胞侵袭、转移的发生和发展有非常重要的意义。2013年本课题组就GP73在肝癌发生、发展中的调节机制进行初步研究发现,GP73与EMT关系密切,发生EMT的主要分子特征是上皮细胞标志物如E-钙黏蛋白(E-cadherin)表达下调和间质细胞标志物如波形蛋白(Vimentin)表达上调[11-12]。2014年ZHANG等[13]首先报道在肝癌细胞株HepG2及BEL-7402中应用siRNA对GP73进行干扰后亦提示GP73在肝癌发生、发展的机制中起到重要作用。目前尽管国内外学者对GP73作为肝癌相关性蛋白的研究已取得一定进展,但是,绝大多数研究仅停留在GP73作为肝癌血清肿瘤标志物的方向,其在肝癌发生、发展中的功能及调节机制未明确阐明,严重阻碍其临床价值的转化。
EMT的发生涉及多个环节,其分子通路十分复杂,但在诱导EMT发生的众多细胞因子和转录因子中,TGF-β被证实是诱导EMT的关键因子,TGF-β共有3种,即TGF-β1、TGF-β2、TGF-β3,其中TGF-β1在肿瘤中主要参与刺激细胞生长、诱导细胞分化和凋亡等精细调节活动,近年来诸多研究报道TGF-β能够诱导体内、体外多种肿瘤细胞发生EMT,认为肿瘤细胞系中转入外源性TGF-β后获得EMT特征,侵袭、转移能力增加;反之抑制TGF-β信号通路后能逆转EMT的发生,抑制肿瘤细胞的侵袭和转移[14-15]。TGF-β在EMT中起着中心作用,即肿瘤转移的关键分子事件。TGF-β介导EMT主要涉及Smad依赖[16]和Smad非依赖[17]两条信号通路。在Smad依赖信号通路中,TGF-β与细胞膜上Ⅱ型受体结合,Ⅱ型受体激酶诱导Ⅰ型受体磷酸化,并与Smad2/3形成复合物。Smad2/3磷酸化后,与Smad4形成异三聚体或四聚体,使E-cadherin表达下调和Vimentin表达上调,介导EMT发生。因此本研究采用免疫组织化学染色的方法在组织学水平初步探讨GP73与TGF-β/Smads信号通路的关系。本研究结果显示,80例组织蜡块中GP73和TGF-β1、Smad2在肝癌组织中阳性表达率高于癌旁组织,并且Spearman相关分析显示,在肝癌组织中GP73与TGF-β1、Smad2均呈正相关,GP73、TGF-β1和Smad2表达水平与肝癌的分化程度、TNM分期及血管侵犯关系密切。
综上所述,本研究结果表明,GP73的表达与TGF-β/Smads信号通路关系密切,但其具体作用机制及是否还有其他信号通路的参与,进而调节肝癌的发生与发展,有待进一步的分子水平实验研究加以证实。
作者贡献:黄风玲、杨颖进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;张瑞丽、毛睿、刘攀、孙毅、张华进行实验实施、评估、资料收集;包永星进行质量控制及审校。
本文无利益冲突。
[1]Global Burden of Disease Cancer Collaboration,FITZMAURICE C,DICKER D,et al.The global burden of cancer 2013[J].JAMA Oncol,2015,1(4):505-527.
[2]WU T T,BOITNOTT J.Dysplastic nodules:a new term for premalignant hepatic nodular lesions[J].Radiology,1996,201(1):21-22.
[3]KLADNEY R D,BULLA G A,GUO L,et al.GP73,a noval Golgi-localized protein upregulated by viral infection[J].Gene,2000,249(1/2):53-65.
[4]KLADNEY R D,CUI X,BULLA G A,et al.Expression of GP73,a resident Golgi membrane protein,in viral and nonviral liver disease[J].Hepatology,2002,35(6):1431-1440.
[5]MAITRA A,THULUVATH P J.GP73 and liver disease:a(golgi)complex enigma[J].Am J Gastroenterol,2004,99(6):1096-1098.
[6]毛一雷,杨华瑜,徐海峰,等.新的肝癌血清标记物GP73在肝癌诊断中的初步研究[J].中华医学杂志,2008,88(14):948-951.
MAO Y L,YANG H Y,XU H F,et al.Significance of Golgiglycoprotein 73,a new tumor marker in diagnosis of hepatocellular carcinoma:a primary study[J].National Medical Journal of China,2008,88(14):948-951.
[7]杨颖,木尼热·马合苏提,包永江,等.GP73和AFP单项与联合诊断原发性肝癌的价值[J].中华检验医学杂志,2012,35(11):1034-1037.
[8]杨颖,肖蕾,毛睿,等.高尔基体蛋白73的表达特征及其对肝癌与肝硬化的鉴别诊断价值[J].中华肝脏病杂志, 2012,20(12):920-924.
YANG Y,XIAO L,MAO R,et al.Expression profiles and differential diagnostic value of serum Golgi protein-73 in patients with liver cirrhosis and primary hepatic carcinoma[J].Chinese Journal of Hepatology,2012,20(12):920-924.
[9]包永星,杨颖,赵化荣,等.高尔基体蛋白73对早期肝癌的诊断价值及临床意义[J].中华肿瘤杂志,2013,35(7):505-508.
BAO Y X,YANG Y,ZHAO H R,et al.Clinical significance and diagnostic value of Golgi-protein 73 in patients with early-stage primary hepatocellular carcinoma[J].Chinese Journal of Oncology,2013,35(7):505-508.
[10]CHAFFER C L,WEINBERG R A.A perspective on cancer cell metastasis[J].Science,2011,331(6024):1559-1564.
[11]BAO Y X,CAO Q,YANG Y,et al.Expression and prognostic significance of golgiglycoprotein73(GP73)with epithelial-mesenchymal transition(EMT)related molecules in hepatocellular carcinoma(HCC)[J].Diagn Pathol,2013,8:197.
[12]毛睿,杨颖,曹茜,等.高尔基体糖蛋白73在肝细胞肝癌组织中的表达及意义[J].世界华人消化杂志,2014,22(32):4996-5000.
MAO R,YANG Y,CAO Q,et al.Significance of expression of Golgiglycoprotein 73 in hepatocellular carcinoma[J].World Chinese Journal of Digestology,2014,22(32):4996-5000.
[13]ZHANG Y L,ZHANG Y C,HAN W,et al.Effect of GP73 silencing on proliferation and apoptosis in hepatocellular cancer[J].World J Gastroenterol,2014,20(32):11287-11296.
[14]WENDT M K,TIAN M,SCHIEMANN W P,et al.Deconstructing the mechanisms and consequences of TGF-β induced EMT during cancer progression[J].Cell Tissue Res,2012,347(1):85-101.
[15]GREGORY P A,BRACKEN C P,SMITH E,et al.Anautocrine TGF-beta/ZEB/miR-200 signaling network regulates establishment and maintenance of epithelial-mesenchymal transition[J].Mol Biol Cell,2011,22(10):1686-1698.
[16]DERYNCK R,ZHANG Y E.Smad-dependent and Smad-independent pathways in TGF-beta family signaling[J].Nature,2003,425(6958):577-584.
[17]ZHANG Y E.Non-smad pathways in TGF-beta signaling[J].Cell Res,2009,19(1):128-139.
(本文编辑:贾萌萌)
Expression Level and Significance of GP73,TGF-β1and Smad2 in Hepatocellular Carcinoma Tissues
HUANGFeng-ling,YANGYing,ZHANGRui-li,MAORui,LIUPan,SUNYi,ZHANGHua,BAOYong-xing.TumorCenter,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China
Correspondingauthor:BAOYong-xing,TumorCenter,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China;E-mail:baoyx@vip.sina.com
ObjectiveTo investigate the relationship between Golgi protein 73(GP73),TGF-β/Smads signaling pathway and hepatocellular carcinoma.Methods80 cases of paraffin-embedded samples of hepatocellular carcinoma tissues and para-carcinoma tissues collected by Pathology Department of the First Affiliated Hospital of Xinjiang Medical University were selected from January 2010 to December 2014.And clinical data of these patients were consulted from the Medical Records Room of our hospital,including gender,age,hepatitis B surface antigen(HBsAg),alpha fetoprotein(AFP)level,with or without liver cirrhosis,with or without portal vein tumor thrombus,differentiation degree,TNM staging,with or without vascular invasion.Immunohistochemistry EnVision system was adopted to detect positive expression and IOD of GP73 and TGF-β1,Smad2 in hepatocellular carcinoma tissues and para-carcinoma tissues.ResultsGP73,claybank particles,were located in cytoplasm.The positive expression rate of GP73 in hepatocellular carcinoma tissues was 73.8%(59/80),higher than 5.0%(4/80)(χ2=76.50,P<0.05) of para-carcinoma tissues.TGF-β1,Smad2 mainly expressing in cytoplasm,occasionally in karyon,were claybank dense granule.TGF-β1positive expression rate in hepatocellular carcinoma tissues was 81.2%(65/80),higher than 6.2%(5/80)(χ2=65.67,P<0.05)of para-carcinoma tissues.Smad2 positive expression rate in hepatocellular carcinoma tissues was 66.2%(53/80),higher than 10.0%(8/80)(χ2=47.62,P<0.05)of para-carcinoma tissues.Spearman relevant analysis results showed that GP73 correlated positively with TGF-β1,Smad2(rs=0.841,0.405,P<0.05).The comparison of the expression levels of GP73,Smad2 in patients with different gender were not statistically significant(P>0.05),the comparison of the expression levels of TGF-β1in patients with different gender was statistically significant(P<0.05);the comparison of the expression levels of GP73,TGF-β1and Smad2 in patients with different age,HBsAg,AFP,with or without liver cirrhosis,with or without portal vein tumor thrombus were not statistically significant(P>0.05);the comparison of the expression levels of GP73,TGF-β1and Smad2 in patients with different differentiation degree,TNM staging,with or without vascular invasion were all statistically significant(P<0.05).ConclusionGP73,mainly expressing positively in hepatocellular carcinoma tissues,may be involved in the occurrence and development of hepatocellular carcinoma through the regulation of TGF-β/Smads signaling pathway.
Carcinoma,hepatocellular;Transforming growth factor beta1;Smad2 protein;Golgi protein 73
新疆维吾尔自治区自然科学基金资助项目(2014211C070)
830054新疆乌鲁木齐市,新疆医科大学第一附属医院肿瘤中心
包永星,830054新疆乌鲁木齐市,新疆医科大学第一附属医院肿瘤中心;E-mail:baoyx@vip.sina.com
R 730.261
A
10.3969/j.issn.1007-9572.2016.26.013
2016-01-12;
2016-05-13)

