血小板反应素蛋白2在高原地区胃黏膜炎性病变及胃癌患者中表达的差异研究
贺春兰,张梦兰,杨 勇,苟笑丹,贺菊香,李菊英
血小板反应素蛋白2在高原地区胃黏膜炎性病变及胃癌患者中表达的差异研究
贺春兰,张梦兰,杨 勇,苟笑丹,贺菊香,李菊英
背景血小板反应素蛋白2(THBS2)在成纤维细胞中高表达,在内皮细胞中则缺乏表达。研究显示,THBS2在正常组织中高表达,在胃癌及成骨肉瘤中表达明显下降,提示与肿瘤的形成呈负相关。青海位于青藏高原且是胃癌高发区,THBS2在高原地区胃癌患者的表达情况尚未见文献报道。目的研究THBS2在高原地区患者胃黏膜炎性病变及胃癌组织中的表达情况,探讨THBS2与高原地区不同胃黏膜病变间的关系及意义。方法选取2012年12月—2015年2月青海大学附属医院腔镜中心检查的30例胃黏膜炎性病变患者的标本及青海省人民医院住院的30例胃癌患者的手术标本〔分别取胃癌组织、癌旁组织(距离胃癌组织5 cm)及正常胃黏膜组织〕,采用组织芯片技术和免疫组织化学方法检测胃黏膜组织THBS2表达情况,采用实时荧光定量反转录聚合酶链式反应(RT-qPCR)法检测THBS2 mRNA表达情况。比较不同临床特征患者胃黏膜炎性病变及胃癌组织中THBS2、THBS2 mRNA阳性率的差异。结果免疫组织化学法显示,THBS2主要表达于细胞质和细胞膜中,呈现黄色或棕黄色染色。胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率较正常胃黏膜组织、胃癌组织升高(P<0.017)。不同性别、年龄、民族、病变性质患者胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率比较,差异无统计学意义(P>0.05)。正常胃黏膜组织、癌旁组织及胃癌组织THBS2、THBS2 mRNA阳性率比较,差异无统计学意义(P>0.05)。不同性别、年龄、民族、肿瘤大小、有无淋巴结转移患者胃癌组织THBS2、THBS2 mRNA阳性率比较,差异无统计学意义(P>0.05);不同分化程度、浸润深度胃癌组织THBS2、THBS2 mRNA阳性率比较,差异有统计学意义(P<0.05)。结论THBS2可能参与了高原地区人群胃黏膜炎性病变的发生、发展,THBS2表达与胃癌的分化程度、浸润深度相关,THBS2可以作为胃黏膜炎性病变进展及胃癌预后或观察疗效的指标。
胃肿瘤;胃炎;胃黏膜;血小板反应素蛋白2;高海拔
贺春兰,张梦兰,杨勇,等.血小板反应素蛋白2在高原地区胃黏膜炎性病变及胃癌患者中表达的差异研究[J].中国全科医学,2016,19(26):3185-3190.[www.chinagp.net]
HE C L,ZHANG M L,YANG Y,et al.Differences in the expression of THBS2 in gastric mucosal inflammatory lesions and gastric cancer tissues of patients on plateaus[J].Chinese General Practice,2016,19(26):3185-3190.
胃癌是最常见的恶性肿瘤之一,其发病率和病死率分别居世界第4位和第2位[1]。青海是国内胃癌高发地区之一,由于经济条件相对落后,大部分胃癌患者就诊时已属于晚期,失去了最佳的治疗机会,严重威胁当地居民生命健康。胃癌的发生与环境和遗传有重要关系。研究发现,胃癌的发生从浅表性胃炎→慢性萎缩性胃炎→胃黏膜异常增生,发展为胃癌[1],所以,寻找和发现诊断胃黏膜炎性病变的有效因子,对干预和预防胃癌的发生有重要意义。血小板反应素蛋白(thrombospondin,THBS)包括THBS1、THBS2、THBS3、THBS4、THBS5 5个成员,根据结构和功能不同分为A、B两个亚型,A亚型包括THBS1和THBS2,均具有相同的三聚体结构,由186个氨基酸残基组成,包括N端球状结构域、原胶原同源区、备解区重复序列、表皮生长因子样重复序列、钙离子结合域、C端球状结构域。THBS2有多种生物学功能,促进炎性细胞的游出、影响血管的形成、肿瘤细胞浸润和转移[2-3]。对于THBS2在高原地区胃黏膜病变患者中研究较少,本研究主要通过检测THBS2在高原地区患者不同胃黏膜病变组织中的表达情况,探讨THBS2在高原地区患者胃黏膜炎性病变的发生、发展以及胃癌形成中作用。
1 材料与方法
1.1材料来源收集2012年12月—2015年2月在青海大学附属医院腔镜中心检查的30例胃黏膜炎性病变患者标本,放在事先置有冰块的标本收集包中,结束后置-80 ℃冰箱保存。收集同期青海省人民医院住院的30例胃癌患者的手术标本,分别取胃癌组织、癌旁组
本文研究背景和创新点:
血小板反应素蛋白2(THBS2)是成纤维细胞、平滑肌细胞等分泌的细胞外基质糖蛋白,具有调节细胞黏附、运动、创口愈合、胚胎发育等功能,同时通过影响血管形成、细胞浸润和转移在肿瘤发生、发展中发挥作用。青海是胃癌高发区,同时由于地处青藏高原,具有高海拔、缺氧等环境特点。本研究通过在蛋白水平及基因水平对THBS2在高原、胃癌高发区人群正常胃黏膜组织、胃黏膜炎性病变及胃癌组织中的表达进行研究,发现THBS2在高原地区胃黏膜炎性病变组织中表达升高,而在胃癌组织中表达下降,且与胃癌的分化、浸润相关,提示THBS2在高原地区参与了胃黏膜炎性病变的发生、发展,但在胃癌的发生中可能是一个保护性因素。本文为探讨THBS2在高原地区人群胃黏膜损伤中的作用,预防高原地区胃癌的发生奠定了基础。
织(距离胃癌组织5 cm)及正常胃黏膜组织1 cm×1 cm,采用10%甲醛溶液固定或放置在-80 ℃冰箱保存。患者均未做过任何治疗且诊断明确、临床资料齐全。
1.2试剂THBS2抗体购自Abcam公司,即用型免疫组织化学EliVisionTMplus试剂盒(鼠/兔)购自天根生化科技(北京)有限公司(KIT-9902),试剂盒由试剂A(增强剂)和试剂B(酶标羊抗鼠/兔IgG聚合物)组成。二氨基联苯胺(DAB)显色系统(液体DAB酶底物显色试剂盒)购自天根生化科技(北京)有限公司,实验设检测片和阴性对照片,阴性对照片与检测片操作方法相同,一抗改用同种IgG,其余条件相同。
1.3方法
1.3.1组织芯片制作将收集的30套胃癌标本做成蜡块,每个蜡块选择2个点,共180个点,制作成组织芯片。采用免疫组织化学的EliVisionTM法检测THBS2的表达情况。
1.3.2免疫组织化学法检测THBS2表达30例胃黏膜炎性病变标本制成蜡块,5 μm连续切片,石蜡切片,常规苏木素-伊红(HE)染色进行复诊。胃黏膜炎性病变蜡块切片和组织芯片放置在37 ℃恒温箱内烤30 min。二甲苯脱蜡,梯度乙醇脱水。磷酸盐缓冲液(PBS)冲洗后,枸橼酸钠缓冲液进行抗原修复。PBS冲洗3次,滴加3% H2O2溶液后在37 ℃孵育10 min,滴加5%牛血清清蛋白(BSA)封闭液,室温孵育20 min。将抗THBS2抗体按1∶50稀释,37 ℃恒温箱里孵育1 h。PBS冲洗3次。加兔IgG-HRP二抗,室温放置40 min,PBS冲洗5次,DAB显色,在显微镜下掌握染色程度;蒸馏水冲洗5 min,苏木素复染40 s,蒸馏水冲洗后,饱和磷酸氢二钠浸泡2 min返蓝,蒸馏水冲洗5~10 min。最后进行梯度乙醇脱水、二甲苯透明、中性树脂封固,显微镜下读片。
1.3.3实时荧光定量反转录聚合酶链式反应(RT-qPCR)法检测THBS2 mRNA表达标本置于已加入1 000 μl裂解液的1.5 ml离心管中,用电动高速匀浆机研磨,置冰上5 min,4 ℃ 12 000 r/min离心5 min(离心半径8.0 cm),上清液转入新的2 ml离心管中,加200 μl三氯甲烷,剧烈震荡15 s,冰上放置3 min,4 ℃ 13 000 r/min离心10 min(离心半径8.0 cm),分3层,取无色水相,转入新的无RNA酶离心管内,加入200 μl的无水乙醇,转入吸附柱内,4 ℃ 12 000 r/min离心5 min(离心半径8.0 cm),加入500 μl去蛋白液(RD),4 ℃ 12 000 r/min离心30 s(离心半径8.0 cm),加入700 μl漂洗液(RW)室温静置2 min,4 ℃ 12 000 r/min离心30 s(离心半径8.0 cm),弃去液体,放入吸附柱,4 ℃ 12 000 r/min离心2 min(离心半径8.0 cm),弃去残夜。将吸附柱放入新的1.5 ml无RNA酶的离心管内,加入50 μl RNase-Free双蒸水(ddH2O),室温放置2 min,4 ℃ 12 000 r/min离心2 min(离心半径8.0 cm),获得总RNA。在紫外分光光度计上测得RNA浓度。凝胶电泳测得RNA的完整性,弃去不符合要求的RNA。采用Thermo Scientific RevertAid First Strand cDNA Synthesis Kit将总RNA反转录为cDNA。采用凯杰生物工程有限公司合成目的引物,以反转录的cDNA为模板,GAPDH引物为内参,利用PCR技术扩增THBS2 mRNA,THBS2代码为QT01671068,引物长度100 bp;GAPDH上游引物为 5′-CAAGGTCATCCATGACAACTTTG-3′,下游引物为5′-GTCCACCACCCTGTTGCTGTAAG-3′,引物长度496 bp。PCR反应条件95 ℃预变性3 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸60 s,共34个循环;最后72 ℃退火8 min。1.5%凝胶电泳检测,上样量5 μl/孔,1.5%凝胶电泳检测出现的条带。
1.3.4结果判定免疫组织化学法结果判定:显微镜下,THBS2定位于细胞质及细胞膜,染色黄色至棕黄色者为阳性细胞。每张切片观察5个高倍视野(×40),每个视野计数200个细胞。结果判断采用细胞染色比例评分,细胞百分比计算方式为:细胞百分比=阳性细胞数/总细胞数×100%。阳性细胞数≤25%为阴性,≥26%阳性。RT-qPCR法结果判定标准:Mark标记目的基因片段的大小,上样量5 μl/孔,以内参为参照,在100 bp上出现条带为阳性。
1.4统计学方法采用SPSS 17.0软件进行统计学处理,计数资料采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1免疫组织化学法检测THBS2表达免疫组织化学法显示,THBS2主要表达于细胞质和细胞膜中,呈现黄色或棕黄色染色(见图1、2,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.2正常胃黏膜组织、胃黏膜炎性病变组织、胃癌组织THBS2、THBS2 mRNA阳性率比较正常胃黏膜组织、胃黏膜炎性病变组织、胃癌组织THBS2、THBS2 mRNA阳性率比较,差异有统计学意义(P<0.05);其中胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率较正常胃黏膜组织、胃癌组织升高,差异有统计学意义(P<0.017,见表1)。
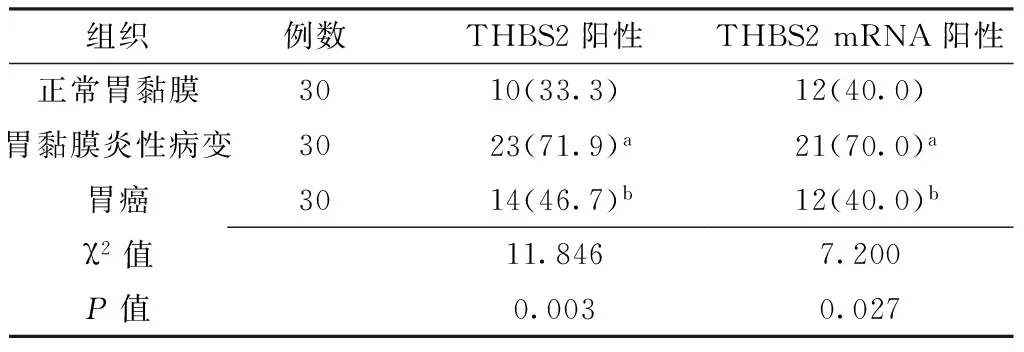
表1 正常胃黏膜组织、胃黏膜炎性病变组织、胃癌组织THBS2、THBS2 mRNA阳性率比较〔n(%)〕
注:THBS2=血小板反应素蛋白2;与正常胃黏膜组织比较,aP<0.017;与胃黏膜炎性病变组织比较,bP<0.017
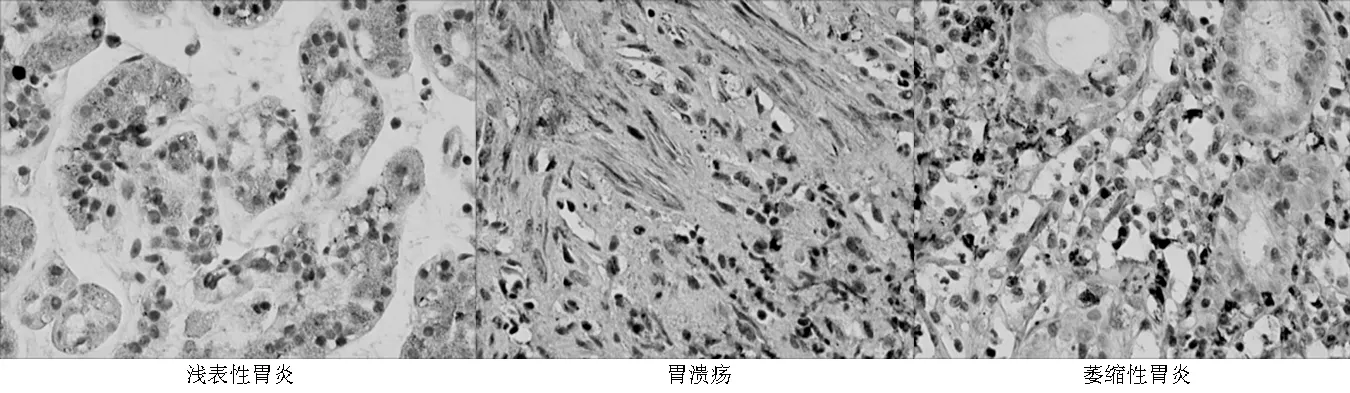
图1 不同胃黏膜炎性病变组织THBS2表达(苏木素-伊红染色,×20)

图2 正常胃黏膜组织、癌旁组织及胃癌组织THBS2表达(苏木素-伊红染色,×10)
2.3不同临床特征患者胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率比较不同性别、年龄、民族、病变性质患者的胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率比较,差异无统计学意义(P>0.05,见表2)。
2.4正常胃黏膜组织、癌旁组织及胃癌组织THBS2、THBS2 mRNA阳性率比较正常胃黏膜组织、癌旁组织及胃癌组织THBS2、THBS2 mRNA阳性率比较,差异无统计学意义(P>0.05,见表3)。

表3 正常胃黏膜组织、癌旁组织及胃癌组织THBS2、THBS2 mRNA阳性率比较〔n(%)〕

表2 不同临床特征患者胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率比较
注:均采用Fisher确切概率法
2.5不同临床特征患者胃癌组织THBS2、THBS2 mRNA阳性率比较不同性别、年龄、民族、肿瘤大小、有无淋巴结结转移患者胃癌组织THBS2、THBS2 mRNA阳性率比较,差异无统计学意义(P>0.05);不同分化程度、浸润深度胃癌组织THBS2、THBS2 mRNA阳性率比较,差异有统计学意义(P<0.05,见表4)。

表4 不同临床特征患者胃癌组织THBS2、THBS2 mRNA阳性率比较
注:均采用Fisher确切概率法
3 讨论
本研究结果显示,THBS2、THBS2 mRNA的表达与患者的年龄、性别、民族无关。胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率较正常胃黏膜组织、胃癌组织升高,但与胃黏膜炎性病变性质无关;在胃癌组织中,高分化者THBS2、THBS2 mRNA阳性率高,浸润深度达到黏膜及肌层者THBS2、THBS2 mRNA阳性率高,THBS2、THBS2 mRNA阳性率与淋巴结转移无明显相关。
青海地区高寒缺氧,胃肠道是对缺氧环境较敏感的器官之一,由于长期低氧环境,引起胃黏膜出血、坏死、炎性细胞浸润等病理性变化,从而使胃黏膜自我保护屏障受损,是诱发胃黏膜病变主要病理生理基础,同时也是高原地区慢性胃炎,尤其是慢性萎缩性胃炎高发原因之一[4]。长期损伤可以引起胃黏膜增生及诱导炎症发生,使局部微环境发生变化,为肿瘤的发生创造了条件。所以,大多数学者认为肿瘤是长期慢性炎症的结果。世界卫生组织把胃溃疡、胃黏膜肠上皮化生、胃黏膜异常增生等胃黏膜病变列为癌前病变。
THBS2属于THBS家族成员之一,由成纤维细胞、平滑肌细胞等分泌的分子量为20 kD的细胞外基质糖蛋白,位于6q27染色体上[5]。由3条多肽链组成同源三聚体,具有与凝血酶、纤维蛋白原、纤维连接蛋白、肝素等物质结合的多个位点,与多种细胞受体、生长因子、细胞间基质蛋白结合,调节细胞的黏附、移动、创口的愈合、胚胎的发育[6]。同时在肿瘤发生、发展中起着重要作用。有文献报道,敲除THBS2基因的实验小鼠皮肤张力降低,骨密度增加,皮肤及其他组织的小血管密度增加,提示THBS2与细胞的黏附与迁移有关[7]。有文献显示,在结肠癌组织中THBS2的表达明显高于正常组织[8]。STREIT等[9]研究提示,高表达的THBS2可以抑制肿瘤血管的密度和数量的增加并促进肿瘤细胞的凋亡。HAWIGHORST等[10]将皮肤化学致癌物质作用于野生型和THBS2缺失型小鼠,发现在恶性肿瘤发生过程中野生型小鼠间质THBS2表达明显上调,THBS2缺失型小鼠的肿瘤生长速度显著加快,提示THBS2在肿瘤发生过程中表现出来的表达上调是宿主的一种自身抗肿瘤防卫机制。本研究采用组织芯片技术和免疫组织化学方法检测胃黏膜组织THBS2表达情况,采用RT-qPCR法检测THBS2 mRNA表达情况,结果发现,胃黏膜炎性病变组织THBS2、THBS2 mRNA阳性率较正常胃黏膜组织、胃癌组织升高,THBS2、THBS2 mRNA表达与胃癌的分化程度及浸润深度有关,不论从蛋白水平还是基因水平,均得到了证实,与既往文献报道一致[11]。THBS2抑制内皮细胞增生、分裂,从而抑制肿瘤血管的形成,在低分化胃癌组织中THBS2表达低,失去了抑制内皮细胞分裂、增生的能力,形成肿瘤血管,供给肿瘤细胞营养[12]。尽管在肿瘤发生过程中肿瘤细胞分泌血管内皮生长因子(VEGF)等细胞因子,VEGF可以阻断THBS2对介导caspase活化但不能阻断THBS2对血管内皮细胞DNA合成的抑制,VEGF能阻断THBS2介导内皮细胞的凋亡,但不能阻断THBS2对内皮细胞分裂周期的抑制,所以,即使在VEGF、表皮细胞生长因子(EGF)等因子存在的环境中,THBS2依然是一种有效的非caspase依赖型的血管内皮细胞抑制剂,随着肿瘤分化程度的降低,THBS2分泌减少,表达降低,肿瘤间质大量的血管形成,为胃癌细胞的生长和转移创造了条件[13-14]。胃黏膜在缺氧环境下受到损伤,引起胃黏膜病理性改变,导致THBS2的分泌增加,改变胃黏膜的微环境,可以刺激其他细胞因子释放并参与炎性反应。有文献报道,在角膜损伤的6 h内,THBS2分泌增加,24 h降低至最低,96 h出现第2次增加,192 h降到参考值水平,THBS2在损伤的作用下细胞结合部位肌动蛋白表达增强,黏合斑中a肌动蛋白丢失,细胞进入去黏合状态,这种状态为其他一些特殊因子参与炎性损伤与修复提供了微环境[15]。
综上所述,在高原地区患者THBS2可能参与了胃黏膜炎性病变发生和发展,在炎症发生时改变了胃黏膜局部的微环境,THBS2也可通过抑制肿瘤血管的形成,影响肿瘤的分化与浸润。因此,进一步研究THBS2对高原地区患者胃黏膜的损伤作用,对预防高原地区胃癌的发生有着重要的意义。
作者贡献:李菊英进行课题设计;贺春兰进行资料收集整理、撰写论文、成文并对文章负责;张梦兰、杨勇、苟笑丹进行课题实施、评估、资料收集;贺菊香进行质量控制及审校。
本文无利益冲突。
[1]陆灏珠,钟南山,陆再英,等.内科学[M].8版.北京:人民卫生出版社,2013:375-378.
[2]CZEKIERDOWSKI A,CZEKIERDOWSKA S,DANILOS J,et al.Microvessel density and CpG island methylation of the THBS2 gene in malignant ovarian tumors[J].J Physiol Pharmacol,2008,59(Suppl 4):53-65.
[3]KIM H,WATKINSON J,VARADAN V,et al.Multi-cancer computational analysis reveals invasion-associated variant of desmoplastic reaction involving INHBA,THBS2 and COL11A1[J].BMC Med Genomics,2010,3(3):51.
[4]杨桂英,熊元治.青海地区慢性萎缩性胃炎流行病学特点研究[J].中国消化内镜,2009,3(2):22-28.
[5]KYRIAKIDES T R,ZHU Y H,SMITH L T,et al.Mice that lack thrombospondin 2 display connective tissue abnormalities that are associated with disorderedcollagen fibrillogenesis,an increased vascular density,and a bleeding diathesis[J].J Cell Biol,1998,140(2):419-430.
[6]KAZEROUNIAN S,YEE K O,LAWLER J.Thrombospondins in cancer[J].Cell Mol Life Sic,2008,65(5):700-712.
[7]赵文毅,燕敏,刘炳亚,等.凝血酶敏感蛋白2在肿瘤中的研究进展[J].国外医学(肿瘤学分册),2005,32(12):886-889.
ZHAO W Y,YAN M,LIU B Y,et al.The role of thrombospondin 2 in tumor[J].Foreign Medical Sciences(Oncology Section),2005,32(12):886-889.
[8]TOKUNAGA T,NAKAMNRA M,OSHIKA Y,et al.Thrombospondin 2 expression is correlated with inhibition of angiogenesis and metastasis of colon cancer[J].Br J Cancer,1999,79(2):354-359.
[9]STREIT M,STEPHEN A E,HAWIGHORST T,et al.Systemic inhibition of tumor growth and angiogenesis by thrombospondin-2 using cell-based antiangiogenic gene therapy[J].Cancer Res,2002,62(7):2004-2012.
[10]HAWIGHORST T,VELASCO P,STREIT M,et al.Thrombospondin-2 plays a protective role in multistep carcinogenesis:a novel host anti-tumor defense mechanism[J].EMBO J,2001,20(11):2631-2640.
[11]力超,林东贤,蔡晓雯,等.凝血酶敏感素-2在胃癌中的表达及其临床意义[J].中国肿瘤临床,2013,40(20):1227-1231.
LI C,LIN D X,CAI X W,et al.Clinical significance of thrombospondin-2 expression in gastric car-cinoma[J].Chinese Journal of Clinical Oncology,2013,40(20):1227-1231.
[12]SUN R,WU J,CHEN Y,et al.Down regulation of Thrombospondin2 predicts poor prognosis in patients with gastric cancer[J].Mol Cancer,2014,28(13):225.
[13]JUBB A M,HURWITZ H I,BAI W,et al.Impact of vascular endothelial growth factor-A expression,thrombospondin-2 expression,and microvessel density on the treatment effect of bevacizumab in metastatic colorectal cancer[J].J Clin Oncol,2006,24(2):217-227.
[14]ARMSTRONG L C,BJÖRKBLOM B,HANKENSON K D,et al.Thrombospondin 2 inhibits microvascular endothelial cell proliferation by a caspase-independent mechanism[J].Mol Biol Cell,2002,13(6):1893-1905.
[15]严军,王正国,朱佩芳,等.凝血酶敏感蛋白2在小鼠角膜碱烧伤后修复过程中的表达[J].中华烧伤杂志,2005,21(6):452-454.
YAN J,WANG Z G,ZHU P F,et al.Expression of thrombospondin 2 during the repair process after alkali burn injury of cornea in mice[J].Chinese Journal of Burns,2005,21(6):452-454.
(本文编辑:陈素芳)
Differences in the Expression of THBS2 in Gastric Mucosal Inflammatory Lesions and Gastric Cancer Tissues of Patients on Plateaus
HEChun-lan,ZHANGMeng-lan,YANGYong,GOUXiao-dan,HEJu-xiang,LIJu-ying.QinghaiUniversityAffiliatedHospital,Xining810001,China
Correspondingauthor:LIJu-ying,DepartmentofPathology,MedicalCollegeofQinghaiUniversity,Xining810001,China;E-mail:lijuying@126.com
BackgroundTHBS2 is highly expressed in fibroblasts but is insufficiently expressed in endothelial cells.THBS2 is also highly expressed in normal tissues,but its expression in gastric cancer and osteogenic sarcoma is decreased.Thus,THBS2 expression is negatively correlated with tumor formation.A high incidence of gastric cancer is recorded in Qinghai Province on Qinghai-Tibet Plateau.However,the expression conditions of THBS2 in gastric cancer patients on plateaus have yet to be reported.ObjectiveTo investigate the expression conditions of THBS2 in gastric mucosa inflammatory lesions and gastric cancer tissues of patients on plateaus and to explore the relationship and significance between THBS2 and different gastric mucosa lesions of patients on plateaus.MethodsSpecimens were collected from 30 cases with gastric mucosal inflammatory lesions inspected by the Endoscopy Center of Qinghai University Affiliated Hospital.Surgical specimens were also obtained from 30 gastric cancer patients admitted to Qinghai Provincial People′s Hospital from December 2012 to February 2015.The specimens were taken from gastric cancer tissues,para-carcinoma tissues located 5 cm away from gastric cancer tissues,and normal gastric mucosal tissues.The expression of THBS2 in gastric mucosal tissues was detected through tissue microarray and immunohistochemical analysis.The mRNA expression of THBS2 was determined through RT-qPCR.Differences in positive rates between THBS2 and its mRNA in gastric mucosal inflammatory lesions and gastric cancer tissues with various clinical features were then compared.ResultsImmunohistochemical analysis revealed that THBS2 is mainly expressed in the cytoplasm and the cell membrane,as indicated by yellow and claybank stains.The positive rates of THBS2 and its mRNA in gastric mucosal inflammatory lesions were significantly higher than those in normal gastric mucosa and gastric cancer tissues(P<0.017).The positive rates of THBS2 and its mRNA in gastric mucosal inflammatory lesions in different genders,ages,nationalities,and lesion types did not significantly differ(P>0.05).The positive rates of THBS2 and its mRNA in normal gastric mucosa,para-carcinoma tissues,and gastric cancer tissues did not also significantly differ(P>0.05).Likewise,the positive rates of THBS2 and its mRNA in gastric cancer tissues of patients with different genders,ages,nationalities,tumor sizes,and metastatic or non-metastatic lymph nodes did not significantly vary(P>0.05).By comparison,the positive rates of THBS2 and its mRNA in gastric cancer tissues with various degrees and depths of invasion significantly differed(P<0.05).ConclusionTHBS2 may be involved in the occurrence and development of gastric mucosal inflammatory lesions among patients on plateaus.THBS2 expression is highly associated with the differentiation degrees and invasion depths of gastric cancer.Therefore,THBS2 can be considered an indicator of the development of gastric mucosal inflammatory lesions and prognosis of gastric cancer or observation of curative effects.
Stomach neoplasms;Gastritis;Gastric mucosa;THBS2;Altitude
青海省科技厅计划与研究课题资助项目(2012-Z-720)
810001青海省西宁市,青海大学附属医院(贺春兰,杨勇,苟笑丹);青海省人民医院(张梦兰);青海大学医学院病理教研室(贺菊香,李菊英)
李菊英,810001青海省西宁市,青海大学医学院病理教研室;E-mail:lijuying@126.com
R 735.2
A
10.3969/j.issn.1007-9572.2016.26.012
2016-02-26;
2016-07-15)

