TNBS模型大鼠结肠组织中NF-κB、PPAR-γ的表达特点*
顾培青 沈 洪朱 磊 刘亚军 张 露 刘军楼 徐 艺 成家飞(江苏省中医院,江苏 南京 210029)
·研究报告·
TNBS模型大鼠结肠组织中NF-κB、PPAR-γ的表达特点*
顾培青 沈 洪△朱 磊 刘亚军 张 露 刘军楼 徐 艺 成家飞
(江苏省中医院,江苏 南京 210029)
目的 观察三硝基苯磺酸 (TNBS)造模后第3日、7日、10日、14日大鼠结肠组织中核转录因子-κB (NF-κB)、过氧化物酶体增殖物激活受体-γ(PPAR-γ)表达的变化特点。方法 造模组采用TNBS/乙醇溶液灌肠法制作UC大鼠模型,将大鼠分为空白组、造模后3 d组、造模后7 d组、造模后10 d组、造模后14 d组。后4组分别于造模后第3日、7日、10日、14日处死,采用免疫组化法及实时荧光定量PCR法测定各组大鼠结肠组织中NF-κB、PPAR-γ及mRNA表达。结果 造模后3 d大鼠结肠NF-κB表达显著上调,10 d、14 d后表达较前逐渐回落;造模后3 d大鼠结肠PPAR-γ表达明显下调,至14 d时其表达逐渐恢复。结论 TNBS大鼠结肠炎是炎症性肠病的良好模型,造模后结肠NF-κB表达上调,PPAR-γ表达受抑制,在造模后14 d后模型自愈较为明显,治疗的疗程选择7~10 d为宜。
三硝基苯磺酸 炎症性肠病 核转录因子-κB 过氧化物酶体增殖物激活受体-γ
【Abstract】Objective:To observe the expression characteristics of NF-κB and PPAR-γ in colon tissue of TNBS rats after successful modeling on 3rdday,7thday,10thday and 14thday.Methods:The models were made with TNBS/ethanol solution enema method.The rats were divided into the blank group,3 d group,7 d group,10 d group and 14 d group.The latter four groups were killed according to time.The expression of NF-κB,PPAR-γ and mRNA was detected by immunohistochemistry and real-time fluorescence quantitative PCR method.Results:3 days after modeling,NF-κB expression of rat colon was significantly up-regulated,but after 10 days and 14 days,the expression gradually declined.3 days after modeling,PPAR-γ expression of rat colon significantly reduced.Till 14thday,the expression gradually restored.Conclusion:TNBS colitis in rats is a good model of IBD.After modeling,NF-κB of colon up-regulated and PPAR-γ expression was inhibited.14 d after modeling,selfhealing of model is more obvious,and the course of treatment lasting 7 to 10 days is appropriate.
【Key words】TNBS;Inflammatory bowel disease;NF-κB;PPAR-γ
炎症性肠病(IBD)主要包括溃疡性结肠炎(UC)和克隆氏病(CD),是一组与遗传、环境、免疫等因素相关的慢性肠道炎症性疾病。目前的动物模型研究多种多样,造模方法主要有药物学方法、免疫学方法、特定基因敲除、基因缺陷、T细胞移植等等,其中免疫模型是IBD目前研究最活跃的领域。三硝基苯磺酸(TNBS)作为一种半抗原,用它诱导的大鼠实验性结肠炎模型是研究IBD的经典模型。核转录因子-κB(NF-κB)作为炎症反应的枢纽,在IBD的发病机制中被广泛研究。近年来发现,结肠黏膜表面免疫细胞能够表达过氧化物酶体增殖物激活受体-γ(PPAR-γ),并通过调节核转录因子激活蛋白1、NF-κB等炎症相关转录因子的表达来调节炎症反应[1]。其活化后参与体内炎症反应、免疫反应和表皮细胞的分化,尤其与IBD的发病机制和严重程度密切相关[2]。本实验观察TNBS造模后第3、7、10、14 d大鼠结肠组织中NF-κB、PPAR-γ表达的变化特点,既是对TNBS结肠炎模型的验证,也为进一步研究提供数据参考。现报告如下。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠,鼠龄3~4个月,体质量(200±20)g,购自上海西普尔-必凯实验动物有限公司,动物合格证编号2008001652254。
1.2 试剂与仪器 5%TNBS水溶液:Sigma公司,批号PP2297;DAB显色试剂盒(20X)(福州迈新生物技术开发有限公司,批号1409030031);KIT-9921即用型免疫组化试剂盒(鼠/兔)(福州迈新生物技术开发有限公司,批号 1411249921);Trizol(Takara公司,批号9109);Sybr green(Toyobo公司,批号43300)ELISA试剂盒 (中国Elabscience公司),Multiskan MK3酶标仪(美国Thermo公司),光学显微镜 (日本Olympus公司),Stepone plus荧光定量PCR (美国ABI公司),ABI-Veriti型普通PCR仪(美国ABI公司)。
1.3 模型复制 按完全随机设计法将大鼠分为空白组、造模后3 d组、造模后7 d组、造模后10 d组、造模后14 d组。造模组采用TNBS/乙醇溶液灌肠法制作UC大鼠模型[3]。大鼠10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉;用直径2.0 mm长12 cm的输液管经液体石蜡润滑后,由大鼠肛门轻缓插入深约8.0 cm处一次性推入TNBS造模溶液 (100 mg/kg TNBS+50%乙醇0.25 mL),捏紧肛门提尾倒立1 min后放回笼中自然苏醒,常规饲养。空白组大鼠予上述方法等量生理盐水灌肠。
1.4 标本采集与检测 1)标本采集。分别于造模后3、7、10、14 d脱颈椎法处死大鼠,立即开腹迅速剖取结肠,自肛门2 cm处向上取结肠6~8 cm,沿肠系膜纵轴剪开肠腔,冷0.9%氯化钠注射液冲洗干净,立即进行大体形态评分。取病变最严重处结肠,一部分置4%甲醛中固定,石蜡包埋、切片(4 μm)、HE染色,光镜下观察组织病理学变化。另一部分立即置于液氮中,后转入-80℃冰箱中保存。2)大鼠结肠病理组织学评分。评分标准:(1)肠壁炎症的严重程度,记为1分、2分、3分,分别代表轻度、中度、重度炎症;(2)病变严重程度(累及部位),记为1分、2分、3分,即病变位于黏膜层,黏膜和黏膜下层,或透壁性损伤;(3)隐窝损害程度,记为1分、2分、3分、4分。即1/3隐窝损害,2/3隐窝损害,隐窝缺失、表面上皮完整,隐窝和表面上皮都缺失。上述3项指标的打分再分别乘以病变区域所占比例(参与比例)为最后得分。无明显病变记为0分,累加所有分数,得出总分。3)免疫组化法检测肠组织NF-κB、PPAR-γ表达。切取大鼠组织,固定、常规二甲苯脱脂,梯度酒精脱水、透明、包埋、切片。石蜡切片常规脱蜡、水化,用3%H2O2处理阻断内源性过氧化酶并孵育10 min,PBS冲洗3×5 min;微波抗原修复,正常血清工作液于37℃封闭10 min,再用一抗(稀释100倍)4℃冰箱孵育过夜,PBS冲洗3×5 min;滴加生物素标记二抗,37℃孵育30 min,PBS冲洗3×5 min;DAB显色,自来水充分冲洗后、苏木素复染、常规脱水、二甲苯透明、干燥,树脂封片。生物显微图像分析系统(复日,FR-988 Smart Scape2000)摄像、标记、分析。4)实时荧光定量PCR法检测肠组织NF-κB、PPAR-γ mRNA表达。(1)抽提总RNA:按RNAiso Reagent操作说明书提取TNBS模型大鼠结肠黏膜组织总RNA,紫外分析及电泳检测总RNA的纯度、浓度及完整性。(2)单链cDNA的合成:采用Prime Script TM RTreagent Kit试剂盒,严格按说明书操作。各目的基因的引物序列、产物大小如下。GAPDH:F-GGTGTGAACCACGAGAAAT ATGAC,R-TCATGAGCCCTTCCACAATG,扩增片段长度127 bp。PPAR-γ:F-GACCTGAAGCTCCAAGAATACC,R-TTCATGTGGCCTGTTGTAGAG,扩增片段长度99 bp。NF-κB P65:F-GCTCAAGATCTGCCGAGTAAA,R-GT CCCGTGAAATACACCTCAA,扩增片段长度113 bp。(3)RT-PCR:采用SYBR Premix ExTaqTM试剂盒,在ABI7300上设置检测文件,反应条件如下:预变性:95℃,10 min(1个循环),PCR反应:95℃,5 s;60℃,1 min(40个循环)。使用Sequence Detection software version1.2.3软件分析PCR过程中样本的Ct(循环阈值),Ct值随模板浓度增大而减少。
1.5 统计学处理 应用SPSS17.0统计软件分析。计量资料以(±s)表示,方差分析,最小显著差法(LSD)进行两两比较,双侧检验以P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠结肠病理组织学评分比较 见表1。图1。经单因素方差分析两两比较,与空白组相比,造模后3 d大鼠结肠病理评分显著升高 (P<0.05);3、7、10 d之间病理评分差异无统计学意义(P>0.05);14 d病理评分较3 d有明显下降(P<0.05),与空白组相比差异有统计学意义(P<0.05)。
表1 各组大鼠结肠病理组织学评分比较(分,±s)
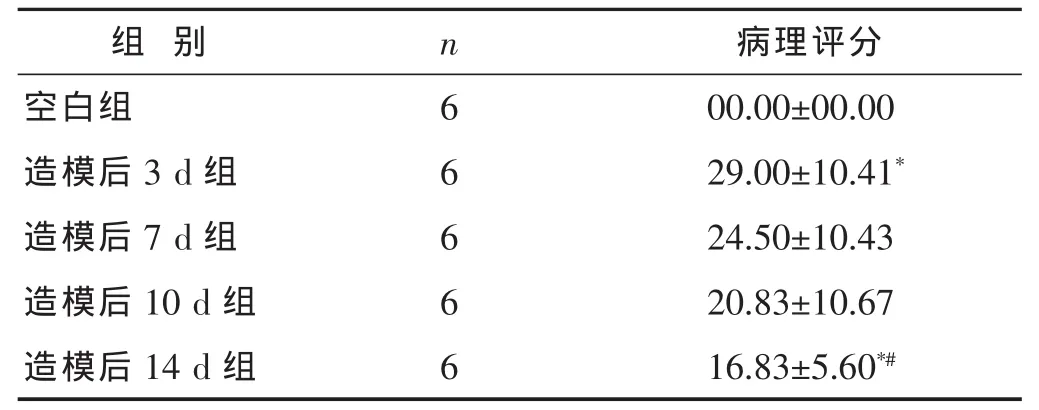
表1 各组大鼠结肠病理组织学评分比较(分,±s)
与空白组比较,*P<0.05;与造模后3 d组比较,#P<0.05。下同。
?
2.2 各组大鼠肠组织NF-κB表达的比较 见表2。图2。经单因素方差分析两两比较,与空白组相比,造模后3 d大鼠结肠NF-κB免疫组化IOD值明显增高 (P<0.05);造模后10、14 d较3 d大鼠结肠NF-κB免疫组化IOD值有明显降低(P<0.05)。
2.3 各组肠组织PPAR-γ表达的比较 见表3,图3。经单因素方差分析两两比较,造模后3 d大鼠结肠PPAR-γ免疫组化IOD值明显下降(P<0.05);造模后14 d较 3、7、10 d大鼠结肠 PPAR-γ免疫组化IOD值均有明显增加(P<0.05);造模后3、7、10 d之间PPAR-γ免疫组化IOD值差异无统计学意义(P>0.05)。14 d与空白对照组之间差异无统计学意义(P>0.05)。
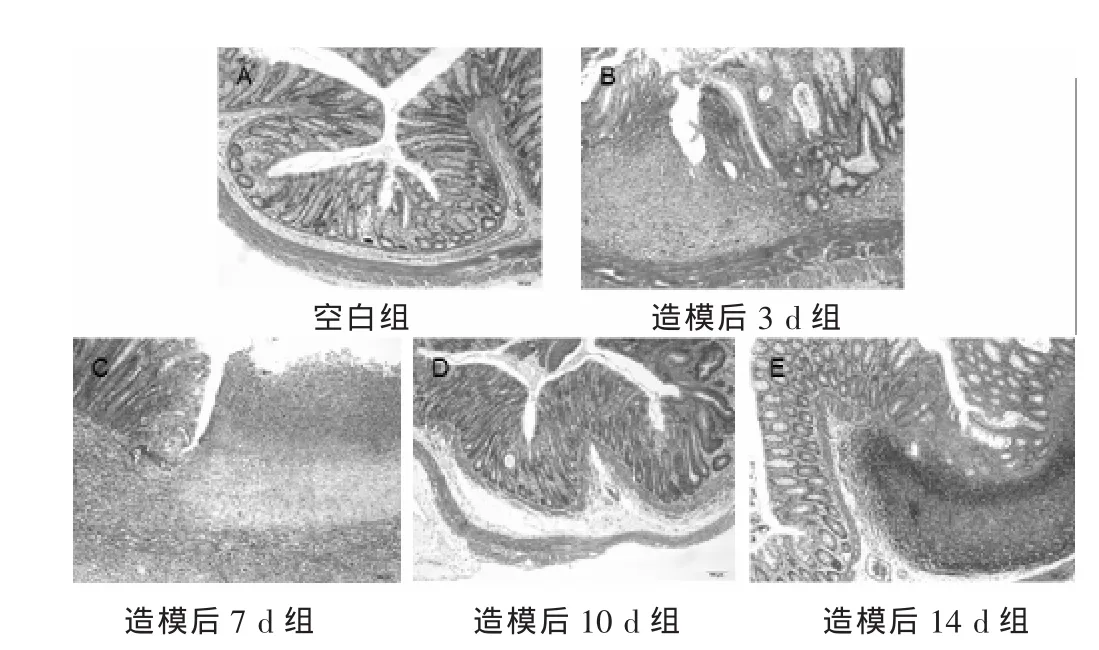
图1 大鼠结肠病理图片(HE染色,100倍)
表2 各组大鼠结肠组织NF-κB免疫组化IOD值比较(±s)

表2 各组大鼠结肠组织NF-κB免疫组化IOD值比较(±s)
?
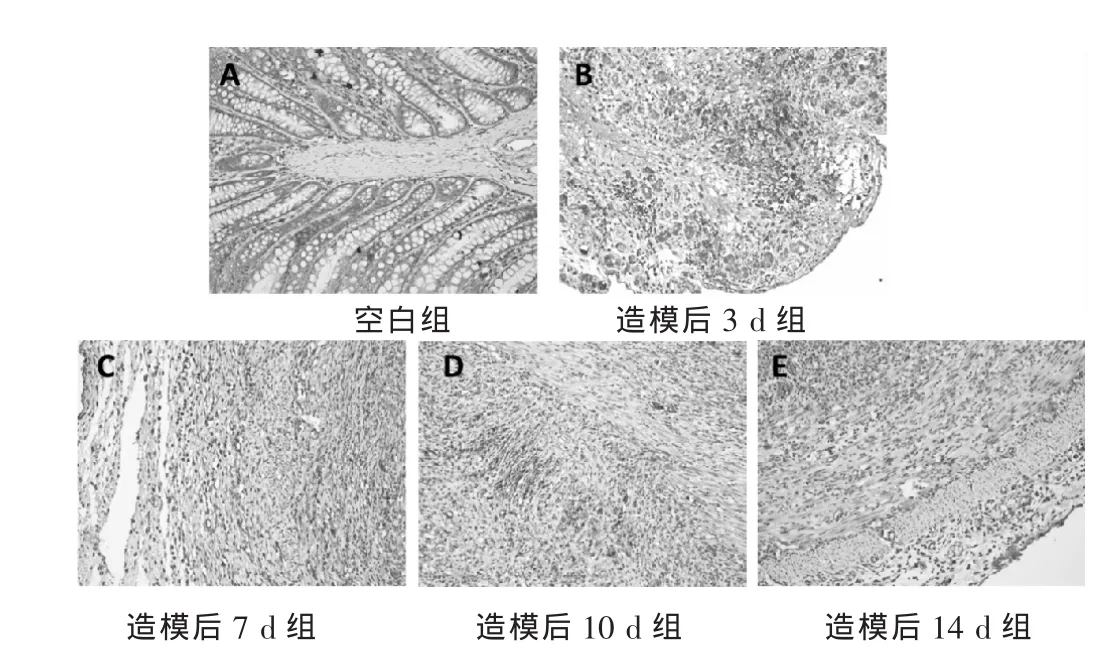
图2 大鼠结肠组织NF-κB免疫组化表达情况(200倍)
表3 大鼠结肠组织PPAR-γ免疫组化IOD值(±s)
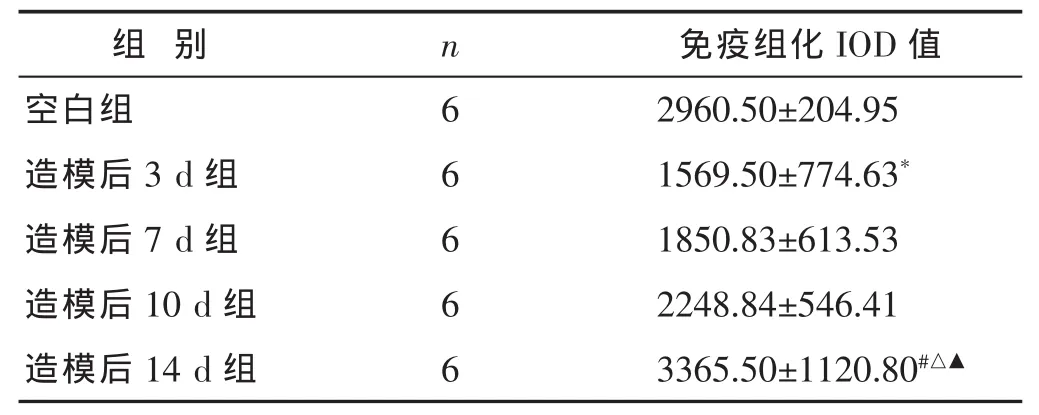
表3 大鼠结肠组织PPAR-γ免疫组化IOD值(±s)
与造模后7 d组比较,△P<0.05;与造模后10 d组比较,▲P<0.05。
?

图3 大鼠结肠组织PPAR-γ免疫组化表达情况(200倍)
2.4 各组大鼠肠组织NF-κB mRNA表达的比较 见表4。经单因素方差分析两两比较,造模后3 d NF-κB mRNA 2-ΔΔCt值明显升高(P<0.05);7 d、14 d组NF-κB mRNA 2-ΔΔCt值较3 d组有降低(P<0.05)。
2.5 各组大鼠肠组织PPAR-γ mRNA表达的比较见表4。经单因素方差分析两两比较,各组间PPAR-γ mRNA 2-ΔΔCt值差异无统计学意义(P>0.05)。
表4 各组大鼠肠组织NF-κB mRNA、PPAR-γ mRNA表达的比较(±s)
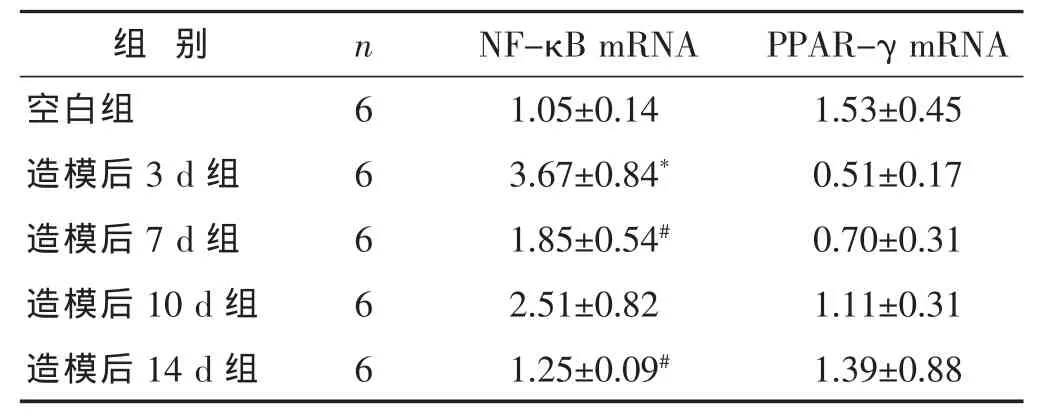
表4 各组大鼠肠组织NF-κB mRNA、PPAR-γ mRNA表达的比较(±s)
?
3 讨 论
Morris在1984年首次成功地制造出三硝基苯磺酸(TNBS)动物模型,该模型建立之初用于反映CD的病理变化及药物疗效的研究[3]。随后,人们将其用于UC的病理研究和药效评价[4]。该模型主要采用灌肠给予以乙醇为溶剂的TBNBS溶液,刺激结肠炎的产生。其机制被认为首先是乙醇破坏鼠的肠黏膜屏障,TNBS作为半抗原与体内蛋白结合成为抗原,产生一系列免疫反应,从而诱发结肠炎症。通过对不同剂量的TNBS引起的大鼠UC模型观察[5],发现一次性注入直肠100 mg/kg剂量下引起的结肠组织呈慢性炎症变化,病程较长,各种炎症介质发生明显变化,肠黏膜发生溃疡、水肿、糜烂、大量的炎性细胞浸润等组织病理学改变,与UC患者出现的临床表现和病理变化十分相似。所以学界认为100 mg/kg是本模型的最佳剂量,与国外报道相似[6-8]。TNBS(100 mg/kg)造模后,结肠炎持续约7~8周时间,急性期主要限于结肠黏膜及黏膜下层大量炎性细胞浸润,以中性粒细胞为主;慢性期主要为淋巴细胞和浆细胞浸润,病理改变以血管增生和组织变形为突出表现;急、慢性期的大致分界点为3周左右[9-10]。IBD实验一般用其急性期,以模仿IBD活动期的特征。本实验观察至大鼠造模后14 d为止,观察其急性期内结肠组织NF-κB及PPAR-γ表达变化特征,结果显示:造模后3 d病变累及肠壁各层,局部有多量坏死的中性粒细胞积聚,见黏膜层隐窝坏死,轮廓存留,1只隐窝轻度损伤,2只见黏膜层坏死,未见明显炎细胞浸润,损伤局部组织无明显肉芽组织增生。造模后7 d多数黏膜层全部坏死,损伤局部组织有明显肉芽组织增生。黏膜层隐窝坏死,2只隐窝中度损伤。造模后10 d组病变炎症程度与7 d组基本相似。造模后14 d组肠壁有重度炎症反应,损伤局部组织有明显肉芽组织增生,病变累及黏膜下层、肌层,见黏膜层隐窝坏死。经单因素方差分析两两比较显示,造模后3 d、7 d、10 d之间病理评分差异无统计学意义;造模后14 d组病理评分较3 d组有明显改善P=0.030,提示造模后14 d时大鼠结肠炎症已趋于缓解。
NF-κB是一类能与多种基因启动子或增强子部位B位点发生特异性结合并促进其转录的蛋白质。NF-κB可以调控任何含有B位点的基因转录,包括细胞因子及其受体 (IL-1β、IL-6、IL-8、TNF-α、IL-2R)、粘附分子(ICAM-1、VCAM-1)、促进或抑制凋亡蛋白(Bcl-xL、Fsa、FasL)、急性期反应蛋白(CRP)、趋化因子(RANTFS、MCP、MTP)、补体、生长因子、酶分子、转录因子等。研究表明[11],NF-κB在UC中呈现过度激活状态,并导致细胞因子及黏附分子等过度和持续表达,放大炎症反应。NF-κB在许多炎症反应中发挥枢纽作用,尤其是NF-κB p65亚群,它在调控靶基因的转录中起着关键性的作用。Rogler等[12]采用特异性的p65单克隆抗体,原位证实了UC患者肠黏膜巨噬细胞和上皮细胞NF-κB p65表达比正常对照明显增强,且其表达与炎症的严重程度呈正相关。
本实验免疫组化结果显示,造模后3 d大鼠结肠NF-κB表达显著上调,10 d、14 d后表达较前逐渐回落;实时荧光定量PCR结果与免疫组化结果类似。
PPAR是一类配体激活的核转录因子超家族成员,有α、β、γ三个亚类。PPAR-γ主要在棕色和白色脂肪组织、大肠、视网膜以及部分免疫系统表达,参与调控脂质代谢、胰岛素敏感性、细胞增殖以及炎症等多项生物功能[13]。研究表明,PPAR-γ是固有免疫和获得性免疫的关键因子,UC活动期表达低于正常并且与UC严重程度成负相关[14]。5-ASA是治疗UC的经典药物之一,实验证实它可能通过激活PPAR-γ起治疗作用[15]。现在学界认为PPAR-γ的配体通过抑制NF-κB的活化,减少促炎症细胞因子的转录及表达,从而下调过度的免疫反应。
本实验免疫组化结果显示,造模后3 d大鼠结肠PPAR-γ表达明显受到抑制,至14 d时其表达逐渐恢复。实时荧光定量PCR检测PPAR-γ mRNA结果各组间差异无统计学意义,可能与数据标准差较大、抽样误差较大有关,扩大样本量后应会表现出类似免疫组化的结果。
以上可知,观察治疗措施对TNBS模型的干预效果,其疗程选择在7~10 d为宜,疗程过长,如超过14 d,则无法排除模型本身自愈的可能。
[1] XIA J,YUAN J,XIN L,et al.Transcriptome analysis on the inflammatory cell infiltration of nonalcoholic steatohepatitis in bama minipigs induced by a long-term high-fat,high-sucrose diet[J].PLoS One,2014,9(11):1-22.
[2] Arab HH,AL-Shorbagy MY,Abdallah DM,et al.Telmisartan attenuates colon inflammation,oxidative perturbations and apoptosis in a rat model of experimental inflammatory bowel disease[J].PLoS One,2014,9(5):1-16.
[3] Morris GP,Beck PL,Herridge MS,et al.Hapten-induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology,1989,96(3):795-803.
[4] 盛艳梅,颜晓燕.溃疡性结肠炎动物模型在药效研究中的应用[J].生理科学杂志,2006,28(2):65-66.
[5] 郑礼,高振强,王淑仙.大鼠溃疡性结肠炎模型的实验研究[J].中国药理学通报,1998,14(4):370-372.
[6] Stenson WF.Enhanced synthesis of leukotrieneB4 by colonic mucosa ininflammatory bowel disease[J].Gastroenterology,1984,86(3):453-460.
[7] Krimskym,Yedgars,Aptekarl,et al.Anelioration of TNBs-induced colon inflammation on rats by phospholi-pase A2 chhibitor[J].Am J Physiol Gas-trochtest Liver Physiol,2003,285(9):586-592.
[8] Dargeniog,Farracemg,Cosenzav,et al.Expression of apoptosis-related protein sin rat with induced colitis[J].Int J Colorectal Dis,2004,19(7):451-460.
[9] 朱峰,钱家鸣.实验性炎症性肠病的动物模型[J].胃肠病学,1996,1(2):107-1101.
[10]王皓,欧阳钦,胡仁伟.三硝基苯磺酸结肠炎动物模型的建立[J].胃肠病学,2001,6(1):7-10.
[11]Mitsuyama K,Suzuki A,Tomiyasu N,et al.Transciption factor-targeted therapies in inflammatory bowel disease[J].Disgestion,2001,63(12):68-72.
[12]Rogler G,Brand K,Vogl D,et al.Nuclear factor-κB is activated in macrophages and epithelial cells of inflamed intestinal mucosa[J].Gastroenterology,1999,115(11):357-369.
[13]Adachi M,Kurotani R,Morimura K,et al.Peroxisome proliferator activatedreceptor gamma in colonic epithelial cells protects against experimental inflammatory bowel disease[J].Gut,2006,55(10):1104-1113.
[14]Danyes RA.Emegring roles of PPARs in inflammation and immunity[J].Immunol,2002,72(2):748-759.
[15]Adachi M,Kurotani R,Morimura K,et al.Peroxisome proliferator activated receptor gamma in colonic epithelial cells protects against experimental inflammatory bowel disease[J].Gut,2006,55(8):1104-1113.
The Expression Characteristics of NF-κB and PPAR-γ in Colon Tissue of TNBS Rats
GU Peiqing,SHEN Hong,ZHU Lei,et al.Jiangsu Hospital of TCM,Jiangsu,Nanjing 210029,China.
·研究报告·
R285.5 文献标志码:A
1004-745X(2016)08-1461-05
10.3969/j.issn.1004-745X.2016.08.002
国家自然科学基金委员会青年科学基金项目(81302919);江苏省中医药局科技项目立项计划(LZ13048);江苏省中医院高峰学术人才培养工程(k2014yrc13);江苏省中医院院级课题(Y14076)
(电子邮箱:shenhong999@163.com)
2016-04-24)

