经皮芒硝超声导入对急性胰腺炎大鼠模型的实验研究*
金佳佳 陈建华 杨伟刚(浙江省湖州市中医院,浙江 湖州 313000)
·研究报告·
经皮芒硝超声导入对急性胰腺炎大鼠模型的实验研究*
金佳佳 陈建华 杨伟刚
(浙江省湖州市中医院,浙江 湖州 313000)
目的 观察经皮芒硝超声导入对急性胰腺炎大鼠的影响。方法 取清洁级SD大鼠90只,按随机数字表法随机分成3组,空白对照组(A组)、传统芒硝外敷组(B组)、经皮芒硝超声导入组(C组)。B、C组袋中装有30 g芒硝,A组袋中装有同样重量铝片。C组大鼠运用超声不间断超声导入,每12小时更换芒硝1次。将各组大鼠血液进行血清肿瘤坏死因子-α(TNF-α)和血清淀粉酶(AMY)检测,对胰腺组织病理变化进行评分,观察各组大鼠急性胰腺炎模型胰腺损伤程度、不同时相各组大鼠胰腺组织的病理评分的比较以及各组大鼠血清TNF-α及AMY的水平。结果 从病理改变轻重程度,C组>B组>A组;B组和C组大鼠的病理评分均明显低于A组(P<0.05);与B组相比,C组大鼠第2日和第3日的病理学评分均更低(P<0.05);与A组相比,B组的血清TNF-α和AMY水平降低(P<0.05);C组各指标均较B组显著降低(P<0.05)。结论 经皮芒硝超声药物导入法对急性胰腺炎大鼠模型的疗效明显优于单一传统给药疗法。
急性胰腺炎 经皮超声导入 芒硝 实验研究
【Abstract】Objective:To explore the observation of mirabilite by percutaneous ultrasound guided for rat model with acute pancreatitis.Methods:90 clean grade SD rats were selected,which were randomly divided into 3 groups:the control group(group A),the group of traditional external application of mirabilite(group B),the group by Percutaneous ultrasound guided mirabilite(group C).Group B and group C were filled with 30 g of mirabilite,as well as group A with the same weight of aluminum sheet.The rats in group C were treated with mirabilite by percutaneous ultrasound guided,changed once every 12 hours.The blood samples were taken and serum tumor necrosis factor-α(TNF-α),amylase(AMY)in different groups were compared;simultaneously the pathological changes of pancreatic tissue were scored.Then the degree of pancreatic injury,pathological score of model rats′tissues of acute pancreatitis and the level of serum TNF-α,AMY in the three groups were observed and compared.Results:From the comparison of pathological changes of the degree,the order was group C>group B> group A;the pathological scores of group B and group C were significantly lower than that of group A(P<0.05);compared with group B,the pathological scores of group C on the second day and the third day were lower(P<0.05);the levels of serum TNF-α and AMY in group B were lower appreciably than that of group A,and the difference was statistically significant(P<0.05).Each index in group C was significantly lower than that of group B (P<0.05).Conclusion:The curative effect of percutaneous ultrasound drug delivery method of mirabilite on rat models with acute pancreatitis is better than that of the traditional single drug therapy,worthy of further clinical research and exploration henceforward.
【Key words】Acute pancreatitis;Percutaneous ultrasonic introduction;Mirabilite;Experimental study
急性胰腺炎(AP)是多种病因导致胰酶在胰腺内被激活后引起胰腺组织自身消化、水肿、出血甚至坏死的炎性反应,是临床较为严重的一种急腹症[1]。现代许多研究证明,芒硝外敷具有消炎止痛、预防感染、吸收腹腔渗液、促进脓肿吸收、促进与恢复消化道功能等功效[2]。笔者通过动物实验,研究经皮芒硝超声导入对急性胰腺炎大鼠模型的影响。现报告如下。
1 材料与方法
1.1 实验动物 清洁级健康成年雄性SD大鼠90只,体质量180~220 g,购自上海动物实验中心,动物许可证号:X1402263。
1.2 试药与仪器 芒硝 (由湖州市中医院中药房提供)。牛磺胆酸钠(Sigma公司),TNF-α ELISA试剂盒(Takara Bio Company);淀粉酶ELISA试剂盒(QIAGEN);羊抗鼠occludin、ZO-1单克隆抗体(Santa Cruz Biotechnology,Inc.);荧光标记兔抗羊二抗(Cell Signaling Technology,Inc.,工作浓度1∶100);高速离心机(上海精密器材厂);酶标仪(美国SUNRISE公司);超声中频导药仪(沈阳市美辰医疗器械有限公司,型号MCTD-01型)。
1.3 分组与造模 取大鼠90只,按随机数字表法随机分成3组,空白对照组(A组)、传统芒硝外敷组(B组)、经皮芒硝超声导入组 (C组)。胰腺炎造模参照LANGE等方法[3],全部大鼠予以禁食(不禁水)12 h,3%戊巴比妥钠腹腔注射麻醉 (按体质量0.1 mL/100 g),固定,剪毛,消毒,取长约5 cm上腹部正中切口,进腹后顺胃逐步寻到开口于十二指肠起始部的胰胆管,用针头自开口根部逆行注射牛磺胆酸钠(浓度3%,用量2 mL/kg),采用微量泵恒速注入,注射结束时用微血管夹钳闭胰胆管,15 min后取出微血管夹,关腹。
1.4 给药方法 造模后,各组按20 mL/(kg·d)皮下注射平衡液以支持,A、B、C组大鼠均以纱布袋敷于大鼠腹部剃毛处,用束带在大鼠背部捆绑,并在芒硝袋四角用丝线固定于大鼠腹部皮肤上各1针,B、C组袋中装有30 g芒硝,A组袋中装有同样重量铝片,C组大鼠运用超声导药仪不间断超声导入,每12小时更换芒硝1次。
1.5 标本采集 在第1日、2日、3日后分批处死大鼠,采用断颈法处死大鼠并取完整的胰腺组织,以预冷的4℃0.9%氯化钠注射液快速、彻底清洗胰腺组织,沿主胰管轴剖开胰腺,每次每组10只,将切取胰腺标本放入甲醛固定液中,制作病理切片并评分。
1.6 胰腺病理学评分 参考改良版SCHMIDT等[4]标准,根据胰腺炎的特点进行评分。1)水肿:0分为无;1分为轻度胰腺小叶距离增宽;2分为重度胰腺小叶距离增宽;3分为胰腺腺泡距离增宽;4分为胰腺组织细胞距离增宽。2)坏死:0分为胰腺组织无坏死;1分为胰腺组织坏死面积1%~10%;2分为胰腺组织坏死面积11%~20%;3分为胰腺组织坏死面积21%~30%;4分为胰腺组织坏死面积大于30%。3)出血:0分为胰腺组织无出血;1分为胰腺组织有出血。4)炎性细胞浸润:高倍镜视野下计数胰腺血管周围或胰腺小叶内白细胞数量。0分为0分~1个;1分为2~10个;2分为11~20个;3分为21~30个;4分>30个或出现微脓肿。以上4项评分相加即为每张切片的病理评分结果。
1.7 血清TNF-α及血清淀粉酶的检测 经心脏穿刺采血3 mL,采用双抗体夹心ELISA法检测血清TNF-α和淀粉酶水平,按试剂盒说明书进行操作。
1.8 统计学处理 应用SPSS19.0统计软件处理。计量资料以(±s)表示,组间比较采用析因设计方差分析,并判断因素间是否存在交互作用。组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠胰腺组织的病理改变 见图1。A组:肉眼观察,胰腺组织弥漫性水肿,部分胰腺组织呈黑色改变并伴有明显出血;镜下观察,胰腺组织结构模糊,胰腺小叶间有大量炎症细胞浸润。B组:肉眼观察,胰腺组织轻度水肿;镜下观察,胰腺小叶之间有少量炎症细胞,腺泡轻度水肿,伴有少量红细胞。C组:肉眼观察,胰腺组织无出血、水肿改变;镜下观察,胰腺小叶间未见炎症细胞浸润,腺泡未见水肿和出血。

图1 各组大鼠胰腺组织病理切片(HE染色,200倍)
2.2 各组大鼠不同时期胰腺炎组织病理切片评分比较 见表1。A组大鼠各时相病理学评分差异无统计学意义(P>0.05);B组和C组大鼠评分都随时间延长而逐渐降低,各时相间两两比较,差异均有统计学意义(P<0.05),且均明显低于A组(P<0.05);与B组相比,C组大鼠第2日和第3日的病理学评分均更低 (P<0.05)。
表1 各组大鼠不同时相胰腺组织病理切片评分比较(分,±s)

表1 各组大鼠不同时相胰腺组织病理切片评分比较(分,±s)
与A组比较,*P<0.05;与B组比较,△P<0.05。下同。
组别n 第3日第1日 第2日A组 10 5.03±0.51 B组 10 3.91±0.68*9.57±0.35 8.21±0.91 9.62±0.81*7.42±0.12*C组 10 2.02±0.68*△9.59±1.11*6.23±0.57*△
2.3 各组大鼠血清TNF-α及血清淀粉酶的含量比较见表2。与A组相比,B组血清TNF-α和淀粉酶水平降低(P<0.05);而C组各指标均较B组显著降低(P<0.05)。
3 讨 论
近年来,急性胰腺炎发病率急剧上升,尤其是AP已成为威胁人类健康的重要疾病之一[5]。该病病情凶险,变化快,可引发多种并发症,病死率高。因此,如何有效地防治急性胰腺炎具有重要的临床意义[6-7]。
表2 各组大鼠血清TNF-α及血清淀粉酶的水平比较(±s)
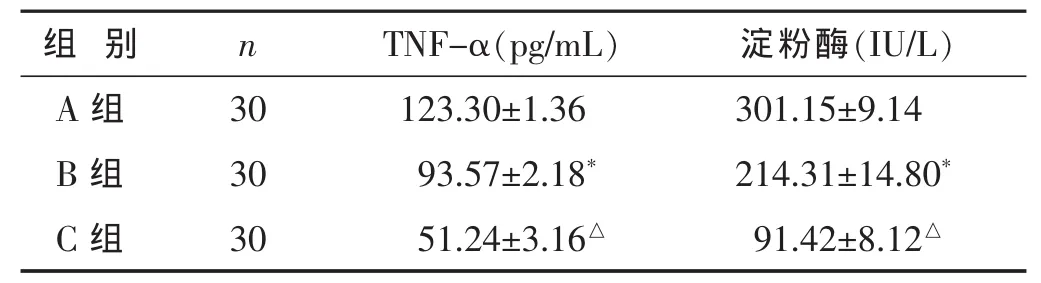
表2 各组大鼠血清TNF-α及血清淀粉酶的水平比较(±s)
?
TNF-α是一种具有广泛生物活性的非特异性炎症介质,是导致胰腺及胰外器官组织损伤和刺激其他炎症细胞因子释放的重要启动因子,血清中TNF-α活性的大小与胰腺组织的损害程度密切相关[8-9]。而人体内AMY主要来源于胰腺。正常情况下,胰腺细胞将储藏在酶原颗粒的消化酶和酶原分泌到胰管,这种分泌活动被限制在腺泡细胞顶膜。而顶膜分布有防止胰管内容物进入细胞内空间的连接屏障[10]。血清淀粉酶的升高多由急性胰腺炎引起的,常见于在发病后6~12 h,24 h达峰值,48 h开始下降,恢复正常则需3~5 d。淀粉酶活性升高的程度虽然并不一定和胰腺损伤程度相关,但其在一定程度上反映了炎症的变化,所以临床上仍以AMY作为AP诊断的首选指标[11]。
芒硝为硫酸盐类矿物芒硝族芒硝经加工精制而成的结晶体,主要含水硫酸钠(Na2SO4·10H2O)。其性味咸、苦,寒,归胃、大肠经,咸能软坚,苦能泻热。2010版《中华人民共和国药典》[12]记载其功能为泻下通便、润燥软坚、清火消肿,用于实热积滞、腹满胀痛、大便燥结、肠痈肿痛;外治乳痈、痔疮肿痛。中医学认为芒硝苦能泻热,咸能软坚,其性善消[13],且芒硝苦寒,外用可改善局部循环,促进渗出吸收,减轻炎症反应。芒硝有好的抗炎作用,可能与芒硝外敷可加快淋巴循环、增强网状内皮细胞吞噬功能、减少局部白细胞浸润、减轻炎性反应有关。
超声电导靶向给药治疗技术是近年来国内外出现的一种药物渗透的新疗法。其主要作用机制是通过电致孔技术、超声空化技术和现代离子导人技术的综合应用产生促进药物的透皮叠加作用,给药速度快。这种给药方法避免药物在肝脏首过效应,不受胃肠道的消化酶的降解破坏,无血药浓度的峰谷变化。药物在病变局部形成较高的血药浓度,代谢缓慢,作用时间长久。
本实验研究,B组和C组大鼠的病理评分均明显低于A组,与B组相比,C组大鼠第2日和第3日的病理学评分均更低;与A组相比,B组的血清TNF-α 和AMY降低,差异有统计学意义;C组各指标均较B组显著降低,故经皮芒硝超声导入较传统芒硝外敷对急性胰腺炎具有更好的炎症吸收作用。通过超声波对流转运、辐射等功能的强力驱动作用,使药物沿人工生物通道直接进入病变的器官和组织,并迅速形成药物高浓度浸润区,使组织局部血管扩张,血流加速,增加渗透,加速组织的新陈代谢,改善组织的营养;同时可使肌张力下降,结缔组织的延展性增强,软化瘢痕,松解粘连,有消炎镇痛的作用[15]。
总之,本研究利用经皮芒硝超声药物导入法对急性胰腺炎大鼠模型的疗效明显优于单一传统给药疗法,能有效地改善血液循环,增强胰腺炎症渗出物的吸收,从而达到治疗疼痛的目的。故经皮芒硝超声导入法有望运用于临床急性胰腺患者,以期为急性胰腺炎患者提供多样化的辅助疗法。
[1] 刘井瑞,高林棣,张新明,等.急性胰腺炎大鼠血清IMD的早期改变[J].青岛大学医学院学报,21015,51(5):611-616.
[2] 王巧瑜.芒硝外敷联合生长抑素在治疗急性胰腺炎中的应用[J].广东医学,2014,5(10):1567-1568.
[3] 杨波,黄鹤光,陈大良,等.逆行性胰胆管注射法制作重症急性胰腺炎大鼠模型[J].福建医科大学学报,2002,36(1):71-72.
[4] Schmidt J,Lewandrowsi K,Warshaw AL,et al.M orphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat[J].Int J Pancreatol,1992,12(1):41-51.
[5] Pier Alberto Testoni.Acute recurrent pancreatitis:Etiopathogenesis,diagnosis and treatment[J].World J Gastroenterol,2014,20(45):16891-16901.
[6] Swetha K,Walter P,Aida H.Pharmacologic therapy for acute pancreatitis[J].World J Gastroenterol,2014,20(45):16868-16880.
[7] Yildirim AO,InuM,Eyi YE,et al.The effects of glycyrrhizin on expsrimental acute pancreatitis in rats[J].Eur Rev Ued Pharmacol Sci,2013,17(22):2981-2987.
[8] Marcelo GB,Andres AB,Daniel R.Chronic stress sensitizes rats to pancreatitis induced by cerulein:Role of TNF-α[J].World J Gastroenterol,2010,16(44):5565-5581.
[9] 付锐,项和平,杨刑琦,等.降钙素原、C反应蛋白、肿瘤坏死因子、游离DNA对多位患者发生多器官功能障碍综合征的预测价值[J].中华急诊医学杂志,2013,22(8):850-854.
[10]Butler J,Bates D.Serum amylase and acute pancreatitis[J].Emerg Med J,2003,20(6):550-551.
[11]付华,胡岗,吴华,等.血淀粉酶指标在急性胰腺炎中变化的研究[J].中华医院感染学杂志,2013,23(18):4596-4597.
[12]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:118-119.
[13]周珂,王业莉.大黄灌肠配合芒硝外敷辅治急性胰腺炎的临床观察[J].浙江中医药大学学报,2015,7(39):545-554.
[14]梁卓,张军.超声药物导入结合中药保留灌肠治疗慢性盆腔炎疗效评价[J].辽宁中医药大学学报,2015,7(19):575-554.
[15]Schlafer 0,Sievers M,Klotzbucher H,et al.Improvement of boil-ogical activity by low energy ultrasound assisted.Bioreactors[J].Ultra-sonics,2000,38(1-8):711-716.
Experimental Study on Mirabilite by Percutaneous Ultrasound Guided for Rat Model with Acute Pancreatitis
JIN Jiajia,CHEN Jianhua,YANG Weigang.Huzhou Hospital of Traditional Chinese Medicine,Zhejiang,Huzhou 313003,China.
R576 文献标志码:A
1004-745X(2016)08-1471-03
10.3969/j.issn.1004-745X.2016.08.005
浙江省中医药科技计划项目(2013ZB125)
2016-02-15)

