刺参多糖超声-微波协同提取工艺优选
王庆芬, 黄丽英, 林曦瑾, 朱璐璐, 许小琦, 阮舒健
刺参多糖超声-微波协同提取工艺优选
王庆芬1,2, 黄丽英1, 林曦瑾3, 朱璐璐3, 许小琦3, 阮舒健3
目的以刺参多糖(SCPS)的提取率和纯度为评价指标,优选SCPS的提取工艺。方法以苯酚-硫酸法测定SCPS的纯度,并以提取率和纯度作为评价指标,采用正交试验法对SCPS的提取工艺进行优选。结果以D-葡萄糖醛酸为对照品并确定SCPS超声-微波协同提取的最佳提取工艺为取刺参粉末加入15倍量蒸馏水,微波功率80 W,提取4次,每次30 min。结论利用超声微波协同提取SCPS工艺科学合理、稳定可行,提取率较高。
多糖类; 微波; 提取法; 工艺学; 酚类; 硫酸类; 正交试验
刺参(Stichopus japonicus)是我国20多种食用海参中品质最好的一种,属于棘皮动物门刺参纲刺参科[1],是一种海洋动物性药材,具有抗肿瘤、抗凝血、抗血栓、降血脂、降低血黏度、免疫调节、抗菌等作用,同时在辅助治疗慢性乙型肝炎及高血压病等常见疾病上得到中医广泛的认同和应用[2-3]。刺参的主要活性成分有刺参多糖、刺参皂苷、多肽、刺参神经节苷酯等,其中刺参多糖具有抗肿瘤、抗凝血和提高免疫力等作用,在医药方面的应用越来越受到人们的关注,逐步成为海洋生物活性物质综合利用的研究热点。
多糖结构复杂,种类多样,分子量和极性大,且常与蛋白质、脂质等结合成多糖复合物,这给多糖的提取带来了困难。传统的多糖提取方法均存在提取时间长、多糖提取率不高等不足[4]。超声-微波协同萃取技术是一种新型的提取技术,直接将超声振动与开放式微波两种作用方式相结合,利用超声波振动的空化作用以及微波的高能作用,实现了低温常压条件环境下,对样品进行快速和高效的提取。超声-微波协同法用于中草药有效成分提取已得到较广泛的应用。本文采用苯酚-硫酸法并以D-葡萄糖醛酸为对照品,测定刺参多糖的含量[5],以刺参多糖提取率和纯度作为指标[6-7],采用正交试验设计优选刺参多糖的超声-微波协同提取工艺。
1 材料与方法
1.1材料干燥刺参(市售,产地福建霞浦);D-葡萄糖醛酸(纯度98%,批号:1216012)、葡萄糖(纯度99.9%,批号:1403066)、L-岩藻糖(纯度99%,批号:1102021)、D-半乳糖(纯度97%,批号:1224032)、甘露糖(纯度99%,批号:133708),均为阿拉丁试剂有限公司生产;三氯甲烷、正丁醇、苯酚、浓硫酸均为分析纯(国药集团化学试剂有限公司),实验用水为二次蒸馏水,实验室自制。
1.2仪器超声-微波协同萃取仪(CW-2000,新拓微波溶样测试技术有限公司);低速大容量多管离心机(LXT-IIB ,上海安亭科学仪器厂):旋转蒸发器(RE-2000,上海亚荣生化仪器厂);冷冻干燥机(FD-1,北京博医康技术公司);紫外分光光度计(UV-2450,日本岛津有限公司);自动三重纯水蒸馏器(SZ-97,上海亚荣生仪器厂);倾倒式粉碎机(DJ-10A,上海淀久中药机械制造有限公司)。
1.3方法
1.3.1各单糖对照品溶液的制备精密称取D-葡萄糖醛酸、葡萄糖、L-岩藻糖、D-半乳糖、甘露糖对照品各10.0 mg于10 mL量瓶中,加蒸馏水混匀并稀释至刻度,即得1.0 mg/mL的单糖对照液,冷藏备用。临用前取各单糖对照品储备液1.0 mL于10 mL量瓶中,加蒸馏水稀释至刻度,得0.1 mg/mL的对照品溶液。
1.3.2SCPS供试品溶液的制备精密称取刺参粗多糖干浸膏20.0 mg于10 mL量瓶中,加蒸馏水稀释至刻度,即得2.0 mg/mL的样品,冷藏备用。临用前,取样品储备液1.0 mL于10 mL量瓶中,加水稀释至刻度,即得0.2 mg/mL的供试品溶液。
1.3.3SCPS对照品的筛选精密量取蒸馏水1.0 mL,加入5%苯酚溶液0.6 mL,立即加入硫酸6. 0 mL,迅速摇匀,100 ℃水浴中加热15 min,取出后立即放入冰浴下放置15 min,取出,冷却,作为空白对照置于300~800 nm内调零。精密吸取单糖对照品溶液和SCPS供试品溶液各2.0mL,同上操作,在300~800 nm波长范围内扫描,得各溶液的吸收曲线。
1.3.4D-葡萄糖醛酸标准曲线的制备与线性关系的考察精密量取0.1 mg/mL D-葡萄糖醛酸对照品溶液0,0.2,0.4,0.6,0.8,1.0 mL于25 mL具塞试管中,加蒸馏水补足至1.0 mL。分别加入5%苯酚溶液0.6 mL,再加入硫酸6.0 mL,迅速摇匀,100 ℃水浴中加热15 min,取出后立即放入冰浴中15 min,取出,冷却,在478 nm 测定吸光度,重复测定3次。以D-葡萄糖醛酸的浓度c(mg/mL)为横坐标,吸光度值A为纵坐标,绘制D-葡萄糖醛酸浓度与吸光度的标准曲线,得到线性回归方程:
A=4.719 8c-2.6×10-3,r=0.999 5
1.3.5SCPS提取方法的考察取刺参粉末约3.0 g,精密称定,按照料液比1∶15加入蒸馏水,混合摇匀,分别采用超声微波协同提取、超声提取和加热水煮法提取30 min,5 000 r/min离心10 min,取上清液,滤渣加45 mL蒸馏水,重复提取3次,合并上清液,减压浓缩至20 mL左右。往浓缩液中加入三氯甲烷20 mL和正丁醇5 mL,剧烈振摇10 min,5 000 r/min离心10 min,取出蛋白质层,重复3次,取上层液,加入3倍量无水乙醇静置过夜,5 000 r/min离心30 min,弃去上清液,所得沉淀即为含杂质的粗多糖[8],粗多糖经冷冻干燥48 h后得干浸膏。
1.3.6正交试验优选SCPS超声-微波提取工艺以提取的料液比、微波功率、提取时间、提取次数为影响因素,采用L9(34)正交试验设计,以刺参多糖提取率和纯度为考察指标,对刺参多糖的提取工艺进行优选,因素及水平见表1。计算公式如下:
刺参粗多糖提取率=m干浸膏/m药材×100%
刺参粗多糖纯度=ρ测得的多糖/ρ粗多糖×100%
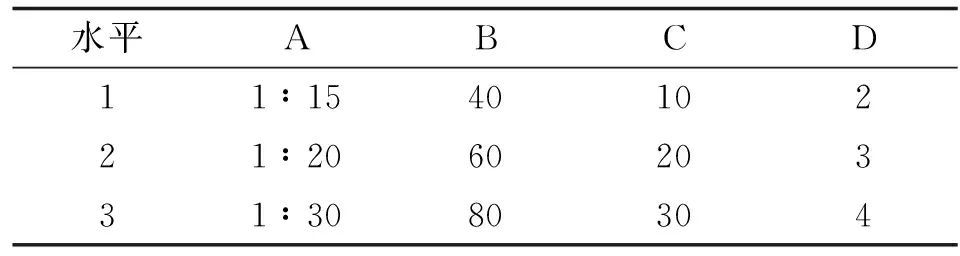
表1 正交试验因素水平表
A:料液比; B:微波功率; C:提取时间; D:提取次数.
2 结 果
2.1对照品的选择D-半乳糖、甘露糖、葡萄糖、L-岩藻糖、D-葡萄糖醛酸和海参多糖经苯酚-硫酸法显色后的紫外-可见吸收光谱图见图1。其中,D-葡萄糖醛酸和海参多糖经苯酚-硫酸法后的紫外-可见吸收谱图形状最为相似,二者均在313 nm和478 nm处有2个吸收峰;其他单糖与苯酚-硫酸显色后其紫外-可见吸收谱图与海参多糖的吸收谱图有4个吸收峰,除320 nm和480 nm处的吸收峰有吸收外,还有2个肩峰,分别位于405 nm及528 nm处,差别大,不适合作为测定海参多糖的标准品。故本实验选用D-葡萄糖醛酸作为对照品,在478 nm处测定刺参多糖含量。
2.2精密度试验分别精密吸取0.1 mg/mL D-葡萄糖醛酸溶液0.6 mL 于6支25 mL 具塞试管中,加水补足至1.0 mL。按照“1.3.4”方法测定浸膏中刺参多糖的含量,重复测定6次。结果表明,6份样品的平均吸光度为0.371,RSD为0.60%。
2.3稳定性实验精密吸取0.2 mg/mL的样品溶液1 mL于25 mL试管中,按照“1.3.4”方法测定浸膏中刺参多糖的含量,重复测定6次。在2 h内每隔15 min在478 nm处测定吸光度。结果表明,样品的平均吸光度为0.367,RSD为0.92%,表明此方法在2 h内稳定。
2.4日间稳定性试验精密吸取0.2 mg/mL的样品溶液1 mL于25 mL 具塞试管中,按照“1.3.4”方法测定浸膏中刺参多糖的含量,重复测定6次,重复6 d测定结果。结果表明,样品的平均吸光度为0.369,RSD为0.89%。
2.5加样回收率试验精密吸取0.2 mg/mL的样品溶液0.5 mL,精密量取0.1 mg/mL D-葡萄糖醛酸溶液0.20,0.35,0.50 mL于25 mL 具塞试管中,加水补足至1.0 mL。按照“1.3.4”方法测定浸膏中刺参多糖的含量,重复测定3次。结果见表2。
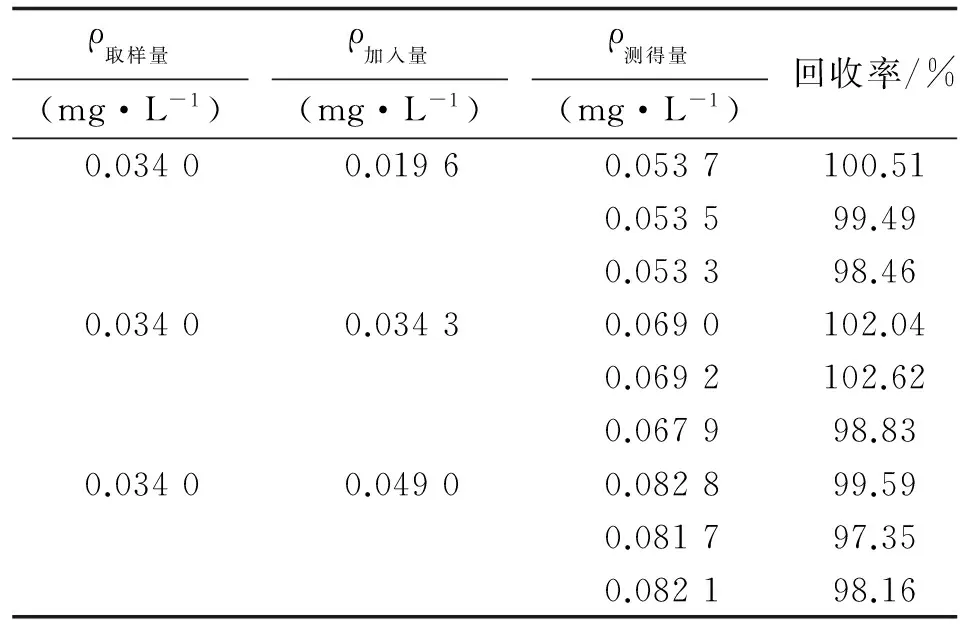
表2 加样回收率试验结果
n=3.
2.6SCPS提取方法的考察结果不同提取方法刺参多糖提取率结果见表3。采用超声-微波协同提取得到的粗多糖干浸膏提取率最高。
表3不同提取方法刺参多糖提取率
Tab 3Extraction rate of polysaccharide of different experimental methods
2.7超声-微波协同强化提取工艺正交试验结果分析正交试验结果见表4,方差分析结果见表5,6。由表5可以看出,以多糖提取率各因素作用主次为B>C>A>D;以纯度为考察指标,无显著性差异。表5结果表明微波功率对刺参多糖的提取率有极显著的影响,提取时间对提取率有影响。故依据直观分析结果,选择刺参多糖的最佳提取工艺为A1B3C3D3。
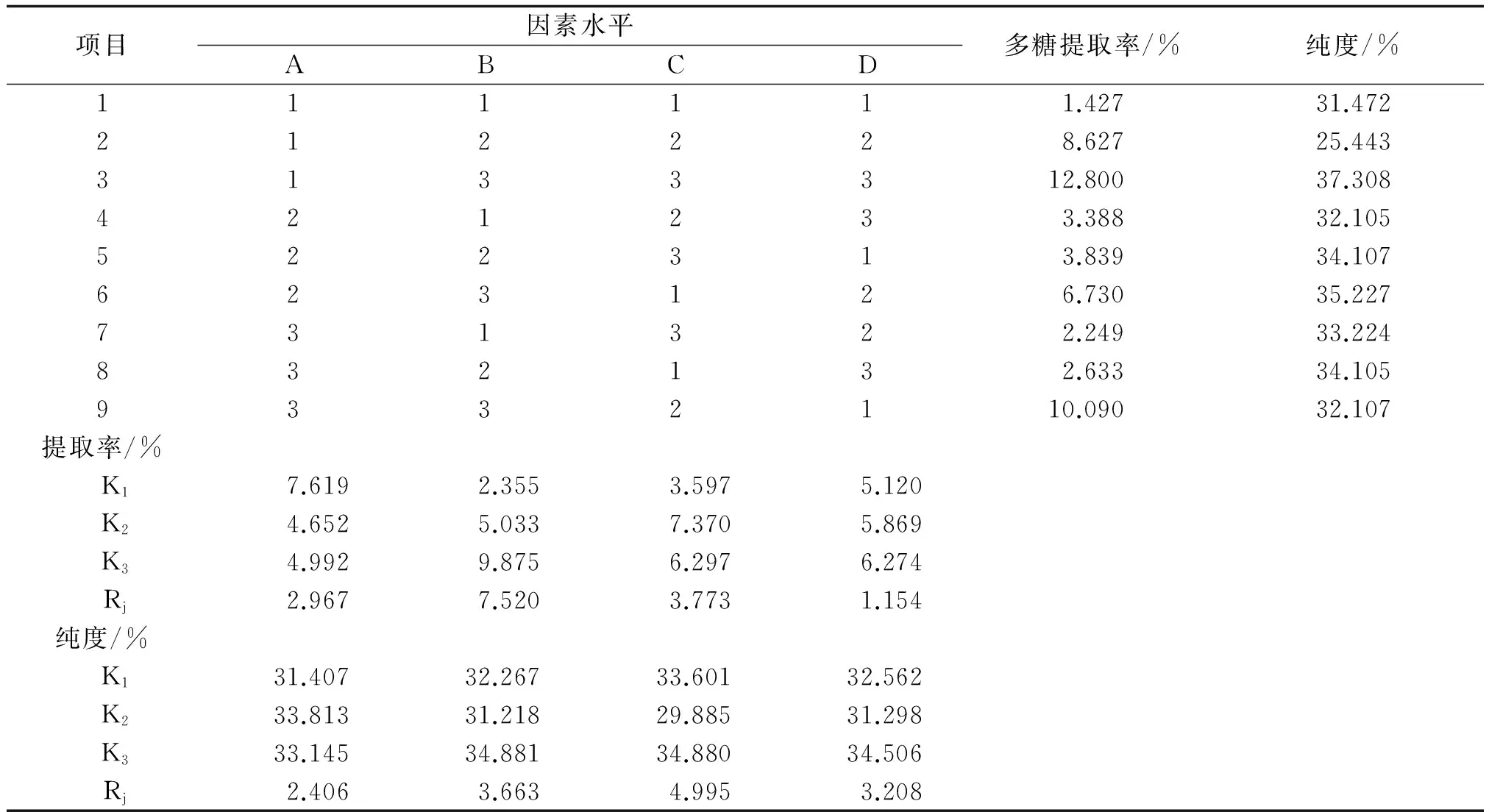
表4 L9(34)正交实验结果分析
2.8最佳工艺验证试验依照正交试验所优选的最佳工艺条件,采用超声-微波协同提取法提取3批SCPS的平均提取率分别为12.387%,12.379%和12.127%;RSD为1.7%,2.5%和2.7%。该提取工艺与正交试验结果基本一致,表明该工艺合理可行,稳定性较好。
3 讨 论
多糖常见的提取方法有强碱提法和酶解法。传统提取方法存在提取周期长、多糖提取率不高等不足。超声-微波协同提取法将微波和超声两种手段有机结合起来,大大提高了提取效率,还可避免了高温对提取成分的影响,具有省时、节能、提出率高等优点[9-10],在中草药化学成分提取中的应用已经显示出明显的优势。目前已有研究报道用于黄芪多糖和灵芝多糖等的提取[9,11],但未见用于刺参多糖的提取报道。
A:料液比; B:微波功率; C:提取时间; D:提取次数.△:P<0.05为显著性.

表6 刺参多糖纯度方差分析表
A:料液比; B:微波功率; C:提取时间; D:提取次数.
多糖是海参体壁的重要成分,刺参多糖由葡萄糖醛酸、乙酰氨基半乳糖、岩藻糖及硫酸基组成的杂多糖[12],成分较为复杂。本研究对海参多糖含量测定中的单糖对照品经过苯酚-硫酸法进行筛选,结果表明D-葡萄糖醛酸对照品和样品溶液的吸收曲线最为相似,所以选用D-葡萄糖醛酸为单糖对照品。
[1]张月杰,卢明锋,吉爱国. 刺参多糖药理作用研究进展[J].中国生化药物杂志,2012,33(1):74-77.
[2]Ye L B,Xu L,Li J R. Preparation and anticoagulant activity of a fucosylated polysaccharide sulfatefrom a sea cucumber Acaudina molpadioidea[J].CarbohydPolym,2012,87(3):2052-2057.
[3]Wijesinqhe W A,Jeon Y J,Ranasamy P,etal. Anticancer activity and mediation of apoptosis in human HL-60 leukaemia cells by edible sea cucumber (Holothuria edulis) extract[J].FoodChem,2013,139(s1-4):326-331.
[4]薛丹,黄豆豆,黄光辉,等. 植物多糖提取分离纯化的研究进展[J]. 中药材,2014,37(1):157-161.
[5]张锦雀,黄丽英,吴晓珊. 金线莲多糖苯酚-硫酸法测定条件的优化[J]. 中国医院药学杂志, 2010,30(2):113-115.
[6]彭凯丽,李新,李元林,等. 正交试验优选复方桑菊口服液中药材的提取工艺[J].中国药房,2014,25(3):243-245.
[7]李跃辉,凌艳君,朱沛,等.正交试验优选鼻敏宁颗粒提取工艺[J].中国医药导报,2014,11(2):114-116.
[8]韩秋菊,马宏飞. 海参多糖的提取与纯化研究[J]. 安徽农业科学, 2012,40(14):8071-8074.
[9]张玉朝,李小艳,宋强,等. 超声-微波协同萃取灵芝多糖最佳工艺研究[J]. 福建中医药大学学报,2011,21(2):36-38.
[10]杨胜丹,付大友. 超声波、微波萃取及其联用技术在中药有效成分提取中的应用[J]. 广东化工,2010,37(2):120-122.
[11]杜广芬,蔡志华,王刚,等. 黄芪多糖超声-微波协同提取研究[J]. 天然产物研究与开发,2012,24(1):114-117.
[12]张月杰,卢明锋,吉爱国. 刺参多糖药理作用研究进展[J].中国生化药物杂志,2012,33(1):74-77.
(编辑:张慧茹)
Optimization on Ultrasound-microwave Assisted Extraction Process of Stichopus Japonicus Polysaccharide
WANG Qingfen1,2, HUANG Liying1, LIN Xijin3, ZHU Lulu3, XU Xiaoqi3, RUAN Shujian3
1.College of Pharmacy, Fujian Medical University, Fuzhou 350004,China;2.Department of Pharmacy, 175 Hospital of PLA,The Affiliated Southeast Hospital of Xiamen University, Zhangzhou 363000,China;3.College of Preclinical Medicine, Fujian Medical University, Fuzhou 350004,China
ObjectiveChoose extraction rate and the content determination of Stichopus Japonicus polysaccharide(SCPS) as evaluation indicator, then optimize the best extraction.MethodThe content of SCPS was detected by phenol-sulfuric acid method to choose the suitable standard monosaccharide and orthogonal test was applied to study the SCPS extracted factors with its extraction rate and content as evaluation index.ResultD-glucuronic acid was chosen and the best ultrasound-microwave assisted extraction of SCPS was as follows: ratio of solid and liquid 1∶15, microwave power 80 W, extracting for four times, each time for 30 min.ConclusionThe optimal extraction conditions were rational and feasible, with less time and higher extraction rate.
polysaccharides; microwaves; extraction; technolog; phenols; sulfuric acids; orthogonal test
2015-09-13
国家海洋局海洋生物遗传资源重点实验室开放研究基金(HY201404);国家卫生和计划生育委员会科研基金(wkj-FJ-33);国家级大学生创新创业训练计划项目(201410392016)
1.福建医科大学 药学院,福州350004;
2.解放军第一七五医院,厦门大学附属东南医院 制剂科,漳州363000;
王庆芬(1982-),女,福建医科大学2014级硕士研究生
黄丽英.Email:fjmuhly88@sina.com
R282.74; R343.9; R454.1; R927.2; R977.7
A
1672-4194(2016)02-0078-04
3.福建医科大学 基础医学院,福州350004

