热敏型核酸酶在毕赤酵母中的分泌表达及催化特性
陈芳霞,陈鹏
热敏型核酸酶在毕赤酵母中的分泌表达及催化特性
陈芳霞,陈鹏
西北农林科技大学 生命科学学院,陕西 杨凌 712100
核酸酶在生物工程领域有着重要的应用价值。本研究在优化北极虾核酸酶 (Shrimp nuclease,SNU) 基因序列的基础上,构建SNU的毕赤酵母分泌表达载体SNU-pPICZα A并转化酵母,以高拷贝整合转化子为基础,优化酶表达的条件,并对该酶的催化特性进行分析,结果显示SNU可在毕赤酵母SMD1168H中高效分泌表达,最佳诱导表达条件为:培养基BMMY pH 6.0,甲醇浓度为1%,诱导时间为72 h,诱导后粗酶液比活力为1.4×105U/mL。经过DEAE Sephadex阴离子交换层析可纯化获得高纯度的目标蛋白,每升菌液可纯化15 mg目标蛋白,比活力达到6.291×106U/mg,该酶表观分子量为50 kDa,PNGaseF酶切证实该酶存在糖基化现象。二价金属离子Ca2+、Mn2+、Co2+、Mg2+及还原剂DTT、β-ME能显著地提高其水解活性,但Zn2+、Cu2+、SDS、高浓度NaCl抑制该酶的活性,SNU为Ca2+/Mg2+依赖型核酸酶。70 ℃处理10 min可使该酶不可逆的失活。
北极虾Ca2+/Mg2+依赖型核酸酶,毕赤酵母,分泌表达优化,催化特性
重组蛋白技术的成熟与发展为生物医药和生物学研究提供了非常高效的手段,但在蛋白生产过程中仍存在诸多技术性难题。在重组蛋白纯化过程中菌体裂解释放核酸产生高粘度的裂解液,影响下游的操作和层析纯化。蛋白粗提液过量的核酸将导致纯化产品的核酸污染,因此在蛋白纯化上游步骤除去核酸意义重大。酶法除去核酸是现今蛋白质粗提液处理最主要的途径。商业化产品DNase I是最为常用的去除核酸的酶制剂[1],但存在催化活力低、价格昂贵等缺点,来源于灵杆菌商品化核酸酶Benzonase endonuclease (Merck) 由于具有高的催化效率,使之成为生物化学和药物制剂领域重要的核酸污染控制用酶[2-4]。但Benzonase酶稳定性极高、灭活难,在后续蛋白纯化过程中,需要采用较为复杂的色谱技术去除微量的核酸酶,使目标蛋白损失以及分离纯化的成本明显增加。因此筛选高活性且易热失活的热敏核酸酶对于蛋白纯化工艺的优化有重要的价值,特别是对生物学领域众多嗜热蛋白纯化过程中,当热敏核酸酶除去核酸后,可以利用嗜热蛋白的热稳定性,通过加热失活的方式高效除去反应后的核酸酶。另外核酸酶是生产食品添加剂和医药行业中重要原料——单核苷酸的重要酶制剂[5],因此研究开发新的核酸酶,对于核苷酸生产工艺的改造有重要的实践价值。
北极虾胰脏中纯化的核酸酶 (Shrimp nuclease,SNU) 是少有报道的一种热敏核酸酶,其在65 ℃的活力半衰期为1 min,且热失活表现为不可逆[6],已有的研究都是从北极虾胰脏中直接提取该核酸酶,关于北极虾核酸酶的重组表达至今未有文献报道。与之同源的热敏型蟹核酸酶DSN及其突变体DSN-TL成功在宿主BL21 (DE3) 中重组表达[7-8],其他一些非特异性核酸酶 (DNase Ι[9]),灵杆菌核酸酶[10-11],NucA[12])也都已经实现了在大肠杆菌周质或培养基中的分泌表达,虽然利用原核表达系统胞内高效表达核酸酶有零星的文献报道,但是这些核酸酶的重组中往往存在对宿主细胞的高毒性,表现出宿主很难生长或者以无活性的包涵体形式表达等问题,加之多数核酸酶存在糖基化现象[13],使利用原核系统表达核酸酶存在较大的技术障碍。毕赤酵母具有原核生物无法比拟的优点,非常适合于对宿主高毒性核酸酶的重组表达。本研究利用重叠PCR优化北极虾核酸酶基因并构建毕赤酵母分泌表达载体,在筛选高拷贝转化菌的基础上,构建北极虾核酸酶的重组表达体系,并对重组表达酶的催化特性进行分析,以期为该酶的分子改造及应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
大肠杆菌菌株TOP10、毕赤酵母SMD1168H和毕赤酵母表达载体pPICZα A均由本实验室保存。
1.1.2 工具酶与主要试剂
限制性核酸内切酶、T4 DNA连接酶、蛋白Marker均购自Fermentas公司。IProof DNA聚合酶为Bio-Rad公司产品,pEasy Blunt Zero克隆载体为北京全式金生物技术有限公司产品;PNGaseF、DNA Marker购自大连宝生物工程有限公司。其他常用生化及分子生物学试剂均为国产或进口分析纯。DEAE sephadex A-50为GE公司产品。引物合成及测序由北京奥科生物技术有限责任公司完成。
1.2 方法
1.2.1 核酸酶密码子的优化
参考GenBank报道的北极冷水虾核酸酶蛋白质序列 (GenBank Accession No. CBG22733),去除N端的23个氨基酸残基的信号肽序列,根据毕赤酵母密码子的偏好性,参考Sharp等[14]的方法对成熟蛋白的381个氨基酸残基编码的cDNA进行密码子优化。根据优化序列合成32条引物用于优化基因的拼接合成,其中N端和C端对应的引物分别添加Ⅰ和Ⅰ的限制性内切酶酶切位点。利用PCR拼接合成的基因序列克隆到pEasy Blunt Zero载体上,送北京奥科生物技术公司进行测序分析。
1.2.2 分泌表达载体的构建及转化:
分别参考Sambrook[15]的方法和Easy SelectTMExpression Kit的说明。
1.2.3 毕赤酵母转化子鉴定及表达分析
转化子鉴定:挑单克隆于20 μL 20 mmol/L NaOH溶液中,煮沸10 min,10 000 r/min离心2 min,取1 μL上清作为模板,用AOX PCR扩增确定目的基因是否整合到酵母中。
高Zeocin抗性菌株SNU插入拷贝数测定:参考李凯等[16]的方法进行,目的基因SNU和内参基因GAPDH引物设计见表1。
表1 本研究所用引物
Table 1 Primers used in this study
Underlined letters indicateⅠⅠdigestion sites.
表达分析:挑取数个单菌落接种于5 mL BMGY培养基中,250 r/min、30 ℃培养过夜直到600为2–6。经BMGY培养的5 mL菌液5 000 r/min离心10 min,用BMGY培养基重悬菌体于50 mL BMMY培养基中,250 r/min、30 ℃培养,每24 h补加甲醇一次至终浓度为1%,并于24、42、78、96 h分别取样1 mL,离心,取上清,加终浓度至10%的三氯乙酸沉淀蛋白,沉淀用预冷80%丙酮洗涤2–3次,SDS-PAGE分析目标蛋白的表达水平。筛选获得的目标蛋白表达量高的克隆用于后续的研究。
1.2.4 表达条件的优化
选择表达量最高的克隆,参考1.2.3的步骤,分别在不同诱导时间 (24、48、72、96 h),不同甲醇诱导浓度 (体积分数为1%,0.5%) 下进行表达条件的优化。
1.2.5 表达蛋白的纯化
经最优培养条件诱导获得的毕赤酵母培养液离心后,上清经溶液A (10 mmol/L Tris-HCI,pH 7.0,50 mmol/L NaCl) 4 ℃透析过夜后上样于预先平衡的DEAE Sephadex A-50离子交换柱上,然后用溶液A除去未结合的蛋白,用含0–1.0 mol/L NaCl的溶液A进行线性梯度洗脱,分步收集洗脱液并进行酶活测定。将各活性管合并于10 mmol/L Tris-HCl缓冲液 (pH 7.0) 4 ℃透析过夜,经PEG6 000浓缩后进行电泳检测。蛋白浓度的测定采用考马斯亮蓝G250法,用牛血清蛋白制作标准曲线。
1.2.6 PNGaseF分析核酸酶糖基化
根据PNGaseF说明书进行[17]。10 μg纯化酶液中加入10 μL变性缓冲液,100 ℃保温3 min使酶蛋白变性以暴露所有的糖基化位点,然后加入稳定剂缓冲液5 μL,1 U PNGaseF,去离子水补足体积至30 μL,37 ℃反应18 h后进行SDS-PAGE分析。
1.2.7 核酸酶酶活性的测定
参照Ko等的方法[18]进行。酶活力单位定义为每分钟生成的核苷酸量在260 nm处的吸光值⊿=1.0时为1 U。以20 μg pEASY-Blunt Zero质粒DNA 为底物。反应体系为:2 μL缓冲液 (100 mmol/L Tris-HCl,pH 8.0,50 mmol/L MgSO4),10 μg pEASY-Blunt Zero质粒载体,1 U纯化的核酸酶,用ddH2O补充至终体积为20 μL,混匀,37 ℃保温10 min。反应结束后,加1/4体积1 mol/L HCl,25% TCA终止反应。上清用灭菌ddH2O稀释,在260 nm处测定光吸收值。
1.2.8 不同反应时间、温度、pH、金属离子及还原剂对核酸酶活性的影响
参考1.2.7的方法,分析不同反应时间和温度 (0、4、28、37、50、60 ℃) 对水解活性的影响,同时分析了不同pH (4.0、5.0、6.0、7.0、8.0、9.0、10.0) 和0、1、5、10 mmol/L金属离子 (Mg2+、Ca2+、Co2+、Mn2+、Cu2+、Zn2+) 对水解活性的影响。同时测定了1、10 mmol/L DTT/β-巯基乙醇,0.1%、1%的表面活性剂Triton X-100/Tween-20/SDS以及50、100、200、300、400 mmol/L NaCl对核酸酶活性的影响,反应完毕后立即用10 μL 250 mmol/L EDTA终止反应,1.0%琼脂糖凝胶进行电泳检测。
1.2.9 核酸酶的不可逆热失活分析
为了确定核酸酶的不可逆失活温度,参考1.2.7的方法,反应体系预先不加底物于50、60、70 ℃分别保温10 min,加热后的溶液冰上放置 30 min后,加入底物,37 ℃反应30 min,电泳检测是否存在水解活性。
2 结果与分析
2.1 重组质粒的构建和鉴定
通过32条引物重叠延伸PCR获得了去除信号肽的核酸酶编码区序列,电泳分析显示在1 200 bp左右有一特异DNA扩增带,经克隆测序显示含有1 176 bp的目标编码区 (含毕赤酵母Kex2 signal及Ste13 signal 切割序列),与预期结果一致。优化合成的核酸酶基因经ⅠⅠ双酶切连接至pPICZα A载体,重组质粒经双酶切验证,插入片段与预期大小一致,说明重组表达载体pPICZα A -SNU构建成功。
2.2 重组蛋白表达条件的优化
通过Zeocin抗性水平,筛选酵母高拷贝整合转化子[19],然后PCR鉴定正确的6个克隆分别在pH 6.0,1%甲醇浓度下诱导表达,从蛋白表达水平再次筛选出目标蛋白表达量高的单克隆菌株,实时荧光定量PCR结果表明此高拷贝菌株有8个目的基因拷贝整合到酵母基因组。诱导96 h的培养液上清浓缩进行SDS-PAGE检测,在50 kDa处出现明显的条带 (图1),略大于北极虾核酸酶的理论分子量42 kDa。
从甲醇浓度和诱导时间对蛋白表达条件进行优化,图1中可以看出最佳组合为:1%的诱导甲醇浓度,72 h目的蛋白表达量达到最大值,可能是0.5%的甲醇浓度,不能满足毕赤酵母所需的碳源,使得目的蛋白表达量略低。
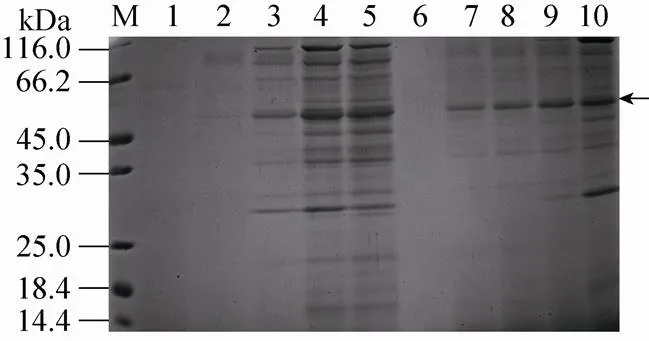
图1 不同甲醇诱导浓度和诱导时间下SNU表达量的SDS-PAGE分析
2.3 重组核酸酶的纯化
随着酵母诱导时间的延长,营养的限制造成溶菌现象或蛋白的降解,SDS-PAGE分析检测到蛋白种类增多 (图1,泳道10),研究选择诱导 72 h的上清经透析和阴离子交换层析进行纯化,梯度洗脱活性管经浓缩后进行SDS-PAGE分析,结果显示为单一条带(图2A)。
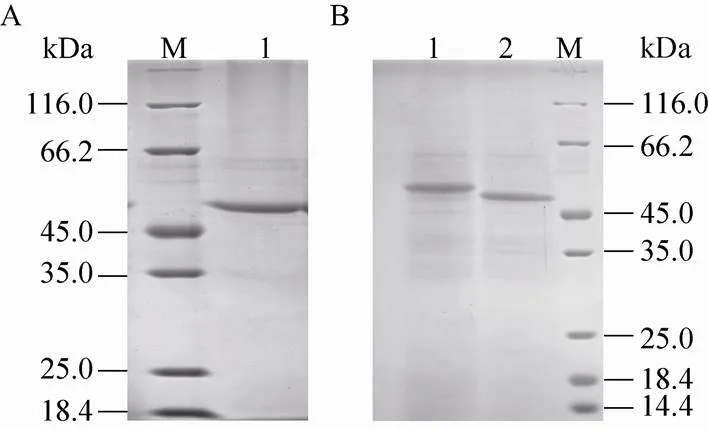
图2 表达蛋白的纯化 (A) 和糖基化分析 (B)
2.4 PNGase F分析核酸酶糖基化
SDS-PAGE分析纯化后的SNU分子量大于理论分子量,推测可能存在翻译后的糖基化修饰。经PNGaseF处理的SNU SDS-PAGE分析显示分子大小为48 kDa,比预期分子量仍偏大 (图2B),说明毕赤酵母表达的SNU可能存在非PNGase F可水解的其他糖基化修饰。
2.5 核酸酶SNU催化特性分析
2.5.1 不同反应温度和pH对酶活性的影响
为便于研究SNU的催化影响因素,在给酶量为1 U,10 μg质粒为底物,反应条件为37 ℃,pH 8.0的条件下,SNU水解核酸的时间进程测定实验发现,以10 μg质粒为底物最佳反应时间为10 min。
在0–60 ℃范围内测定SNU水解核酸的活性,如图3A所示,在0–60 ℃范围内SNU均具有水解活性,即使在0 ℃条件下也表现出一定的水解活性,温度达到37 ℃酶的活性达到最大值,随着温度的升高,催化水解程度明显降低。在pH 4–10范围内分析核酸酶SNU的水解活性,由图3B所示,SNU在pH 5.0–9.0的酸碱范围都保持一定的水解活性,最适pH范围为6.0–8.0。
图3 温度 (A) 和pH (B) 对SNU酶活性的影响
2.5.2 金属离子对酶活性的影响
SNU的水解活性需要二价金属离子催化,实验反应体系中添加不同的金属离子引起的效应存在差异,Mg2+、Co2+、Ca2+、Mn2+能有效激活核酸酶水解反应,Mg2+/Mn2+对核酸酶激活作用明显大于Co2+和Ca2+,并且不同浓度的二价离子对核酸酶活性有着不同的促进作用,伴随Mg2+和Mn2+浓度的增加 (≥5 mmol/L),激活作用减弱,5 mmol/L Mg2+和 1 mmol/L Mn2+显著提高水解效率,而核酸酶对Co2+和Ca2+浓度在5 mmol/L和10 mmol/L变化不敏感,表现为水解程度相差不大。但是低浓度和高浓度的Zn2+和Cu2+抑制了酶催化水解反应。
2.5.3 不同还原剂、变性剂、表面活性剂和NaCl对核酸酶活性的影响
研究还原剂DTT、β-巯基乙醇、表面活性剂Triton X-100、Tween-20、SDS等因素对核酸酶的影响,与对照组相比额外添加一定浓度的DTT、β-ME、Triton X-100、Tween-20等都有效提高了酶的水解活性,而0.1% SDS完全抑制酶的活性。SNU的活性受盐浓度明显影响,NaCl浓度低于0.1 mol/L时,SNU表现高的活性,当NaCl高于0.1 mol/L时即表现出对核酸酶活性的明显抑制,当反应体系中NaCl增加至0.3 mol/L时核酸酶活性被完全抑制。
2.6 核酸酶的不可逆热失活分析
酶的热失活是终止酶切反应的一种简便易行的方法,缺失质粒底物的酶切反应体系分别在50 ℃、60 ℃、70 ℃孵育10 min后,加入质粒底物进行水解反应,结果表明70 ℃预保温10 min使SNU完全失活。
3 讨论
自然生境的多样性为分离不同催化特性的酶提供了基础。从嗜冷生物中获取热敏感的酶已有较多成功的报道,如从北极虾中分离的虾碱性磷酸酶 (Shrimp alkaline phosphatase,SAP) 是基因工程操作过程使用的主要去磷酸化酶[20];南极细菌TAB5中分离的碱性磷酸酶TAP (TAB5 alkaline phosphatase,TAP)在原核系统中可以实现重组表达而成为SAP的有效替代酶[[21]。从北极虾胰脏中纯化获得的核酸酶SNU特异作用于双链的DNA,核酸序列分析显示其属于RNA/DNA非特异性核酸酶,在Ca2+和Mg2+同时存在时,可能表现出RNase活性[6]。同时SNU与勘察加半岛蟹胰脏中发现的双链特异型核酸酶DSN具有相似的催化特性,在金属离子Ca2+、Mg2+、Co2+等存在条件下,能够有效切割双链DNA,而无RNase活性[22],这些特性为SNU在生物技术领域广泛应用提供了依据。
关于北极虾核酸酶的重组表达至今尚未有文献报道。本研究构建了北极虾核酸酶的毕赤酵母分泌表达载体SNU-pPICZα A,成功实现了北极虾核酸酶SNU分泌表达,优化了SNU最佳表达条件和纯化方法,每升培养液可以纯化15 mg高活性的SNU,依据Kunitz测定法对酶活力单位的定义,已报道的nuclease与DNase I的比活力分别为8.6×106U/mg和7.2×105U/mg[12],本研究重组酶SNU的比活力达到6.291×106U/mg,属于高活性的核酸酶。N-糖基化对蛋白的活性,结构和功能的稳定性起到了重要的作用[23-24],PNGaseF水解证明重组SNU存在糖基化现象。这些结果为后续规模化高密度发酵生产该核酸酶奠定了基础。
纯化的SNU表现出70 ℃,10 min不可逆的失活,这与从天然原料中纯化获得的SNU (65 ℃不可逆失活15 min) 的特性较为接近,是一种典型的热敏型核酸酶。Sugiyama等将核酸酶依据酶对辅因子和最适pH的不同分为两类:Ca2+/Mg2+依赖型核酸酶和Zn2+依赖型核酸酶[25],依据SNU催化特性证明其为Ca2+/Mg2+依赖型核酸酶。最适反应条件分析显示SNU可在宽泛的条件下保持其催化活性,且表现出对金属离子的依赖性,非离子型去污剂,还原剂可明显增加核酸酶的活性,不可逆热失活及优异的催化特性为该酶在细胞裂解液粘度的降低以及蛋白类生物药物中核酸去除等生物工程领域的应用奠定了基础。
REFERENCES
[1] Meiss G, Gast FU, Pingoud AM. The DNA/RNA non-specific serratia nuclease prefers double-stranded A-form nucleic acids as substrates. J Mol Biol, 1999, 288(3): 377−390.
[2] Gast FU, Franke I, Meiss G, et al. Immobilization of sugar-non-specific nucleases by utilizing the streptavidin-biotin interaction. J Biotechnol, 2001, 87(2): 131–141.
[3] Sastry L, Xu Y, Cooper R, et al. Evaluation of plasmid DNA removal from lentiviral vectors by benzonase treatment. Human Gene Ther, 2004, 15(2): 221–226.
[4] Marcin O, Paweł F. Benzonase-possibility of practical application. Postepy Biochemii, 2009, 55(1): 21–24.
[5] Okado N, Hasegawa K, Mizuhashi F, et al. Safety evaluation of nuclease P1 from. Food Chem Toxicol, 2015, 88:21–31
[6] Nilsen IW, Øverbø K, Havdalen JL, et al. The enzyme and the cDNA sequence of a thermolabile and double-strand specific DNase from Northern Shrimps (). PLoS ONE, 2010, 5(4): e10295.
[7] Anisimova VE, Rebrikov DV, Zhulidov PA, et al. Renaturation, activation, and practical use of recombinant duplex-specific nuclease from Kamchatka crab. Biochem-Moscow, 2006, 71(5): 513–519.
[8] Anisimova VE, Barsova EV, Bogdanova EA , et al. Thermolabile duplex-specific nuclease. Biotechnol Lett, 2009, 31(2): 251–257.
[9] Chen CY, Lu SC, Liao TH. Cloning, sequencing and expression of a cDNA encoding bovine pancreatic deoxyribonuclease I in: purification and characterization of the recombinant enzyme. Gene, 1998, 206(2): 181–184.
[10] Friedhoff P, Gimadutdinow O, Ruter T, et al. A procedure for renaturation and purification of the extracellularnuclease from genetically engineered. Protein Expr Purif, 1994, 5(1): 37–43.
[11] Chen P, Yang HY, Li HJ, et al. Expression, purification and characterization of non-specific serratia nuclease in. Chin J Biotech, 2011, 27(8): 1247–1257 (in Chinese).陈鹏, 杨海艳, 李慧婧, 等. 灵杆菌非特异性核酸酶的原核表达、纯化及活性分析. 生物工程学报, 2011, 27(8): 1247–1257.
[12] Ghosh M, Meiss G, Pingoud A, et al. Structural insights into the mechanism of Nuclease A, aββα metal nuclease from. J Biolog Chem, 2005, 280(30): 27990–27997.
[13] Rangarajan ES, Shankar V. Sugar non-specific endonucleases. Fems Microbiol Rev, 2001, 25(5): 583–613.
[14] Sharp PM, Li WH. The codon Adaptation index-a measure of directional synonymous codon usage bias, and its potential applications. Nucl Acids Res, 1987, 15(3): 1281–1295.
[15] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd Ed. New York: Cold Spring Harbor Laboratory Press, 1989: 20–25.
[16] Li K, Gao HL, Gao L, et al. Development of a real-time PCR for determination of foreign gene copy number in genome of. Acta Vet Zootechn Sin, 2011, 42(5): 742–746 (in Chinese).李凯, 高宏雷, 高立, 等. TaqMan实时荧光定量PCR检测毕赤酵母基因组中外源基因拷贝数. 畜牧兽医学报, 2011, 42(5): 742–746.
[17] Yang YL, Chang SH, Gong X, et al. Expression, purification and characterization of low-glycosylation influenza neuraminidase in α-1,6-mannosyltransferase defective. Mol Biol Rep, 2012, 39(2): 857–864.
[18] Ko CY, Lai YL, Liu WY, et al.ENDO2: its catalytic role and requirement of N-glycosylation for function. J Agric Food Chem, 2012, 60(20): 5169–5179.
[19] Zheng J, Guo N, Zhou HB. A simple strategy for the generation of multi-copywith the efficient expression of mannanase. J Basic Microbiol, 2014, 54(12): 1410–1416.
[20] Nilsen IW, Øverbø K, Olsen RL. Thermolabile alkaline phosphatase from Northern Shrimp (): protein and cDNA sequence analyses. Comp Biochem Physiol B: Biochem Mol Biol, 2001, 129(4): 853–861.
[21] Lu ZS, Chen WT, Liu R, et al. A novel method for high-level production of psychrophilic TAB5 alkaline phosphatase. Protein Expr Purif, 2010, 74(2): 217–222.
[22] Anisimova VE, Rebrikov DV, Shagin DA, et al. Isolation, characterization and molecular cloning of duplex-specific nuclease from the hepatopancreas of the Kamchatka crab. BMC Biochem, 2008, 9(1): 14.
[23] Zou SP, Shen H, Kaleema I, et al. N-glycosylation enhances functional and structural stability of recombinant β-glucuronidase expressed inJ Biotechnol, 2013, 164(1): 75–81.
[24] Han MH, Wang XF, Ding HY, et al. The role of N-glycosylation sites in the activity, stability, and expression of the recombinant elastase expressed byEnzyme Microb Technol, 2014, 54: 32–37.
[25] Sugiyama M, Ito J, Aoyag S, et al. Endonucleases. Plant Mol Biol, 2000, 44(3): 387–397.
Secretory expression and characterization of heat sensitive nuclease in
Fangxia Chen, and Peng Chen
College of Life Sciences, Northwest A&F University, Yangling 712100, Shaanxi, China
Nucleases is an important enzyme widely used in biotechnology. A codon optimized nuclease gene (SNU) from Northern Shrimps was inserted into pPICZα A vector, and expressed extracellularly in strain SMD1168H. On the basis of multi-copy recombinant strain, we further optimized the expression condition and characterized SNU. SNU was highly expressed and stable after 1% methanol induction for 72 h, yield reached 1.4×105U/mL. SDS-PAGE electrophoresis demonstrated that this is a N-linked glycoprotein of 50 kDa. It was purified by one step DEAE Sephadex chromatography to the purity of about 15 mg/L with a specific activity of 6.291×106U/mg. Functional analysis on the nuclease activity indicated that it was stimulated by bivalent iron, such as Ca2+, Mn2+, Co2+and Mg2+, but inhibited by Zn2+, Cu2+and high salt. Meanwhile, it was irreversibly inactivated at 70 ℃ for 10 min.
Northern Shrimp Mg2+/Ca2+-independent nuclease,, secretory expression optimization, catalytic characteristics
November 5, 2015; Accepted: January 25, 2016
生物育种与工艺优化
陈芳霞,陈鹏. 热敏型核酸酶在毕赤酵母中的分泌表达及催化特性. 生物工程学报, 2016, 32(7): 991–995.
Chen FX, Chen P. Secretory expression and characterization of heat sensitive nuclease in. Chin J Biotech, 2016, 32(7): 991–995.
Supported by: National Natural Science Foundation of China (Nos. 30400282, 31171606), Basic Science Research Fund in Northwest A&F University (No. 2452015214).
Corresponding author: Peng Chen. Tel/Fax: +86-29-87091637; E-mail: pengchen@nwsuaf.edu.cn
国家自然科学基金 (Nos. 30400282,31171606),西北农林科技大学基本科研业务费 (No. 2452015214) 资助。
(本文责编 郝丽芳)

