采用混合策略提高葡萄糖氧化酶在毕赤酵母中的表达水平
牟庆璇,胡美荣,陈飞,江贤章,陶勇,黄建忠
采用混合策略提高葡萄糖氧化酶在毕赤酵母中的表达水平
牟庆璇1,胡美荣2,陈飞1,江贤章1,陶勇2,黄建忠1
1 福建师范大学 生命科学学院,福建 福州 350108 2 中国科学院微生物研究所,北京 100101
为了提高葡萄糖氧化酶 (GOD) 在毕赤酵母中的表达水平,提出了甲醇/山梨醇混合碳源诱导和共表达分子伴侣二硫键异构酶 (PDI) 和透明颤菌血红蛋白 (VHb) 两种策略。利用对照菌株X33/pPIC9k–GOD 在5 L发酵罐放大培养时,采用甲醇/山梨醇混合碳源诱导,GOD最终酶活为456 U/mL,比只采用甲醇作为单一碳源诱导时GOD最终酶活提高了20%。利用整合伴侣蛋白菌株X33/pPIC9k-GOD/pPICZ-PDI-VHb在5 L发酵罐进行高密度发酵,采用甲醇/山梨醇混合碳源诱导,GOD最终酶活达到716 U/mL,蛋白浓度为7.4 g/L。研究结果对提高外源蛋白在毕赤酵母中的表达有重要参考价值。
毕赤酵母,葡萄糖氧化酶,二硫键异构酶,透明颤菌血红蛋白酶,山梨醇
葡萄糖氧化酶 (Glucose oxidase,GOD),又名β-D-葡萄糖氧化还原酶,系统编号EC1.1.3.4,能够专一的将β-D-葡萄糖氧化,同时产生过氧化氢和葡萄糖酸。高纯度的葡萄糖氧化酶为淡黄色粉末[1],一般酶制剂中还含有过氧化氢酶,构成葡萄糖氧化酶-过氧化氢酶复合体,共同起作用[1-3]。葡萄糖氧化酶在食品、医药、分析化学、临床化学和畜牧业等行业应用十分广泛。
黑曲霉来源的GOD分子量为138 kDa,两个亚基的分子量约70 kDa。其最适pH为6.7,最适反应温度为30 ℃,max值为35.71 μmol/min,m值为35.74 mmol/L[4]。
目前研究的GOD主要来源于青霉菌或黑曲霉。在之前的报道中,在瑞氏木霉和产黄青霉中表达GOD,最终酶活分别为25 U/mL、11.45 U/mL和 17.2 U/mL[5-6]。Gu等[2]通过在毕赤酵母中共表达分子伴侣SEC53、CNE1和GCN4,使GOD酶活达到1 972.9 U/mL,基本达到工业生产的要求,这也是目前文献报道的最高酶活。
二硫键异构酶 (Protein disulfide isomerase,PDI)是内质网中含量最丰富的蛋白之一,主要催化氧化反应帮助蛋白形成正确的折叠结构而分泌到胞外,它可以明显提高异源蛋白在毕赤酵母中的表达。Li等[7]在毕赤酵母中过表达PDI使人白细胞蛋白酶抑制剂 (SLPI) 的产量提高5倍,SLPI的生物活性也有所提高。
毕赤酵母在高密度发酵时需要消耗大量氧气,溶氧水平直接影响异源蛋白的表达,因此透明颤菌来源的血红蛋白 (hemoglobin,VHb) 作为一种氧调节蛋白,可以结合游离氧,从而使发酵液中的氧含量提高[8]。Wang等[9]在毕赤酵母中过表达VHb蛋白,在低溶氧条件下,使耶罗维亚酵母脂肪酶 (YlLIP2) 产量比没有VHb蛋白时提高1.8倍,同时生物量也有明显提高。Wang等[10]在枯草杆菌中表达VHb使那他霉素的含量在1 L发酵罐中产量为8.2 g/L,比野生菌提高了131.3%。
在毕赤酵母表达系统中,甲醇的添加是外源蛋白表达的关键原因之一,但甲醇浓度过高对菌体产生毒害作用。混合碳源补料可在一定程度上补充碳源的不足,又可避免高浓度甲醇可能引起的毒害作用。山梨醇对醇氧化酶 (Alcohol oxidase,AOXI) 转录的抑制较弱,能减缓目标蛋白的胞外降解,降低有毒副产物的积累[11-12],现已逐渐成为毕赤酵母高密度发酵过程中最常用的辅助碳源。Ding等[13]通过甲醇/山梨醇混合流加控制溶氧的方式,使猪圆环病毒cap蛋白在10 L发酵罐中的产量提高至198 mg/L。
PDI和VHb能够提高外源蛋白的表达水平,但尚未见到在提高GOD表达水平方面的报道。本实验中,通过在受体菌X33/pPIC9k-GOD中整合分子伴侣蛋白PDI和VHb,提高GOD的表达,在高密度发酵过程中,利用甲醇/山梨醇混合碳源诱导的方式提高GOD的表达水平。
1 材料与方法
1.1 菌株和质粒
大肠杆菌克隆菌株T1购自全式金公司;酵母表达菌株X33购自Invitrogen;毕赤酵母工程菌X33/pPIC9k-GOD由实验室保存;VHb基因由南京金斯瑞公司合成。
1.2 方法
基因组提取、酶切、连接等常规分子生物学操作参照《分子克隆手册》[14]进行。
1.2.1 融合表达载体的构建
根据PDI基因序列设计寡核苷酸链,合成引物 (表1)。
表1 基因PCR扩增引物列表
Table 1 PCR primers of molecular
通过PCR技术利用引物P1和P2以毕赤酵母基因组为模板扩增出PDI基因序列,将PDI和VHb片段与pPICZ载体连接,构建质粒pPICZ-PDI和pPICZ-VHb。转化T1感受态细胞,获得正确的融合载体。将pPICZ-VHb利用引物P3和P4扩增出含有AOX启动子、VHb基因以及终止子区域的目的片段,与Ⅰ线性化的重组质粒pPICZ-PDI进行同源重组,采用Gibson连接方法,构建pPICZ-PDI-VHb。转化T1感受态细胞,挑取单克隆获得融合质粒。
1.2.2 阳性转化子的获得
将3个测序正确的重组质粒pPICZ-PDI、pPICZ-VHb、pPICZ-PDI-VHb进行Ⅰ线性化后分别电转X33/pPIC9k-GOD,构建菌株X33/pPIC9k- GOD/pPICZ-VHb、X33/pPIC9k-GOD/pPICZ-PDI、X33/pPIC9k-GOD/pPICZ-PDI-VHb,涂布在终浓度250 μg/mL G418和50 μg/mL Zeocin的YPD双抗平板上,获得阳性转化子。
1.2.3 重组蛋白的诱导表达和SDS–PAGE检测
培养基和诱导方法参照文献[15]。将重组菌株X33/pPIC9k-GOD和分别整合分子伴侣PDI、VHb、PDI-VHb的X33/pPIC9k-GOD菌株进行摇瓶诱导表达,收集上清测定酶活。
1.2.4 GOD酶活测定
GOD酶活测定方法参照文献[16]。
1个酶活力单位是指在37 ℃、pH 5.0条件下,在1 min内转化1 μmol葡萄糖生成1 μmol葡萄糖酸和H2O2所需的酶量。
1.2.5 Bradford法测定蛋白浓度
蛋白浓度测定方法参照文献[17]。
1.2.6 5 L发酵罐放大表达GOD
高密度发酵培养基参照文献[15]。等培养基中的甘油耗尽溶氧上升后,以18.15 mL/(h·l) 的速率流加含有1.2% () PTM1的50% () 甘油,待600到150–200时停止流加甘油,饥饿培养0.5–2 h,以5 g/(h·l) 的速率流加含有1.2% () PTM1的100%甲醇,用浓氨水 (28%) 控制pH为6.0,同时以 20∶1 (,甲醇∶山梨醇) 的速率流加山梨醇,调节搅拌转速和通气量控制溶氧在10%以上。
2 结果与分析
2.1 摇瓶水平检测分子伴侣对GOD表达影响
将X33/pPIC9k–GOD菌株作为对照菌株,与分别整合分子伴侣菌株X33/pPIC9k-GOD/pPICZ- PDI、X33/pPIC9k-GOD/pPICZ-VHb和X33/pPIC9k- GOD/pPICZ-PDI-VHb (图1) 按照上述条件进行摇瓶发酵。对照菌株酶活13 U/mL,整合VHb的GOD菌株酶活为18 U/mL,整合PDI的GOD菌株酶活为29 U/mL,同时整合VHb、PDI的GOD菌株酶活达到33 U/mL (图2)。图3可知,整合分子伴侣的菌株蛋白表达均较空白多,其中整合PDI-VHb菌株蛋白表达最多。
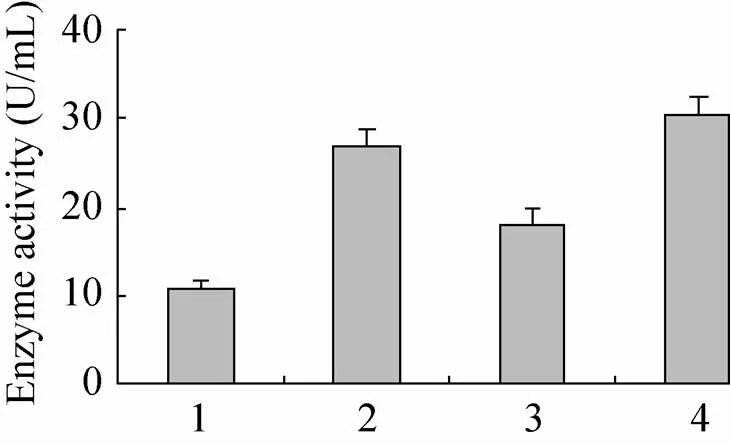
图2 共表达分子伴侣对GOD酶活的影响

图3 SDS-PAGE分析分子伴侣对GOD表达的影响
2.2 5 L发酵罐表达GOD
2.2.1 甲醇/山梨醇混合碳源诱导对GOD表达的影响
未来怎样通过合理的布局产品库存,采用不押款、零库存且相对较低的价格销售,减少农民投入,这不是农资行业一直要实现的事情吗?这些年,农资产品随着政策,市场的变化,探索者各式各样的销售方式,赊销是分销商最头疼的事情。
将对照菌株X33/pPIC9k-GOD按照上述条件采用甲醇流加与甲醇/山梨醇混合碳源流加的方式进行5 L高密度发酵。发酵上清进行SDS-PAGE分析 (图4),甲醇/山梨醇混合碳源流加能够提高GOD表达,但是同时也增加了杂蛋白的表达量。空白菌株采用甲醇诱导下罐酶活为384 U/mL (图5 B),蛋白浓度为3.2 g/L (图4 A);采用甲醇/山梨醇混合碳源流加下罐酶活为456 U/mL (图5 B),蛋白浓度为 5.1 g/L (图4 B)。酶活提高20%,蛋白浓度提高60%。
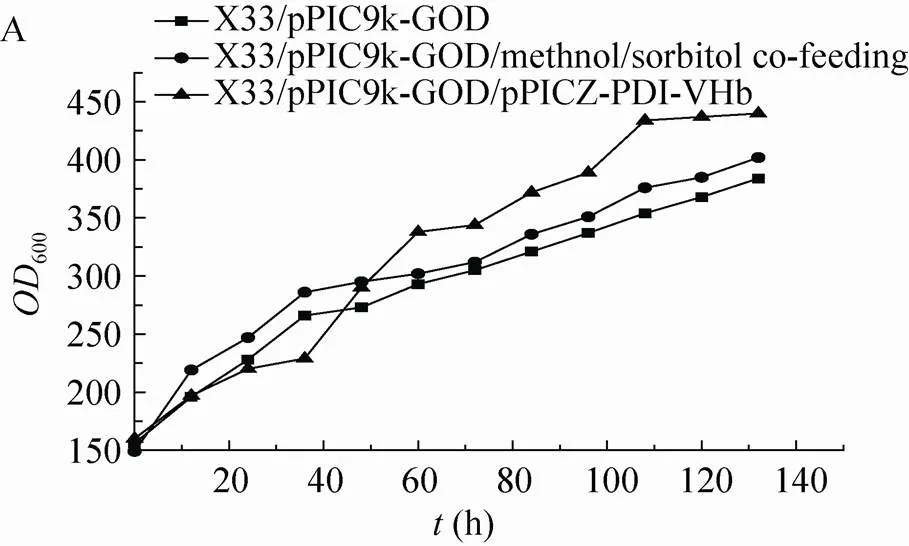
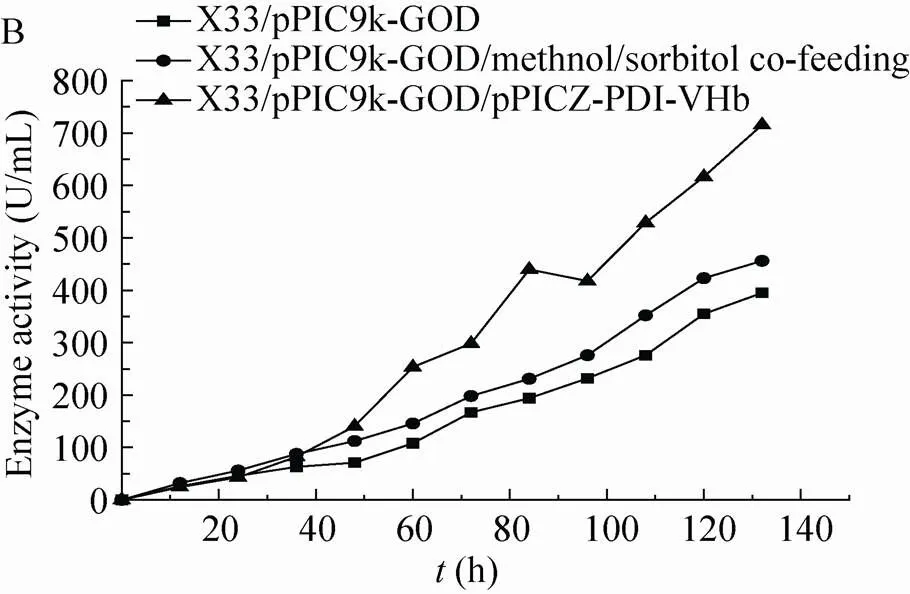
图5 甲醇诱导发酵GOD空白对照菌株、甲醇/山梨醇混合碳源诱导发酵GOD空白对照菌株和甲醇/山梨醇混合碳源诱导发酵共表达PDI-VHb菌株在5 L发酵罐中生物量 (A) 和酶活 (B) 分析
2.2.2 高密度发酵中分子伴侣对GOD表达的影响
将对照菌株X33/pPIC9k-GOD和整合伴侣蛋白的X33/pPIC9k-GOD/pPICZ-PDI-VHb菌株按甲醇/山梨醇混合碳源诱导方式进行5 L发酵罐放大培养。发酵液上清进行SDS–PAGE分析 (图4),整合分子伴侣的菌株蛋白表达量明显高于对照菌株。对照菌株下罐酶活为456 U/mL (图5 B),蛋白浓度为5.1 g/L (图4 B);整合伴侣蛋白GOD菌株下罐酶活达到 716 U/mL (图5B),蛋白浓度为7.4 g/L (图4 C)。酶活提高60%,蛋白浓度提高50%。共表达分子伴侣PDI和VHb可以明显提高GOD的表达水平。
3 讨论
毕赤酵母表达系统是一种成熟的外源蛋白表达系统,具有高水平的外源蛋白表达能力,分泌的重组蛋白有易于纯化及便于大规模发酵等优点,是异源表达GOD的最佳选择。本文在工程菌X33/pPIC9k-GOD中共表达分子伴侣PDI-VHb得到菌株X33/pPIC9k- GOD/pPICZ-PDI-VHb。在5 L发酵罐放大实验过程中,采用甲醇/山梨醇混合碳源诱导的策略,GOD最终酶活为456 U/mL,比甲醇诱导提高了20%;采用共表达伴侣蛋白PDI–VHb和甲醇/山梨醇诱导的混合策略,GOD最终酶活为716 U/mL,比对照菌株提高90%。这说明,分子伴侣PDI和VHb以及甲醇/山梨醇混合碳源诱导确实可以提高GOD的表达。
山梨醇是一种非抑制性碳源,山梨醇与甲醇共同诱导外源蛋白表达时,二者具有不同的代谢途径,山梨醇的加入可以缓解甲醇单独诱导表达能量不足的压力和甲醇积累造成细胞毒性的问题。在高密度发酵GOD过程中,甲醇/山梨醇混合碳源诱导方式能够提高GOD表达量,这与之前报道的结果一致。在毕赤酵母表达系统中,过表达PDI能够提高蛋白表达过程中二硫键的生成,过表达VHb蛋白能缓解细胞生长过程中溶氧的限制作用,还能增加高密度发酵过程中的生物量,这给目的产物与生物量正相关的发酵试验提供新思路。
本文通过整合分子伴侣促进蛋白正确折叠和甲醇/山梨醇混合碳源诱导明显地提高GOD蛋白表达,这为廉价生产GOD提供了新的方法。本实验室将继续探索其他的方法和策略,进一步提高葡萄糖氧化酶的表达水平,以满足其在饲料、检测和精细化工生产等领域的广泛应用。
REFERENCES
[1] Bankar SB, Bule MV, Singhal RS, et al. Glucose oxidase–an overview. Biotechnol Adv, 2009, 27(4): 489–501.
[2] Gu L, Zhang J, Du GC, et al. Multivariate modular engineering of the protein secretory pathway for production of heterologous glucose oxidase in. Enzyme Microb Technol, 2015, 68: 33–42.
[3] Pluschkell S, Hellmuth K, Rinas U. Kinetics of glucose oxidase excretion by recombinant. Biotechnol Bioeng, 1996, 51(2): 15–20.
[4] Wang ZX. Extraction and purification of glucose oxidase fromA9 and study on the properties of the enzyme [D]. Baoding: Agricultural University of Hebei Province, 2006 (in Chinese). 王志新. 黑曲霉葡萄糖氧化酶的提取纯化及其酶学性质研究 [D]. 保定: 河北农业大学, 2006.
[5] Mu JY, Wang Q, Yang CZ, et al. Recombinantglucose oxidase expressed in. Chin J Biotech, 2006, 22(1): 82–86 (in Chinese). 母敬郁, 王峤, 杨纯中, 等. 瑞氏木霉表达黑曲霉葡萄糖氧化酶. 生物工程学报, 2006, 22(1): 82–86.
[6] Wang ZY, Bie XM, Lv FX, et al. Optimization of medium components and fermentation condition for extracellular glucose oxidase production byA4. Sci Tech Food Industry, 2015, 36(16): 217–221 (in Chinese).王周圆, 别小妹, 吕凤霞, 等. 产黄青霉A4产胞外葡萄糖氧化酶发酵工艺优化. 食品工业科技, 2015, 36(16): 217–221.
[7] Li ZG, Allison M, Seth R G, et al. An improved method for enhanced production and biological activity of human secretory leukocyte protease inhibitor (SLPI) in. Biochem Biophys Res Commun, 2010, 402(3): 519–524.
[8] Wakabayashi S, Matsubara H, Webster DA. Primary sequence of a dimeric bacterial hemoglobin from. Nature, 1986, 322: 481–483.
[9] Wang XF, Sun YC, Shen XG, et al. Intracellular expression ofhemoglobin improves production oflipase LIP2 in a recombinant. Enzyme Microb Technol, 2012, 50(1): 22–28.
[10] Wang SH, Liu F, Hou ZW, et al. Enhancement of natamycin production onby chromosomal integration of thehemoglobin gene (vgb). World J Microbiol Biotechnol, 2014, 30(4): 1369–1376.
[11] Boze H, Celine L, Patrick C, et al. High-level secretory production of recombinant porcine follicle-stimulating hormone by. Process Biochem, 2001, 36(8/9): 907–913.
[12] Hellwig S, Emde F, Raven N P G, et al. Analysis of single-chain antibody production inusing on-line methanol control in fed-batch and mixed–feed fermentations. Biotechnol Bioeng, 2001, 74(4): 344–352.
[13] Ding J, Zhang CL, Gao MJ, et al. Enhanced porcine circovirus cap protein production bywith a fuzzy logic DO control based methanol/sorbitol co–feeding induction strategy. J Biotechnol, 2014, 177: 35–44.
[14] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2001.
[15] Wang ZC, Wang Y, Zhang DX, et al. Enhancement of cell viability and alkaline polygalacturonate lyase production by sorbitol co-feeding with methanol infermentation. Bioresource Technol, 2010, 101(4): 1318–1323.
[16] Bankar SB, Bule MV, Singhal RS, et al. Optimization offermentation for the production of glucose oxidase. Food Bioprocess Tech, 2009, 2(3): 44–52.
[17] Daniel MB, Michael DR, Stuart JE. Protein methods. 2nd ed. New York: Wiley Liss, 1996.
High-level production of glucose oxidase by recombinantusing a combined strategy
Qingxuan Mu1, Meirong Hu2, Fei Chen1, Xianzhang Jiang1, Yong Tao2, and Jianzhong Huang1
1 College of Life Sciences, Fujian Normal University, Fuzhou 350108, Fujian, China 2 Institute of Microbiology, Chinese Academy of Scienses, Beijing 100101, China
To enhance the production of glucose oxidase by recombinant, two strategies were developed, which were namely co-feeding of methanol and sorbitol and co-expressing of the protein disulfide isomerase (PDI) andhemoglobin (VHb). The volumetric activity reached 456 U/mL by using the strain X33/pPIC9k-GOD, in 5 liter fermentator, with the co-feeding of methanol and sorbitol, it was 0.2 fold higher than that only feeding by methanol. The improved strain was obtained by co-expressing PDI-VHb with GOD. While fermented in a 5 liter fermentator by feeding methanol and sorbitol, the activity of the improved strain reached 716 U/mL with a yield of 7 400 mg/L total soluble protein concentration. These results indicated that heterologous protein expression level can be enhanced by optimizing fermentation condition and co-expression molecular chaperon in.
,glucose oxidase, protein disulfide isomerase,hemoglobin, sorbitol
October 23, 2015; Accepted: January 8, 2016
生物育种与工艺优化
牟庆璇, 胡美荣, 陈飞, 等. 采用混合策略提高葡萄糖氧化酶在毕赤酵母中的表达水平. 生物工程学报, 2016, 32(7): 986–990.
Mu QX, Hu MR, Chen F, et al. High–level production of glucose oxidase by recombinantusing a combined strategy. Chin J Biotech, 2016, 32(7): 986–990
Supported by: Key Technologies of Industrialization Project in Fujian (No. [2010] 358).
Corresponding author: Jianzhong Huang. Tel: +86-591-22868212; E-mail: hjz@fjnu.edu.cn
福建省产业化关键技术项目 (No. 闽财指[2010]358号) 资助。
(本文责编 郝丽芳)

