调节性T细胞在小鼠肥胖早期的数量变化及其对内脏脂肪巨噬细胞亚型的调节作用
李 霞,汤晓涵,唐丽丽,俞海波,谢志国,周智广
中南大学湘雅二医院代谢内分泌科 中南大学糖尿病免疫学教育部重点实验室 国家代谢性疾病临床医学研究中心,长沙 410011
·论著·
调节性T细胞在小鼠肥胖早期的数量变化及其对内脏脂肪巨噬细胞亚型的调节作用
李霞,汤晓涵,唐丽丽,俞海波,谢志国,周智广
中南大学湘雅二医院代谢内分泌科中南大学糖尿病免疫学教育部重点实验室国家代谢性疾病临床医学研究中心,长沙 410011
目的探讨调节性T细胞(Tregs)在肥胖小鼠的变化及其对脂肪巨噬细胞的调节。方法建立C57BL/6小鼠的肥胖模型,分别在4、10和20周龄观察代谢指标,脾脏内Tregs和脂肪组织内M1/M2型巨噬细胞的数量。用雷帕霉素干预肥胖小鼠,观察其刺激Tregs后对代谢和脂肪炎症的影响。结果C57BL/6小鼠在20周龄时建成早期肥胖模型,肥胖组小鼠的附睾旁脂肪质量和瘦素水平显著高于对照组(P<0.05),但两组血糖和胰岛素水平差异均无统计学意义(P均>0.05),同时,肥胖小鼠脂肪巨噬细胞数量增加,而Tregs呈下降趋势。雷帕霉素干预可使脾脏内Tregs数量显著增加,且伴有代谢紊乱的改善和脂肪M1/M2比例降低。结论肥胖早期Tregs数量的下降可能与脂肪巨噬细胞的浸润及亚型分布异常有关。
肥胖;调节性T细胞;巨噬细胞;内脏脂肪组织
ActaAcadMedSin,2016,38(4):399-403
多项研究表明肥胖内脏脂肪组织的炎症与该部位巨噬细胞的数量以及M1/M2亚型分布有关。在正常饮食下,脂肪组织内巨噬细胞表现为M2型;而肥胖发生过程中,M2型转化为M1型,可诱导产生一氧化氮及肿瘤坏死因子α和白介素- 6等多种炎症介质,介导炎症反应和胰岛素抵抗[1]。除巨噬细胞外,T细胞,尤其调节性T细胞(regulatory T cells,Tregs)在肥胖中的作用日益受到关注。新近研究显示,Tregs,特别是内脏脂肪组织的“脂肪特异性Tregs”,在肥胖引起的炎症和胰岛素抵抗中发挥重要作用[2- 3]。本研究主要探讨在肥胖发生的早期阶段,Tregs在肥胖小鼠的变化及其对脂肪巨噬细胞亚型的调节作用。
材料和方法
实验动物C57BL/6小鼠购于湖南省斯莱克景达实验动物有限公司,4周,雄性,SPF级,按照随机数字表法分为正常饮食组和高脂饮食组,分别喂养至10周和20周时处死小鼠,取血清和附睾旁脂肪悬浮细胞液进行脂肪炎性指标的检测。高脂饮食组饲料购于广东省医学动物实验中心,含脂量60%,建立肥胖模型;小鼠饲养于中南大学湘雅二医院医学动物实验中心。
雷帕霉素干预将高脂喂养建立的肥胖小鼠按照随机数字表法分为雷帕霉素干预组和二甲基亚砜对照组。雷帕霉素购于上海生工生物技术公司(100 mg),将100 mg雷帕霉素溶于1 ml 二甲基亚砜制成母液,将母液用生理盐水制成1∶10的工作液,腹腔注射,20 mg/(kg·d),共干预27 d。
内脏脂肪细胞的分离附睾旁脂肪组织取出置于含磷酸盐缓冲液的培养皿中,加入Ⅱ型胶原酶,放入37℃水浴30 min,离心(4℃,转子半径11.5 cm,1 500 r/min,5 min),弃上层脂肪组织,用磷酸盐缓冲液重复清洗3遍后,用磷酸盐缓冲液重悬细胞,将悬浮细胞用于后续实验。
血清瘦素水平的测定血清瘦素采用ELISA方法检测(Millipore),严格按照试剂盒说明书操作分析。
巨噬细胞亚型、Treg细胞在内脏脂肪组织内的浸润采用流式细胞仪检测,巨噬细胞流式抗体如下:别藻蓝蛋白抗鼠 F4/80,多甲藻叶绿素蛋白抗鼠 CD11c,异硫氰酸荧光素抗鼠 CD11b,Treg细胞流式抗体如下:藻红蛋白/青色素染料7 抗鼠 CD4;亚历克萨荧光素488 抗鼠 CD25;藻红蛋白抗鼠/大鼠/人叉头蛋白3,流式抗体及流式细胞仪均购于美国Biolengend公司。将F4/80+CD11b+CD11c+定义为M1巨噬细胞,将F4/80+CD11b+CD11c-定义为M2巨噬细胞。将CD4+CD25+Foxp3+定义为Treg细胞。
单核细胞趋化蛋白- 1 mRNA的测定取内脏脂肪组织,Trizol法提取总RNA,逆转录合成cDNA。单核细胞趋化蛋白- 1引物在上海生工生物工程股份有限公司合成,引物序列如下: 5’-CACTCACCTGCTGCTACTCAT-3’;5’-CTACAGCTTCTTTGGGACACC-3’。采用实时荧光定量PCR反应,设置ABI PRISM 7000 荧光定量PCR仪,进行两步法PCR扩增,扩增结束后,制作反应溶解曲线,PCR产物特异性在溶解曲线图中表现呈单一且尖锐的波峰。以2-△△Ct值计算目的基因的相对表达量。
统计学处理应用SPSS 17.0统计软件进行统计学分析,符合正态分布的计量资料用均数±标准差表示,计数资料用构成比或率表示。各组数据比较前先进行方差齐性检验,符合正态分布和方差齐性时用单因素方差分析(ONE-WAY ANOVA)。不满足方差齐性、正态分布采用非参数检验。P<0.05为差异有统计学意义。
结 果
高脂喂养肥胖小鼠模型的建立与正常饮食组小鼠相比,高脂喂养10周和20周小鼠的体重、附睾旁脂肪质量,附睾旁脂肪质量所占体重比、血清瘦素水平均显著增加(P<0.05)(图1)。
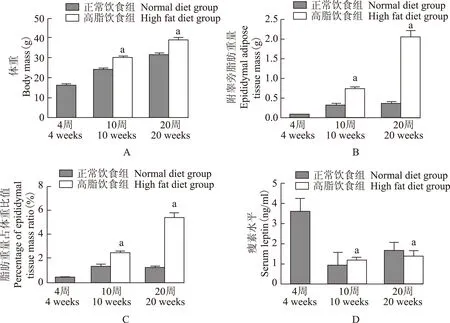
与正常饮食组比较,aP<0.05
aP<0.05 compared with the normal diet group
图 1正常饮食组和高脂饮食组10周、20周时体重(A)、附睾旁脂肪质量(B)、脂肪质量占体重比值(C)、瘦素(D)水平的比较
Fig 1The comparisons of body mass(A),epididymal adipose tissue mass(B),percentage of epididymal tissue mass ratio(C),serum leptin(D) in 10 weeks and 20 weeks between normal diet group and high fat diet group
高脂饮食对小鼠血糖、血清胰岛素水平及胰岛素抵抗指数的影响与对照组相比,高脂饮食组小鼠在20周龄时的血糖[(8.8±0.33)mmol/L 比(9.3±1.92)mmol/L,P=0.62]和血清胰岛素水平[(1.65±0.86) ng/ml 比(1.39±0.64) ng/ml,P=0.94]以及胰岛素抵抗指数(0.64±0.33比0.58±0.27,P=0.78)差异均无统计学意义,高脂饮食组未发生糖尿病以及胰岛素抵抗,提示此模型处于无胰岛素抵抗的肥胖早期阶段。
高脂饮食对小鼠脾脏Treg数量及脂肪组织巨噬细胞比例的影响高脂饮食组小鼠体内Treg细胞占CD4+T细胞的比例在4、10和20周龄分别为(6.40±0.28)%、(4.93±0.71)%和(4.73±3.66)%,各组间比较差异无统计学意义(P均>0.05)(图2A)。与正常饮食组相比,高脂饮食组小鼠脂肪组织巨噬细胞比例在10周龄[(3.28±2.90)% 比(8.36±7.54)%,P=0.20)]和20周龄[(16.85±6.60)% 比(21.15±11.22)%,P=0.53]差异均无统计学意义(图2B)。20周时,高脂饮食组与正常饮食组相比,M1/M2巨噬细胞比例有升高的趋势,但差异无统计学意义(0.62±0.17 比 0.83±0.15,P=0.11)(图2C)。附睾旁脂肪组织内巨噬细胞趋化因子单核细胞趋化蛋白- 1 mRNA表达水平在高脂喂养20周时明显增加(1.50±0.82比10.96±6.24,P<0.05)(图2D)。
雷帕霉素干预对高脂喂养小鼠的影响腹腔内注射雷帕霉素27 d后,高脂饮食小鼠脾脏内Treg细胞占CD4+T细胞的比例从(3.22±0.41)%增加到(15.30±4.10)%。雷帕霉素刺激Treg干预后,干预组体重(27.08±0.79) g相对于对照组体重(38.00±4.74)g明显下降(P<0.05)(图3),附睾旁脂肪质量[(0.96±0.09) g 比(2.05±0.52) g,P<0.05]、血清瘦素水平[(2.14±0.86)ng/ml 比(13.90±2.56) ng/ml,P<0.05]和血糖[(8.15±0.91)mmol/L 比(12.15±0.47)mmol/L,P<0.05]均显著下降。雷帕霉素干预对附睾旁脂肪组织巨噬细胞的数量无影响(22.2±4.95比26.87±15.65,P=0.59),但干预组附睾旁脂肪组织M1/M2巨噬细胞比例由0.98下降至0.48。
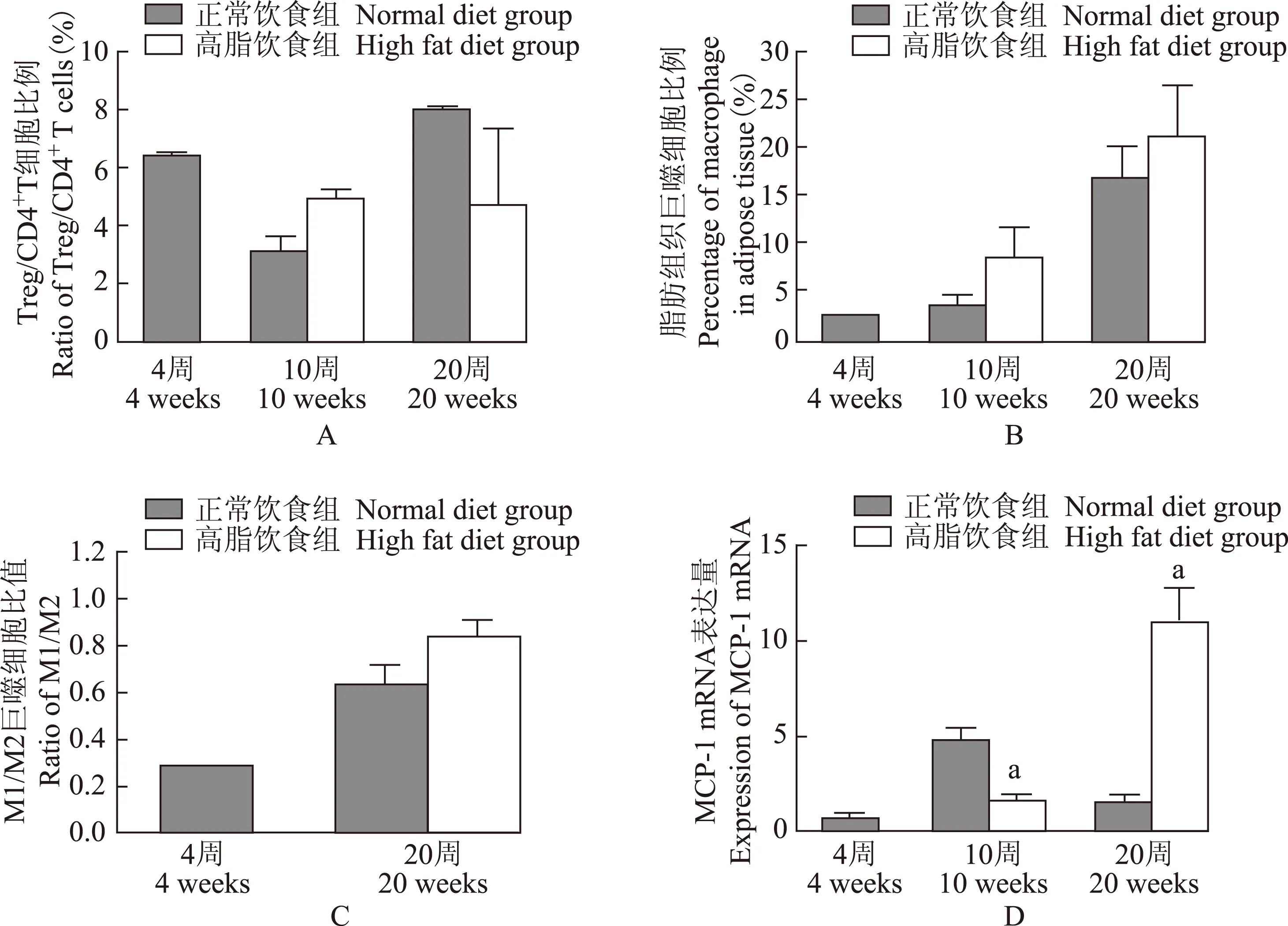
Treg:调节性T细胞;MCP- 1:单核细胞趋化蛋白- 1;与正常饮食组相比,aP<0.05
Treg:regulatory T cell;MCP- 1:monocyte chemoattractant protein- 1;aP<0.05 compared with the normal diet group
图 2正常饮食组和高脂饮食组10周、20周时Treg/CD4+T细胞比例(A)、脂肪组织巨噬细胞比例(B)、MCP- 1 mRNA表达(D)的比较以及两组20周时M1/M2巨噬细胞比例(C)的比较
Fig 2The comparisons of ratio of Treg/CD4+T cells(A),percentage of macrophage in adipose tissue(B),and MCP- 1 mRNA expression(D) in 10 weeks and 20 weeks and the comparison of ratio of M1/M2 in 20 weeks(C) between normal diet group and high fat diet group
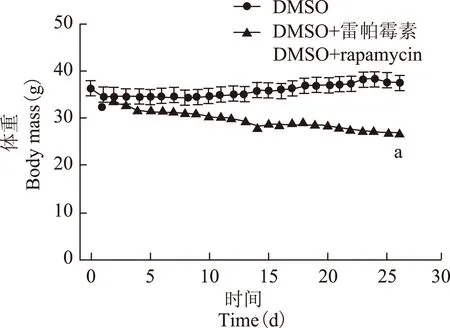
DMSO:二甲基亚砜;与DMSO组比较,aP<0.05
DMSO:dimethylsulfoxide;aP<0.05 compared with DMSO group
图 3雷帕霉素干预高脂饮食肥胖小鼠的体重变化
Fig 3Change in body mass in high fat diet group under rapamycin intervention
讨 论
肥胖患者的脂肪组织内巨噬细胞数量增加,且内脏网膜内脂肪组织巨噬细胞数量增加明显多于皮下脂肪组织[4],提示内脏脂肪组织巨噬细胞与肥胖发生密切相关[5- 6]。除巨噬细胞等天然免疫细胞引起的脂肪组织炎症浸润外,新近研究显示CD8+T细胞、CD4+T细胞、Treg细胞、B细胞等通过与其他免疫炎症细胞相互作用或直接参与内脏脂肪炎症的发生发展[7]。研究显示在高脂喂养肥胖小鼠脂肪组织中CD8+效应性T细胞浸润增加,而CD4+T细胞和Treg细胞则减少[8]。
研究表明内脏脂肪组织内Treg细胞数量及功能缺陷在肥胖导致炎症、胰岛素抵抗的过程中发挥重要的作用。内脏脂肪Tregs与胰岛素抵抗呈负相关,用白介素- 2/抗白介素- 2复合物体内刺激Tregs增殖能改善肥胖小鼠的胰岛素敏感性[9]。相反,用白喉毒素消除小鼠体内Tregs可损害脂肪组织、肌肉、肝脏的胰岛素信号通路,导致胰岛素抵抗[2]。
在肥胖的早期阶段,肥胖小鼠脾脏Tregs的改变如何以及通过对Tregs的干预能否改善内脏脂肪巨噬细胞的浸润和亚型分布目前均不清楚。本研究显示,在肥胖的早期阶段,脾脏的Tregs呈下降趋势,伴随着巨噬细胞的浸润,高脂饮食组小鼠的脾脏Tregs比例从基线的6.40%下降至4.73%。用雷帕霉素增加小鼠体内Tregs的数量,从3.22%增加至15.30%后,干预组的体重、附睾旁脂肪质量、血清瘦素水平、血糖水平均呈显著性下降,同时伴有干预组附睾旁脂肪组织M1/M2巨噬细胞比例的改善。增加Tregs可以改善肥胖和巨噬细胞亚型分布,提示脂肪组织T淋巴细胞改变是肥胖进展过程中更早期事件,Tregs的下降可能更早于巨噬细胞的浸润,而且Tregs可能具有调节巨噬细胞亚型分布的作用。
Eller等[10]使用抗CD25分子抗体诱导产生Tregs缺陷小鼠,结果显示其内脏脂肪组织炎症反应和胰岛素抵抗水平均增高,且增高的程度与Tregs的减少程度呈正相关。而Ilan等[11]则通过向Tregs缺陷小鼠体内过继转移Tregs,证明其具有抑制脂肪组织炎症、改善胰岛素抵抗的作用。循环中Tregs改变对巨噬细胞的影响目前尚不清楚。Cipolletta等[12]和Odegaard等[13]对巨噬细胞特异性敲除过氧化物酶体增殖物激活受体γ的研究显示Tregs可能通过调节过氧化物酶体增殖物激活受体γ使脂肪组织内M2型巨噬细胞的浸润以及逆转肥胖者巨噬细胞M2向M1转化,改善内脏脂肪组织的慢性炎性浸润。Matarese等[14]研究显示,瘦素是对Tregs作用进行调节的上游因子,Tregs能够表达其受体,接受其对自身增殖及免疫抑制作用的负性调节。在体和体外研究均表明,瘦素分子的慢性缺乏或其受体的作用缺陷可以造成Tregs数目、比例以及免疫抑制功能的显著提高[15]。但具体机制尚待进一步研究。
本研究所用的实验小鼠为无胰岛素抵抗的早期肥胖模型,为探讨肥胖的早期炎症事件提供了条件。本研究提示在肥胖状态下,脂肪组织中天然免疫和获得性免疫细胞通过复杂的相互作用共同导致胰岛素抵抗与糖尿病的发生,应该更加重视获得性免疫在肥胖早期发生中的作用,也为免疫干预肥胖提供了思路。
[1]Morris DL,Singer K,Lumeng CN.Adipose tissue macrophages: phenotypic plasticity and diversity in lean and obese states[J].Curr Opin Clin Nutr Metab Care,2011,14(4):341- 346.
[2]Feuerer M,Herrero L,Cipolletta D,et al. Lean,but not obese,fat is enriched for a unique population of regulatory T cells that affect metabolic parameters[J]. Nat Med,2009,15(8):930- 939.
[3]Dinh TN,Kyaw TS,Kanellakis P,et al.Cytokine therapy with interleukin-2/anti-interleukin-2 monoclonal antibody complexes expands CD4+CD25+Foxp3+regulatory T cells and attenuates development and progression of atherosclerosis[J]. Circulation,2012,126(10): 1256- 1266.
[4]Cancello R,Tordjman J,Poitou C,et al.Increased infiltration of macrophages in omental adipose tissue is associated with marked hepatic lesions in morbid human obesity[J]. Diabetes,2006,55(6):1554- 1561.
[5]Cinti S,Mitchell G,Barbatelli G,et al. Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans[J]. J Lipid Res,2005,46(11):2347- 2355.
[6]McNelis J,Olefsky J. Macrophages,immunity,and metabolic disease [J]. Immunity,2014,41(1):36- 48.
[7]Kosteli A,Sugaru E,Haemmerle G,et al. Weight loss and lipolysis promote a dynamic immune response in murine adipose tissue[J]. J Clin Invest,2010,120(10):3466- 3479.
[8]Leea BC,Lee J.Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance[J].Biochim Biophys Acta,2014,1842(3):446- 462.
[9]Cipolletta D,Kolodin D,Benoist C,et al. Tissular T(regs): a unique population of adipose-tissue-resident Foxp3+CD4+T cells that impacts organismal metabolism[J]. Semin Immunol,2011,23(6):431- 437.
[10]Eller K,Kirsch A,Wolf AM,et al. Potential role of regulatory T cells in reversing obesity-linked insulin resistance and diabetic nephropathy[J]. Diabetes,2011,60(11):2954- 2962.
[11]Ilan Y,Maron R,Tukpah AM,et al. Induction of regulatory T cells decreases adipose inflammation and alleviates insulin resistance in ob/obmice[J]. Proc Natl Acad Sci USA,2010,107(21):9765- 9770.
[12]Cipolletta D,Feuerer M,Li A,et al. PPAR-gamma is a major driver of the accumulation and phenotype of adipose tissue Treg cells[J]. Nature,2012,486(7404):549- 553.
[13]Odegaard JI,Ricardo-Gonzalez RR,Goforth MH,et al. Macrophage-specific PPAR gamma controls alternative activation and improves insulin resistance[J]. Nature,2007,447(7148):1116- 1120.
[14]Matarese G,Carrieri PB,La Cava A,et al. Leptin increase in multiple sclerosis associates with reduced number of CD4(+)CD25+regulatory T cells[J]. Proc Natl Acad Sci USA,2005,102(14):5150- 5155.
[15]Matarese G,Procaccini C,De Rosa V,et al.Regulatory T cells in obesity: the leptin connection[J].Trends Mol Med,2010,16(6):247- 256.
Changes of Regulatory T Cells in the Early Stage of Obesity Mice and Their Modulation on Macrophage Subtypes in Visceral Adipose Tissue
LI Xia,TANG Xiao-han,TANG Li-li,YU Hai-bo,XIE Zhi-guo,ZHOU Zhi-guang
Department of Metabolism and Endocrinology,the Second Xiangya Hospital,Central South University,Key Laboratory of Diabetes Immunology,Ministry of Education,Central South University,National Clinical Research Center for Metabolic Diseases,Changsha 410011,China
ZHOU Zhi-guangTel: 0731- 85292154,E-mail: zhouzg@hotmail.com
ObjectiveTo investigate the changes of regulatory T cells (Tregs) and whether Tregs can modulate the distribution of macrophage subtypes in visceral adipose tissue in the early stage of obesity.MethodsAfter C57BL/6 mice obesity models were successfully established,metabolic parameters and numbers of Tregs and M1/M2 macrophage were measured at 4,10,and 20 weeks.The changes of metabolic parameters and adipose tissue inflammation in obesity mice after rapamycin intervention were evaluated. ResultsThe early-stage obesity models were successfully established.Compared with normal diet mice,high fat diet mice had significantly higher epididymal adipose tissue mass and serum leptin levels(P<0.05).However,there was no statistical difference in blood glucose and insulin levels between these two groups(AllP>0.05). Macrophages infiltration in adipose tissue in high fat diet mice gradually increased with time,coincident with decrease in Treg numbers. Increased numbers of Treg,improved metabolic parameters,and decreased ratio of M1/M2 can be seen after rapamycin intervention in mice.ConclusionThe decrease of Tregs in the early stage of obesity may contribute to abnormal distribution of macrophage subtypes in visceral adipose.
obesity;regulatory T cells;macrophages;visceral adipose tissue
国家自然科学基金(81070672)Supported by the National Natural Sciences Foundation of China(81070672)
周智广电话:0731- 85292154,电子邮件:zhouzg@hotmail.com
R589.2
A
1000- 503X(2016)04- 0399- 05
10.3881/j.issn.1000- 503X.2016.04.006
2015- 08- 07)
——雷帕霉素

