miR-143抑制胃癌细胞SGC7901增殖与迁移的机制研究
王欣怡 张海洋 李爽 宁涛 张乐 段晶晶 曲彦军 司怡然 王艺 应国光 巴一
miR-143抑制胃癌细胞SGC7901增殖与迁移的机制研究
王欣怡①张海洋①李爽①宁涛①张乐①段晶晶①曲彦军①司怡然①王艺①应国光②巴一①
目的:探究微小核糖核酸(microRNA,miRNA)-143在胃癌细胞增殖与迁移中的作用与机制。方法:三对肿瘤组织及配对正常组织选自2015年1月至2015年5月天津医科大学肿瘤医院行胃癌根治术的患者,所有患者术前均未予任何放化疗,肿瘤组织病理检测证实均为中分化胃腺癌,癌旁正常组织未见癌细胞浸润。采用Western blot检测胃癌、癌旁正常组织和SGC7901胃癌细胞中鸟成红细胞增多症癌基因-3(avian erythroblastosis oncogene B-3,ERBB3)的蛋白表达水平,逆转录定量聚合酶链式反应(reverse transcription quantitative polymerase chain reaction,RT-qPCR)检测ERBB3 mRNA和miR-143的表达水平,生物信息学软件预测miR-143的靶基因,荧光素酶报告基因实验验证靶基因,Transwell迁移实验和EdU增殖实验分别检测用miR-143 mimics/ inhibitor/NC mimics/inhibitor转染SGC7901细胞后对其迁移和增殖能力的影响。结果:与癌旁正常组织相比,胃癌组织ERBB3蛋白表达水平明显上升,mRNA水平升高差异远不及蛋白显著,miR-143表达水平显著下降;生物信息学软件预测ERBB3 mRNA的3'非翻译区(untranslated regions,UTR)有1个miR-143的结合位点,荧光素酶报告基因实验证实靶点存在;体外实验通过细胞转染上调miR-143后ERBB3蛋白表达水平明显下降,而下调miR-143后明显升高;Transwell迁移实验和EdU增殖实验分别显示miR-143过表达后细胞迁移和增殖能力显著减弱,而下调miR-143后显著增强。结论:miR-143可通过抑制ERBB3的表达抑制胃癌细胞的增殖与迁移。
胃癌miR-143ERBB3 增殖迁移
胃癌是最常见的恶性肿瘤之一,最新流行病学调查表明胃癌在中国的发病率位居第二,死亡率位居第四[1]。目前,根治性手术仍是治疗胃癌的主要手段,但胃癌早期症状缺乏特异性,很多患者确诊时已属晚期,且在行根治性手术治疗后仍有50%的患者出现复发或转移[2]。而对于胃癌尤其是晚期胃癌患者,化疗后其无病生存期(disease free survival,DFS)和中位生存时间(median survival time,MST)均较短,效果不佳[3]。近年来,随着对肿瘤细胞信号通路的研究,肿瘤靶向治疗的发展日新月异,但现阶段针对胃癌的有效靶点仍有限[4-6],因此进一步探索新的靶点意义重大。作为ErbB家族四成员之一[7-8],红细胞增多症癌基因-3(avian erythroblastosis oncogene B-3,ERBB3)在多种恶性肿瘤中呈高表达,包括乳腺癌、胃癌、结直肠癌、非小细胞肺癌(non-small cell lung cancer,NSCLC)等[9-11],提示其参与多种肿瘤的形成过程。微小核糖核酸(microRNA,miRNA)是一类保守的非编码小分子RNA,通过和靶基因mRNA碱基配对引导沉默复合体降解mRNA或阻碍其翻译。研究表明,miRNA参与细胞增殖、凋亡、代谢、激素分泌和免疫应答等多个生物学过程[12-14],并与多种肿瘤的发生发展机制相关[15],在众多下调的miRNA中,生物信息学软件预测miR-143是靶基因ERBB3下游的1个潜在调控因子。本研究旨在探究miR-143对于胃癌细胞增殖与迁移能力的作用与机制。
1 材料与方法
1.1实验材料
1.1.1组织标本三对肿瘤组织及配对正常组织选自2015年1月至2015年5月天津医科大学肿瘤医院行胃癌根治术的患者,所有患者术前均未予任何放化疗治疗,肿瘤组织病理检测证实均为中分化胃腺癌,癌旁正常组织未见癌细胞浸润。本研究所有标本的采集和使用均征得患者或其家属知情同意及符合人体试验委员会所制定的伦理学标准并得到伦理委员会批准。
1.1.2细胞系中分化胃癌细胞系SGC7901由天津医科大学肿瘤医院肿瘤细胞生物学实验室保存。
1.1.3主要试剂DMEM培液、胎牛血清(fetal bovine serum,FBS)(购自美国Gibco公司),miR-143 mimics/inhibitor/NC mimics/inhibitor、EdU试剂盒(购自广州市锐博生物科技有限公司),LipofectamineTM2000、Trizol、荧光素酶检测试剂盒(购自美国Invitrogen公司),逆转录试剂盒(购自大连Takara公司),Taqman miRNA探针、SYBR Green染料(购自美国Applied Biosystems公司),引物(购自苏州GENEWIZ公司),Anti-ERBB3、Anti-GAPDH、羊抗鼠IgG-HRP、羊抗兔IgG-HRP(购自上海Santa Cruz Biotechnology公司),Transwell小室(8 μm)(购自美国Corning公司)。
1.2方法
1.2.1细胞培养与转染SGC7901细胞在含10% FBS、1%双抗的DMEM中,于37℃、5%CO2培养箱培养。转染前按需铺种细胞于6、12、24孔板中,转天待细胞汇合度达50%时分别转染miR-143 mimics/inhibitor/NC mimics/inhibitor,于4~6 h后更换全培液。
1.2.2蛋白提取及Western blot使用裂解液(1.1× SDS lysis buffer,含蛋白酶抑制剂)于冰上提取蛋白,恒压100 V电泳,恒流250 mA冰浴中转膜3 h,2% BSA封闭1 h,后4℃摇床分别孵育一抗Anti-ERBB3、Anti-GAPDH过夜,次日TBST洗膜后分别孵育二抗羊抗鼠IgG-HRP、羊抗兔IgG-HRP 1 h,再次TBST洗膜后,曝光,并用ImageJ进行灰度分析。
1.2.3RNA的提取与定量检测采用Trizol法提取总RNA,-80℃待用。定量检测mRNA采用染料法:以Oligo d(T)为引物,按照16℃30 min、42℃30 min、85℃5 min进行逆转录,后以SYBR Green法依95℃10 min,95℃15 s、60℃60 s40个循环进行逆转录定量聚合酶链式反应(reverse transcription quantitative polymerase chain reaction,RT-qPCR),然后对PCR产物进行溶解曲线分析,采用ΔCT法计算mRNA表达量。miRNA采用探针法:按16℃15 min、42℃1 h、85℃5min进行逆转录,95℃5min,95℃15s、60℃1min 40个循环进行RT-qPCR,定量分析。
1.2.4荧光素酶报告基因实验铺6孔板,次日用LipofectamineTM2000将1 μg野生型/突变型荧光素酶报告基因质粒、1 μg β-半乳糖苷酶表达质粒与100 pmoL miR-143 mimics/inhibitor/NC mimics/inhibitor共转染,4~6 h后换液。24 h后利用荧光素酶试剂盒检测各孔中荧光素酶的表达量,并用β半乳糖苷酶表达量进行矫正。
1.2.5Transwell迁移实验铺6孔板,次日转染,24 h后计数,于24孔板中加入600 μL全培液,小室内铺100 000细胞/孔,并补加空培养液至200 μL,设3个复孔。24 h后,PBS拭去上室细胞,依次于甲醇中固定20 min、染液A(染细胞质)15 min、染液B(染细胞核)10 min,后PBS洗净,切下底部的膜置于载玻片上,拍照。计数每个视野细胞数。
1.2.6EdU增殖实验铺24孔板,次日转染,24 h后按1 000:1稀释EdU试剂A,500 μL/孔加至24孔板,4~6 h后经PBS清洗,后按说明书步骤完成操作,于荧光显微镜下在RFP及DAPI通道分别采集图像,并进行Merge及统计学分析。
1.3统计学分析
采用SPSS 20.0软件进行统计学分析。体外计量数据用±s描述,实验组与对照组间数据的比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1胃癌组织中ERBB3蛋白高表达且miR-143低表达
2.1.1胃癌组织中ERBB3的表达分析提取胃癌及配对癌旁正常组织中的蛋白质及总RNA,检测其中ERBB3蛋白和mRNA的表达情况。Western blot及其灰度分析显示,胃癌组织与癌旁正常组织相比ERBB3蛋白表达水平明显上升4倍,RT-qPCR显示与正常组织相比胃癌组织中ERBB3 mRNA水平升高约1.5倍,差异远不及蛋白显著,以上结果说明在胃癌组织中可能有某种转录后调控机制影响ERBB3的蛋白表达水平(图1)。
2.1.2靶点检测基于miRNA转录后调控机制,推测miRNA可能在ERBB3的转录后调控中发挥重要作用。利用生物信息学软件进行分析,TargetScan、PicTar和miRanda软件预测结果如图1显示,在ERBB3 mRNA的3'非翻译区(untranslated regions,UTR)有1个miR-143的结合靶点,但二者间的作用机制需进一步实验验证。
2.1.3胃癌组织中miR-143的表达分析生物信息学软件筛选出ERBB3可能为miR-143的靶基因,利用RT-qPCR检测胃癌及配对癌旁正常组织中miR-143的表达量,胃癌组织中miR-143的表达水平较正常组织显著下降,达0.5倍以上(图1)。
2.2荧光素酶报告基因实验证实ERBB3是miR-143的靶基因
为直接证明ERBB3 mRNA的3'UTR区存在miR-143的结合位点,利用荧光素酶报告基因实验予以验证。在野生型中,与转染对照类似物相比,转染miR-143类似物组的荧光素酶表达量明显下降,而转染miR-143抑制剂组的荧光素酶表达量明显上升;当ERBB3 mRNA 3'UTR区的相应位点突变后,miR-143不再影响荧光素酶的表达量(图2)。即证实miR-143可以直接与ERBB3 mRNA 3'UTR区的特定位点以碱基互补配对方式结合,其序列在种属间高度保守,且其相互作用的亲和力较高。
2.3miR-143过表达可抑制其靶基因ERBB3的表达
实验选择miR-143低表达的SGC7901细胞系作为研究对象,通过转染实现miR-143的上调或下调进行体外细胞实验。Western blot结果显示,miR-143过表达后,ERBB3的蛋白表达水平明显下降;而下调miR-143后ERBB3的蛋白水平明显升高,灰度分析显示该差异具有统计学意义(图2)。
2.4miR-143过表达可抑制胃癌细胞的迁移能力
Transwell迁移实验结果显示,miR-143过表达后,穿出细胞数减少,迁移能力显著减弱;而下调miR-143后穿出细胞数增多,迁移能力显著增强。定量分析差异具有统计学意义(图3)。
2.5miR-143过表达可抑制胃癌细胞的增殖
EdU增殖实验荧光图像显示,miR-143高表达的胃癌细胞的增殖受到明显抑制,miR-143降表达后显著促进胃癌细胞的增殖。定量分析差异具有统计学意义(图4)。
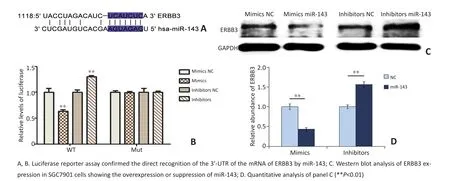
图2 miR-143直接负向调控ERBB3的表达Figure 2 Identification of ERBB3 as a direct target of miR-143
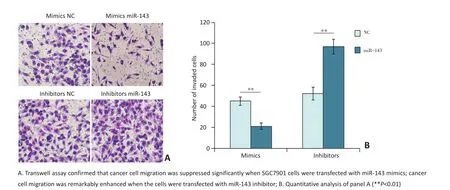
图3 miR-143抑制胃癌细胞的迁移Figure 3 miR-143 suppressed the migration of SGC7901 cells
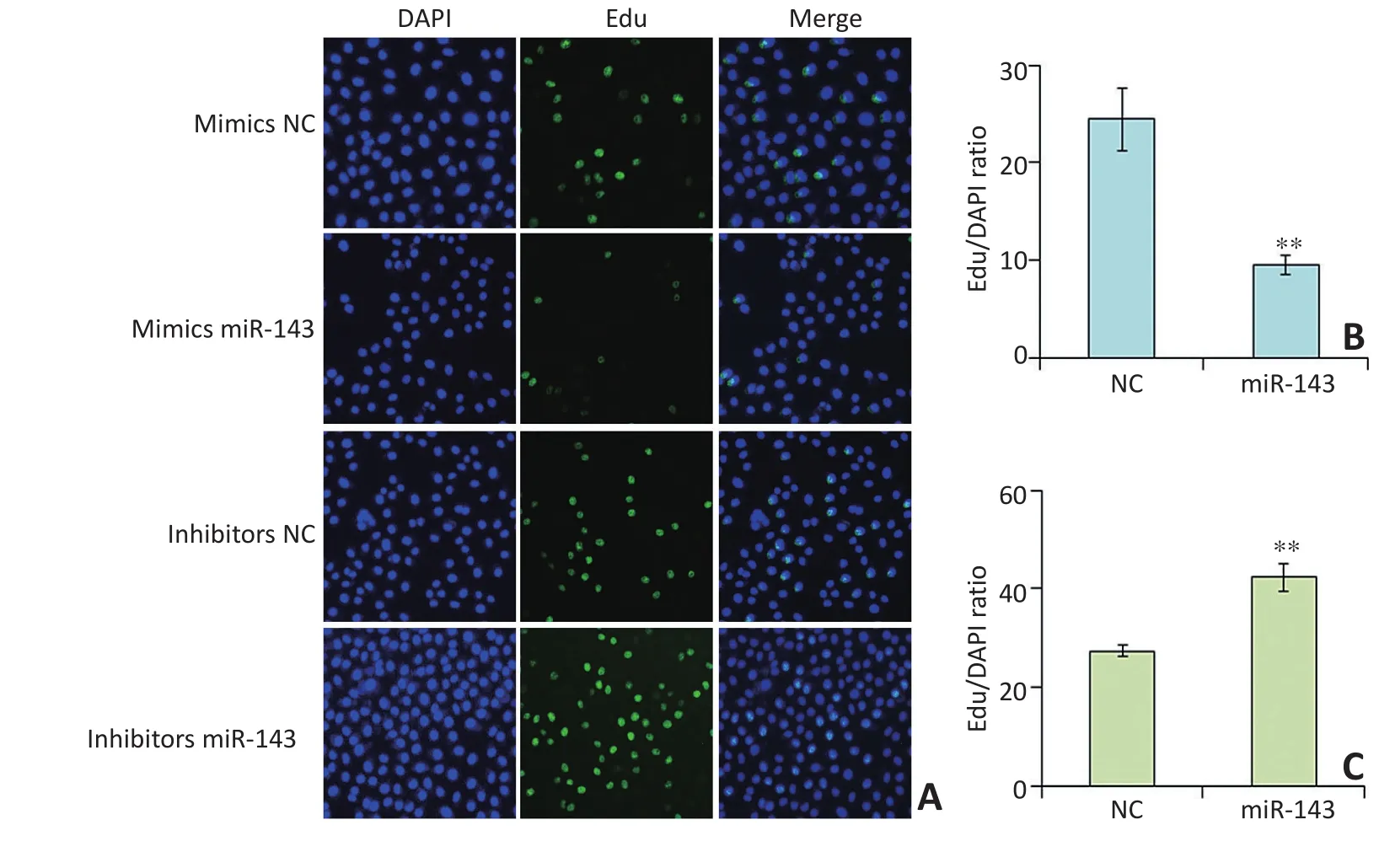
图4 miR-143抑制胃癌细胞的增殖Figure 4 miR-143 suppressed the proliferation of SGC7901 cells
3 讨论
研究表明,胃癌的发生发展是一个涉及遗传和环境等多种因素,历经多步骤变化的复杂过程[16],其中遗传因素包括多种癌基因与抑癌基因的突变和异常表达,但具体机制尚不明确。近年来随着精准医学的提出,靶向治疗快速发展,其中ErbB家族在肿瘤形成过程中发挥着重要作用。其中ERBB3作为该家族四成员之一,通过结合ErbB受体的胞外结构域形成同源或异源二聚体,激活酪氨酸激酶介导的受体胞浆区的自身磷酸化,进而聚集下游效应蛋白激活多条信号通路[7-8],成为一个重要的潜在治疗靶点[17]。与正常组织相比,ERBB3在多种恶性肿瘤中呈现高表达[9-11],提示其参与多种肿瘤的形成过程。自第1 个miRNA被发现以来,其作用在被不断深入探索,众多miRNA不仅参与调控机体的正常生理活动,还与多种肿瘤的发生发展有关[18-19]。研究发现,miR-143的低表达与胃癌、结直肠癌、膀胱癌、宫颈癌等多种恶性肿瘤的发生、侵袭与转移密切相关[20-23]。鉴于ERBB3和miR-143在肿瘤特别是胃癌中均发挥着重要作用,而二者在胃癌中的具体作用机制尚未见报道,故本研究miR-143-ERBB3通路在胃癌中的调节作用,为胃癌治疗靶点的筛选提供线索。实验发现miR-143可以通过抑制ERBB3的表达抑制肿瘤细胞的增殖与迁移,miR-143-ERBB3信号通路在胃癌发病中可能发挥着重要作用,可作为指导临床治疗的潜在靶点。虽然胃癌异质性强,化疗效果不佳,但靶向治疗仍前景广阔,对于miR-143-ERBB3通路的研究也还需深入,未来可进一步探索利用载体运输anti-miR-143进行肿瘤治疗的有效性与可行性。
[1]Allemani C,Weir HK,Carreira H,et al.Global surveillance of cancer survival 1995-2009:analysis of individual data for 25 676 887 patients from 279 population-based registries in 67 countries(CONCORD-2)[J].Lancet,2015,385(9972):977-1010.
[2] Vivian,Yvonne,Shinl.MiRNA as potential biomarkers and therapeutic targets for gastric cancer[J].World J Gastroenterol,2014,20 (30):10432-10439.
[3]Xu RH,Teng KY.Progress of chemotherapy in advanced gastric cancer[J].Chin J Cancer,2009,28(10):1108-1113.[徐瑞华,滕开原.晚期胃癌化疗进展[J].癌症,2009,28(10):1108-1113.]
[4]Robinson DR,Wu YM,Lin SF.The protein tyrosine kinase family of the human genome[J].Oncogene,2000,19(49):5548-5557.
[5]Gong J,Morishita A,Kurokohchi K,et al.Use of protein array to investigate receptor tyrosine kinases activated in gastric cancer[J]. Int J Oncol,2010,36(1):101-106.
[6]Lieto E,Ferraraccio F,Orditura M,et al.Expression of Vascular Endothelial Growth Factor(VEGF)and Epidermal Growth Factor Receptor (EGFR)is an Independent Prognostic Indicator of Worse Outcome in Gastric Cancer Patients[J].Ann Surg Oncol,2008,15(1):69-79.
[7]Foley J,Nickerson NK,Nam S,et al.EGFR signaling in breast cancer: Bad to the bone[J].Semin Cell Dev Biol,2010,21(9):951-960.
[8]Kruser TJ,Wheeler DL.Mechanisms of resistance to HER family targeting antibodies[J].Exp Cell Res,2010,316(7):1083-1100.
[9] Lee-Hoeflich ST,Crocker L,Yao E,et al.A central role for HER3 in HER2-amplified breast cancer:implications for targeted therapy[J]. Cancer Res,2008,68(14):5878-5887.
[10]Hsieh AC,Moasser MM.Targeting HER proteins in cancer therapy and the role of the non-target HER3[J].Br J Cancer,2007,97(4):453-457.
[11]Choi MR,An CH,Chung YJ,et al.Mutational and expressional analysis of ERBB3 gene in common solid cancers[J].APMIS,2014,122 (12):1207-1212.
[12]He L,Hannon GJ.MicroRNAs:small RNAs with a big role in gene regulation[J].Nat Rev Genet,2004,5(7):522-531.
[13]Peláez N,Carthew RW.Biological robustness and the role of microRNAs:a network perspective[J].Current Topics in Developmental Biology,2011,99:237-255.
[14]Zhang HY,Yang H,Zhang CN,et al.Investigation of microRNA expression in human serum during the aging process[J].Journals of Gerontology Series A-Biological Sciences and Medical Sciences,2015,70(1):102-109.
[15]Li M,Li J,Ding X,et al.microRNA and cancer[J].AAPS Journal,2010,12(3):309-317.
[16]Correa P.Human gastric carcinogenesis:a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention[J].Cancer Res,1993,52(24):6735-6740.
[17]Shi FM,Telesco SE,Liu YT,et al.ErbB3/HER3 intracellular domain is competent to bind ATP and catalyze autophosphorylation[J].Proc Natl Acad Sci U S A,2010,107(17):7692-7697.
[18]Hwang HW,Mendell JT.MicroRNAs in cell proliferation,cell death,and tumorigenesis[J].Br J Cancer,2006,94(6):776-780.
[19]Takamizawa J,Konishi H,Yanagisawa K,et al.Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival[J].Cancer Res,2004,64(11):3753-3756.
[20]Akao Y,Nakagawa Y,Hirata I,et al.Role of anti-oncomirs miR-143 and-145 in human colorectal tumors[J].Cancer Gene Ther,2010,17 (6):398-408.
[21]Chen YX,Ma CL,Zhang W,et al.Down regulation of miR-143 is related with tumor size,lymph node metastasis and HPV16 infection in cervical squamous cancer[J].Diagn Pathol,2014,9(6):901-906.
[22]Song T,Zhang X,Wang C,et al.Expression of miR-143 reduces growth and migration of human bladder carcinoma cells by targeting cyclooxygenase-2[J].Asian Pac J Cancer Prev,2011,12(4):929-933.
[23]Naito Y,Sakamoto N,Oue N,et al.MicroRNA-143 regulates collagen typeⅢexpression in stromal fibroblasts of scirrhous type gastric cancer[J].Cancer Sci,2014,105(2):228-235.
(2016-06-06收稿)
(2016-06-20修回)
(编辑:孙喜佳校对:杨红欣)

王欣怡专业方向为消化道肿瘤的诊断与内科治疗。
E-mail:2011111224@tijmu.edu.cn
miR-143 suppresses the proliferation and migration of SGC7901 gastric cancer cells
Xinyi WANG1,Haiyang ZHANG1,Shuang LI1,Tao NING1,Le ZHANG1,Jingjing DUAN1,Yanjun QU1,Yiran SI1,Yi WANG1,Guoguang YING2,Yi BA1
Correspondence to:Yi BA;E-mail:bayi@tjmuch.com
1Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China;2Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China
Objective:To investigate the role and mechanism of miR-143 in the proliferation and migration of gastric cancer(GC)cells. Methods:Western blot was performed to detect the expression level of avian erythroblastosis oncogene B-3(ERBB3)in GC tissues,paired non-cancerous tissues,and SGC7901 GC cells.RT-qPCR was conducted to determine the mRNA and miR-143 of ERBB3 quantitatively.Bioinformatics tools were used to predict the target gene of miR-143.Luciferase reporter assay was carried out to confirm the predicted target gene.Transwell and EdU assays were applied to observe the migration and proliferation of SGC7901 GC cells transfected with miR-143 mimics/inhibitor/NC mimics/inhibitor.Results:Compared with the expression levels of ERBB3 and miR-143 in the paired non-cancerous tissues,the expression level of ERBB3 was upregulated and the expression level of miR-143 was downregulated in GC tissues.In the prediction of the potential target gene,miR-143 could bind to a specific sequence of the 3′-untranslated regions (UTR)of the mRNA of ERBB3.This finding was supported by luciferase reporter assay results.In vitro,ERBB3 protein expression and cell migration and proliferation were suppressed significantly in the SGC7901 cells transfected with miR-143 mimics.By contrast,these processes were remarkably enhanced when the cells were transfected with miR-143 inhibitor.Conclusion:miR-143 can suppress the migration and proliferation of GC cells by downregulating the expression of ERBB3.
gastric cancer,miR-143,ERBB3,proliferation,migration
10.3969/j.issn.1000-8179.2016.16.677
①天津医科大学肿瘤医院消化肿瘤科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060);②中心实验室
巴一bayi@tjmuch.com

