雷替曲塞加奥沙利铂对比PF方案放化疗治疗食管癌的临床观察
陈程 马建华 丁群 尚玉萍 王忠明
雷替曲塞加奥沙利铂对比PF方案放化疗治疗食管癌的临床观察
陈程马建华丁群尚玉萍王忠明
目的:观察雷替曲塞+奥沙利铂化疗对比5-氟尿嘧啶(5-FU)联合顺铂的方案(PF方案)同步放化疗治疗中晚期食管癌的近期疗效及不良反应。方法:选取2012年1月至2014年12月连云港节第二人民医院84例病理确诊的中晚期食管癌患者,随机分为试验组雷替曲塞+奥沙利铂方案同步放化疗40例和对照组PF方案同步放化疗44例,采用三维适形放疗(DT=60 Gy/30 f)。化疗方案:试验组为雷替曲塞2.5 mg/m2,静滴d1,奥沙利铂130 mg/m2,静滴d2;对照组为5-FU 500 mg/m2,静滴d1~5,顺铂25 mg/m2,静滴d1~3。化疗均于放疗第1、29 d应用,化疗2个周期。比较两组患者的近期疗效和不良反应。结果:试验组缓解率(response rate,RR)、完全缓解(complete response,CR)、1年生存率均高于对照组(87.50%vs.79.54%,P=0.329;32.50%vs.18.18%,P=0.130;82.50%vs.79.50%,P=0.701),差异均无统计学意义。不良反应方面,试验组恶心呕吐、食欲不振、白细胞下降、放射性食管炎、心脏毒性明显减轻(P<0.05),其他不良反应两组相似(P>0.05)。结论:雷替曲塞+奥沙利铂方案联合放化疗治疗中晚期食管癌患者,近期疗效与PF方案同步放化疗相当,治疗不良反应明显下降,值得临床进一步行多中心、大样本研究。
雷替曲塞奥沙利铂PF方案食管癌临床观察
食管癌是我国常见恶性肿瘤之一,患者确诊时80%以上的病例为中晚期,同期放化疗被认为是中晚期食管癌的标准治疗方案[1],5-氟尿嘧啶(5-FU)联合顺铂的方案(PF方案)是食管癌的标准化疗方案[2],但严重的不良反应影响其在临床中的应用,因此临床亟需探寻新的化疗方案。本研究将2012年1月至2014年12月连云港市第二人民医院84例食管癌患者随机分为雷替曲塞+奥沙利铂方案同步放化疗组和PF方案同步放化疗组,观察两组患者的近期疗效和不良反应。
1 材料与方法
1.1病例资料
选取2012年1月至2014年12月连云港市第二人民医院经纤维胃镜检查,病理确诊为食管癌的初治患者84例,入组患者均为Ⅱ~Ⅲ期(参考《非手术治疗食管癌临床分期》),卡氏评分≥70分,X光线片显示无食管瘘征象,血常规及肝脏、肾功能检查无放化疗禁忌证,预计生存期≥6个月,随机分为试验组雷替曲塞+奥沙利铂联合放化疗40例,对照组PF联合放化疗44例。试验组中男性24例、女性16例,中位年龄54(38~70)岁;鳞癌38例、腺癌2例;病变位于胸上段的9例、胸中段22例、胸下段9例;病变长度≤3 cm 8例、3~6 cm 23例、≥6 cm 9例;Ⅱ期24例、Ⅲ期16例。对照组中男性26例、女性18例,中位年龄55(40~70)岁;鳞癌41例、腺癌3例;病变位于胸上段10例、胸中段24例、胸下段10例;病变长度≤3 cm 9例、3~6 cm 25例、≥6 cm 10例;Ⅱ期26例、Ⅲ期18例。两组差异均无统计学意义(均P>0.05)(表1)。

表1 两组患者的一般临床资料Table 1 Clinical data of patients in the two groups
1.2方法
1.2.1研究设计及样本量计算通常局部晚期食管癌同步放化疗局控率约为85%,按照检验水准α= 0.05,β=0.2,把握度80%,双侧检验,非劣性试验计算每组需至少纳入39例患者。本研究经过被研究对象或其家属知情同意并得到医院伦理委员会批准。
1.2.2放疗方案采用瓦里安直线加速器6MV-X线三维适形放射治疗,在CT模拟机下定位,CT图像传输到计划系统,勾画靶区及周围正常器官,以影像学可见的肿瘤为GTV,CT所示的短径≥1.0 cm转移性颈部及纵隔肿大淋巴结为GTVnd,临床靶体积CTV包括GTV、GTVnd及相应淋巴引流区,并在GTV上下方向外扩3~5 cm,或在有淋巴结转移的CT层面上下各放1.5 cm,GTV和GTVnd前后左右外扩0.8 cm,CTV上下及前后左右各外放0.5 cm为计划靶体积PTV。同时勾画邻近组织和器官轮廓,包括脊髓、气管、心脏及双肺,通过剂量体积直方图(DVH)与等剂量线图选择最佳治疗计划方案。PTV处方剂量为60 Gy,常规分割,2 Gy/次,1次/d,5次/周。正常器官限量,双肺V20≤28%,肺平均剂量≤13 Gy,脊髓≤45 Gy,心脏V30≤40%,V40≤30%。
1.2.3化疗方案试验组为雷替曲塞2.5mg/m2,静滴d1;奥沙利铂130mg/m2,静滴d2。对照组为5-FU 500 mg/m2,静滴d1~5;顺铂25 mg/m2,静滴d1~3。在放疗的第1、29 d开始,间隔28 d为1个周期,共行2个周期。放疗当天开始给予化疗。第1个周期出现3级血液学毒性,减少化疗药物25%用量,出现4度血液学毒性,终止第2个周期化疗。
1.3观察指标
1.3.1近期疗效评价方法为CT结合食管钡餐评价食管癌放疗近期疗效,按WHO实体瘤疗效评价标准,分为完全缓解(complete response,CR):肿瘤消失,基本恢复正常,体检无肿瘤存在征象≥1个月;部分缓解(partial response,PR):可测量肿瘤缩小50%以上,无新病灶出现,持续≥1个月;疾病稳定(stable disease,SD):可测量肿瘤缩小不足50%,肿瘤增大不足25%,持续≥1个月;疾病进展(progressive disease,PD):X光线食管钡餐造影及体检可测量肿瘤增大25%以上或有新病灶出现。放疗结束后1个月行首次随访,评价近期疗效。总缓解率(overall response rate,ORR)=CR+PR。计算1年生存率,生存期以治疗开始首日至死亡或末次随防时间计算。本研究全部病例随访至2015年12月,失访2例,随访率为97.6%。
1.3.2不良反应治疗期间每周查血常规及记录不良反应,化疗不良反应按NCI-CT-CAE 3.0版标准进行评价,放疗不良反应按照RTOG急性放射损伤分级标准评定。
1.4统计学分析
采用SPSS 17.0软件进行统计学分析,应用Kaplan-Meier法计算生存率,显著性差异采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1疗效
2.1.1近期疗效试验组缓解率(response rate,RR)及CR分别为87.50%、32.50%;对照组RR及CR分别为79.54%、18.18%。试验组RR、CR均高于对照组(87.50% vs.79.54%,P=0.329)及(32.50%vs.18.18%,P=0.130),但差异均无统计学意义(均P>0.05,表2)。

表2 两组患者近期疗效比较Table 2 Comparison of short-term therapeutic effects of esophageal carcinoma patients in the two groups
2.1.2远期疗效试验组1年生存率为82.5%,对照组1年生存率为79.5%,差异无统计学意义(P=0.701,表3,图1)。
2.2不良反应
放疗完成情况:试验组共2例患者因不良反应中断放疗,延迟放疗时间分别为1、3 d。对照组共4例患者因不良反应中断放疗,延迟放疗时间分别为2、3、3、4 d。以上6例患者经积极对症治疗后症状缓解继续放疗,两组全部患者均完成放疗。化疗完成情况:试验组患者均完成2个周期同步化疗,6例患者因血液学毒性达3级,第2个周期减量化疗。对照组患者共42例完成2个周期同步化疗,2例因4级白细胞减低终止第2个周期化疗,14例患者因血液学毒性达3级,第2个周期减量化疗。试验组与对照组患者均出现不同程度的放射性食管炎、血液学毒性、胃肠道等不良反应,与对照组相比,试验组患者恶心呕吐、食欲不振、白细胞下降、放射性食管炎、心脏毒性不良反应明显减低(P<0.05),其他不良反应两组相似(均P>0.05)(表4)。

表3 两组患者生存率比较Table 3 Comparison of survival rates of esophageal carcinoma patients in the two groups
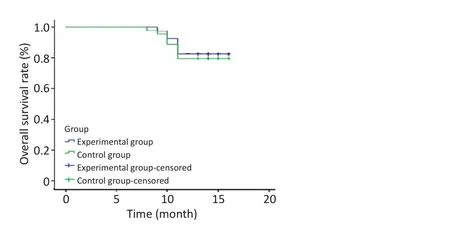
图1 两组患者的生存曲线Figure 1 Survival curves of esophageal carcinoma patients in the two groups
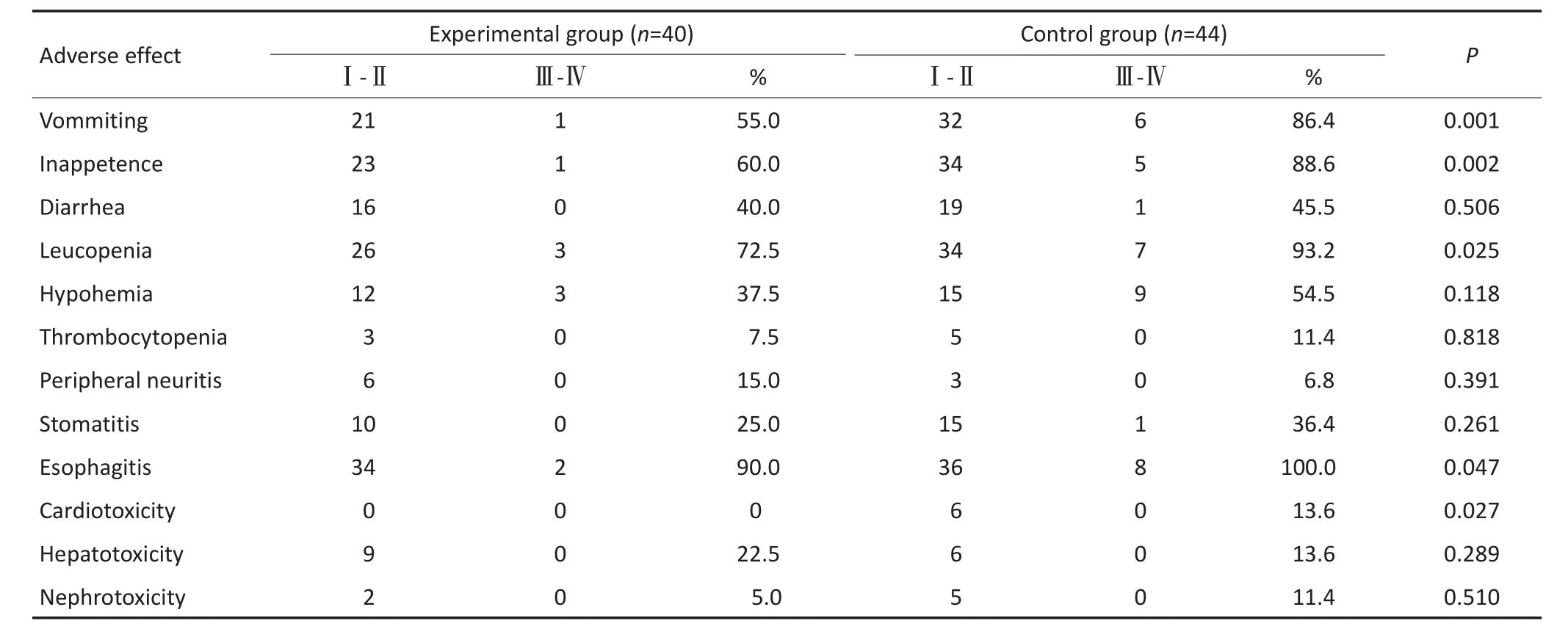
表4 两组患者的不良反应比较Table 4 Comparison of adverse effects of esophageal carcinoma patients in the two groups
3 讨论
食管癌发病率居恶性肿瘤第8位,死亡率居第6位[3-4],5年生存率为15%~25%。放疗是中晚期食管癌的主要治疗手段之一,单纯放疗生存率不高,其失败的主要原因为局部未控、复发和远处转移。研究显示,同步放化疗可以增加局部病灶控制率、减少转移及复发、提高生存率、改善患者的生存质量,其已成为不宜手术中晚期食管癌的标准治疗方案之一[5-8]。其中PF方案是食管癌的标准化疗方案。然而,PF方案同步放化疗在提高疗效的同时也明显增加其不良反应,特别是血液及胃肠道不良反应,部分患者因无法耐受而被迫延迟或中断治疗,严重影响疗效,少数患者甚至因较重的不良反应而威胁生命[6-7]。由于5-FU给药时间长,使用不便,降低用药的医从性,因此临床亟需探寻不良反应较轻且给药方便的新方案。
雷替曲塞为抗代谢类喹唑啉叶酸类似物,通过细胞膜还原型叶酸甲氨蝶呤载体被细胞主动摄取,而后在细胞内被叶酸基聚谷氨酸合成酶代谢为一系列多聚谷氨酸类化合物,该化合物通过高选择性抑制胸苷酸合成酶活性,从而抑制细胞DNA的合成,与氟尿嘧啶相比,其TS酶结合位点不同,但却拥有相同的靶酶[9-10]。雷替曲塞静脉滴注仅需15 min,但半衰期却长达198 h,因此该化合物能在细胞内长时间发挥抗肿瘤作用,主要用于治疗晚期结直肠癌,相关研究表明应用于食管癌的治疗也有较好疗效[11-17]。奥沙利铂是第3代铂类化合物,具有放疗增敏效果,对晚期食管癌的疗效优于顺铂,而消化道及肾脏不良反应较顺铂下降,体外细胞实验显示雷替曲塞与铂类药物联合起增效作用[12],部分临床研究显示雷替曲塞+奥沙利铂在食管癌的应用中具有较好的近期疗效及安全性[15-16]。因此,本研究采用雷替曲塞联合奥沙利铂对比PF方案化疗联合食管癌同步放疗进行研究,以期探索食管癌新的同步化疗方案。
本研究显示,试验组的CR、RR、1年生存率分别为32.50%、87.50%及82.5%,对照组则分别为18.18%、79.54%及79.5%,与相关报道结果一致[15-16],相比于对照组,试验组的CR、RR、1年生存率均有提高,差异均无统计学意义(P=0.130、0.329、0.701)。相比于对照组,试验组的CR、RR有提高的趋势,其疗效确切,考虑与雷替曲塞长达198 h的半衰期有关,较长的半衰期既能持续发挥药物反应,同时可以提高放疗敏感性,起到放疗增敏的效果,但尚需临床扩大样本进一步探索。
不良反应方面,与对照组相比,试验组在恶心呕吐、食欲下降、白细胞下降、放射性食管炎、心电图异常不良反应明显减低(P<0.05),无4级不良反应,3级不良反应明显减少。因此,雷替曲塞联合奥沙利铂方案同步放化疗不良反应明显下降,且雷替曲塞用药时间仅15 min,用药方便,患者医从性更高,更易被患者接受,这与夏铀铀等[15]报道相似,提示雷替曲塞+奥沙利铂同步放化疗使消化道不良反应、骨髓抑制、心脏损伤明显减轻。相关研究显示雷替曲塞心脏毒性反应发生率明显低于5-FU[18-20]。因此,2013年欧洲临床肿瘤协会年会(ESMO)推荐雷替曲塞可作为有严重心脏病史或有心脏病风险,不适合5-FU治疗患者的标准替代药物。本研究结果显示,相比于对照组,雷替曲塞联合奥沙利铂同步放化疗未发现心脏毒性,差异具有统计学意义,进一步证明雷替曲塞的心脏安全性。但试验组肝功能异常及末梢神经炎发生率较对照组增高,差异无统计学意义,肝功能异常经保肝治疗后均恢复正常,建议肝功能异常患者使用雷替曲塞联合奥沙利铂化疗要慎重,而末梢神经炎则考虑主要由奥沙利铂引起,化疗期间通过皮肤保暖及相关对症处理后未影响继续治疗。
综上所述,雷替曲塞加奥沙利铂方案化疗联合放疗治疗中晚期食管癌,尤其对于老年患者、严重心脏病史或有心脏病风险的患者,不良反应明显下降,而疗效一致,安全性较好,用药方便,医从性较高,是临床应用中食管癌同步放化疗新的选择,值得临床推广应用。但本研究样本量较少,仍需进一步行多中心、大样本研究。
[1]Mariette C,Piessen G,Trlboulet JP.Therapeutic strategies in oesophageal carcinoma:role of surgery and other modalities[J].Lancet Oncol,2007,8(6):545-553.
[2]Shah MA,Schwartz GK.Treatment of metastatic esophagus and gastric cancer[J].Semi Oncol,2004,31(4):574-587.
[3]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[4]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[5]Wong RK,Malthaner R.Combined chemotherapy and radiotherapy(without surgery)compared with radiotherapy alone in localized carcinoma of the esophagus[J].Cochrane Database Syst Rev,2010,20(1):2092.
[6]Wang XQ,Cheng XZ,Wang SW,et al.Concurrent PF chemotherapy and radiotherapy in the treatment of advanced esophageal cancer [J].Chin J Radiat Oncol,2005,14(3):215.[王新强,程秀祯,王世伟,等.放疗联合PF方案同步治疗中晚期食管[J].中华放射肿瘤学杂志,2005,14(3):215.]
[7]Wan ZL,Ge Q,Cheng GJ,et al.Clinical analysis of radiation therapy combined with TP chemotherapy for esophageal cancer[J].J Mod Oncol,2010,18(12):2378-2379.[万志龙,葛琴,成国建,等.放疗联合TP方案化疗综合治疗食管癌100例临床分析[J].现代肿瘤医学,2010,18(12):2378-2379.]
[8]Li MJ.Efficacy of concurrent radiotherapy and chemotherapy for locally advanced esophageal cancer[J].Chin Prac Med,2011,6(1):75-76.[李敏杰.局部晚期食管癌同步放化疗疗效[J].中国实用医药,2011,6(1):75-76.]
[9]Jackman AL,Taylor GA,Gibson W,et al.ICI D1694,a quinazoline antifolate thymidylate synthase inhibitor that is a potent inhibitor of L1210 tumor cell growth in vitro and in vivo:a new agent for clinical study[J].Cancer Res,1991,51(20):5579-5586.
[10]Jackman AL,Calvert AH.Folate-based thymidylate synthase inhibitors as anticancer drugs[J].Ann Oncol,1995,6(9):871-881.
[11]Mackay HJ,McInnes A,Paul J,et al.A phaseⅡstudy of epirubicin,cisplatin and raltitrexed combination chemotherapy(ECT)in patients with advanced oesophageal and gastric adenocarcinoma[J]. Ann Oncol,2001,12(10):1407-1410.
[12]Kelland LR,Kimbell R,Hardcastle A,et al.Relationships between resistance to cisplatin and antifolates in sensitive and resistant cell lines[J].Eur J Cancer,1995,31(6):981-986.
[13]Lv HL,Wen SW,Li Y,et al.Effect of raltitrexed as second-line chemotherapy for advanced esophageal cancer[J].J Hebei Medi Univ,2015,36(5):520-522.[吕会来,温士旺,李勇,等.雷替曲塞单药二线治疗晚期食管癌疗效观察[J].河北医科大学学报,2015,36(5):520-522.]
[14]Sun J,Sheng ZJ,Guo JL.Observation of chemotherapy with raltitrexed and Cisplatin for advanced esophageal cancer[J].Modern Journal of Integrated Traditional Chinese and Western Medicine,2014,23(27):2989-2997.[孙静,胜照杰,郭君兰.雷替曲塞联合顺铂治疗进展期食管癌疗效观察[J].现代中西医结合杂志,2014,23 (27):2989-2997.]
[15]Xia YY,Wang L,Song DA,et al.PhaseⅡclinical trial of raltitrexed plus oxaliplatin combined with concurrent radiotherapy for advanced esophageal carcinoma[J].Chin J Clin Oncol,2014,41(11):716-719.[夏铀铀,王磊,宋大安,等.放疗联合雷替曲塞奥沙利铂同步治疗中晚期食管癌的Ⅱ期临床研究[J].中国肿瘤临床,2014,41(11):716-719.]
[16]Li DF,Yang F,Jiang SN,et al.Observation of raltitrexed and oxalipatin combined with three-dimensional conformal radiotherapy for advanced esophageal cancer[J].Chin Clin Oncol,2015,20(1):57-60.[李德凡,杨帆,蒋淑年,等.三维适形放疗联合雷替曲塞加奥沙利铂治疗中晚期食管鳞癌的临床观察[J].临床肿瘤学杂志,2015,20 (1):57-60.]
[17]Lv HL,Wen SW,Li Y,et al.Observation of chemotherapy with raltitrexed for older advanced esophageal cancer[J].Hebei Medical Journal,2015,37(9):1382-1383.[吕会来,温士旺,李勇,等.雷替曲塞单药治疗老年晚期食管癌疗效观察[J].河北医药,2015,37(9):1382-1383.]
[18]Sorrentino MF,Kim J,Foderaro AE,et al.5-fluorouracil induced cardiotoxicity:review of the literature[J].Cardiol J,2012,19(5):453-458.
[19]Kelly C,Bhuva N,Harrison M,et al.Use of raltitrexed as an alternative to 5-fluorouracil and capecitabine in cancer patients with cardiac history[J].Eur J Cancer,2013,49(10):2303-2310.
[20]Liao F,Wang L,Qin SK,et al.Report of 9 cases of cardiac toxicity induced by fluorouracil review of literature[J].J Prac Oncol,2014,29 (2):183-185.[廖峰,王琳,秦叔逵,等.氟尿嘧啶引起的心脏毒性9例报道附文献复习[J].实用肿瘤杂志,2014,29(2):183-185.]
(2016-04-26收稿)
(2016-08-10修回)
(编辑:武斌校对:孙喜佳)

陈程专业方向为胸部肿瘤的放化疗综合治疗。
E-mail:chenchenggood@163.com
Concurrent raltitrexed plus oxaliplatin and radiotherapy versus PF synchronous radiotherapy on advanced esophageal cancer
Cheng CHEN,Jianhua MA,Qun DING,Yuping SHANG,Zhongming WANG
Correspondence to:Zhongming WANG;E-mail:wzm85365580@126.com
Department of Cancer Radiotherapy,the Second People's Hospital of Lianyungang,Lianyungang 222023,China
Objective:To compare the therapeutic and adverse effects of concurrent raltitrexed plus oxaliplatin and radiotherapy with those of PF synchronous radiotherapy in the treatment of advanced esophageal cancer.Methods:A total of 84 pathologically confirmed patients with advanced esophageal carcinoma were randomly distributed to the concurrent raltitrexed plus oxaliplatin and radiotherapy group(experimental group,n=40)and to the PF synchronous radiotherapy group(control group,n=44).All patients were treated with 3DCRT at a total dose of 60 Gy/30f.The chemotherapy in the experimental group consists of raltitrexed at 2.5 mg/m2,d1,plus oxaliplatin at 130 mg/m2,d2.The chemotherapy of the control group consists of DDP at 25 mg/m2,Dd1-3,plus 5-FU 500 mg/m2,d1-5.Two cycles of concurrent chemotherapy were administered during radiotherapy on d1 and d29.The comparison results were used to estimate the therapeutic and adverse effects of the two groups.Results:The rerponse rate,complete response,and one-year overall survival rate of the experimental group were higher than those of the control group[(87.50%vs.79.54%,P=0.3293),(32.50% vs.18.18%,P=0.13),and(82.50%vs.79.50%,P=0.701)],but the difference was not statistically significant.The incidence rates of nausea and vomiting,appetite degression,leucopenia,radiation-induced esophagitis,and cardiotoxicity were significantly lower(P<0.05)in the experimental group than in the control group.Other adverse effects of the two groups were similar(P>0.05).Conclusion:Similar to PF chemotherapy and radiotherapy,the concurrent raltitrexed plus oxaliplatin and radiotherapy achieved a similar short-term therapeutic effect but lower adverse effects on patients with esophageal cancer.
raltitrexed,oxaliplatin,PF scheme,esophageal cancer,clinical observation
10.3969/j.issn.1000-8179.2016.16.472
连云港市第二人民医院肿瘤放疗科(江苏省连云港市222023)
王忠明wzm85365580@126.com

