Lactobacilluskefiranofaciens乳糖酶基因克隆及在毕赤酵母中表达
邢竹青,王彦宁,刘兆贤,邬亚男,梁 丽,王艳萍(天津科技大学 食品工程与生物技术学院,天津 300457)
Lactobacilluskefiranofaciens乳糖酶基因克隆及在毕赤酵母中表达
邢竹青,王彦宁,刘兆贤,邬亚男,梁丽,王艳萍*
(天津科技大学 食品工程与生物技术学院,天津 300457)
以马乳酒样乳杆菌ZW3基因组为模板,PCR扩增得到乳糖酶中LacL、LacM两个大小亚基片段,经EcoRI和SnaBI双酶切后,分别连接pPIC9K质粒,转化大肠杆菌感受态细胞DH5α,并验证其核苷酸序列正确。将重组质粒pPIC9K-LacL、pPIC9K-LacM分别电转化毕赤酵母GS115,构建pPIC9K-LacL-GS115重组子和pPIC9K-LacM-GS115重组子,通过筛选得到抗G418浓度达到3.0mg/m L,具有多拷贝基因的重组子。经反转录PCR验证,cDNA上存在LacL片段,并可检测到乳糖酶酶活达到1.17 U/m L;pPIC9K-LacM-GS115重组子诱导表达72 h后的发酵液上清经SDS蛋白电泳检测到目的条带。
乳糖酶;毕赤酵母;克隆;表达
乳糖酶水解乳糖的糖苷键分解乳糖为半乳糖和葡萄糖,或发生转糖苷作用生成低聚半乳糖[1]。主要用于生产低乳糖牛奶以缓解乳糖不耐受症,近年来其在保健食品生产领域的应用也备受关注(如低聚半乳糖[2]),其市场需求量逐年扩大。因此,对乳糖酶的研究不仅具有理论意义,而且有巨大的社会价值和经济效益。
乳酸菌被公认为一般安全(generally recognizedassafe,GARS)食品,是应用于食品工业中的重要菌种[3]。乳酸菌来源的乳糖酶为中性乳糖酶[4],其最适温度介于40~60℃,可满足乳制品生产的要求,但其不能胞外分泌,提高了分离纯化的难度,不适宜实际食品工业生产。为了获得具有大规模工业生产价值的重组酶发酵菌株,一株经过全基因组测序的马乳酒样乳杆菌ZW 3[5]中两个含有重叠区域的LacL、LacM乳糖酶大小亚基片段分别被克隆到高效的蛋白表达平台——毕赤酵母[6]中,进行了初步表达。
1 材料与方法
1.1料与试剂
1.1.1种
马乳酒样乳杆菌(Lactobacilluskefiranofaciens)ZW 3,大肠杆菌DH5α,毕赤酵母(Pichia pastoris)GS115,以上菌种均为本实验室保藏。
1.1.2养基[6-7]
LB培养基、MRS培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、MD培养基、基本培养基(m inimalmedium,MM)、BMGY诱导表达培养基、BMMY诱导表达培养基。
1.1.3粒
酵母分泌型表达载体pPIC9K:由本实验室保存。
1.1.4物
基因Lac L和LacM引物:根据大小亚基基因片段的核酸序列设计引物,上游引物添加限制性内酶位点SnaB I,下游引物添加限制性内切酶位点EcoR I。
Lac L F 5′-CGGTACGTAATGCAAGCAAATATTAA ATG-3′
Lac L R 5′-CGCGGGAATTCTTATTTGTGTAATCC ATAATAG-3′
Lac M F 5′-CCGTACGTAATGGATTACACAAATA AG-3′
LacM R 5′-CGGAATTCTTAAAACTGGTTTAAGAT GAAGG-3′
pPIC9K载体测序通用引物:
5′AOX1 5′-GACTGGTTCCAATTGACAAGC-3′
3′AOX1 5′-GCAAATGGCATTCTGACATCC-3′
1.1.5要试剂
限制性内切酶SnaB I及EcoR I、T4连接酶、Fastpfu高保真聚合酶、细菌基因组提取试剂盒、质粒提取试剂盒、PCR纯化试剂盒、反转录试剂盒、β-半乳糖苷酶试剂盒。
1.2器与设备
genepulser Xcell电转仪、聚合酶链式反应(polymerase chain reaction,PCR)仪、Power PAC 3000电泳仪、全自动凝胶成像仪:美国Bio-Rad公司;DYY-Ⅲ-6B型稳压稳流电泳仪、DYCZ-24D型电泳槽:北京六一仪器厂;5415D型离心机:德国Eppendorf公司;HZQ-F160全温振荡培养箱:北京东联哈尔仪器制造有限公司;AD07R-20-A12E循环水浴锅:美国Polyscience公司;VIS-7220型分光光度计:北京瑞利分析仪器公司。
1.3法
1.3.1色体的提取
采用细菌基因组提取试剂盒提取马乳酒样乳杆菌ZW 3染色体。
1.3.2糖酶大、小亚基基因片段的扩增
以马乳酒样乳杆菌ZW 3染色体为模板、LacL F、LacL R、LacM F、LacM R为引物,以常规方法扩增,扩增参数:94℃预变性4min;94℃变性30 s,55℃退火30 s,72℃延伸2m in,共进行30个循环;最后72℃延伸10m in。
1.3.3别构建pPIC9K-LacL、pPIC9K-LacM重组质粒
扩增所得的大、小亚基片段进行SnaB I和EcoR I双酶切,分别与经过相应限制性内切酶双酶切后的pPIC9K质粒,在T4连接酶的作用下,16℃进行连接过夜。连接产物转化大肠感受态细胞DH5α,验证阳性的克隆,送华大生物进行测序验证。
1.3.4Pichia pastorisGS115感受态制备
参照参考文献[7]。
1.3.5化Pichia pastoris GS115
参照《分子克隆指南》酵母电转化方法[8]。
1.3.6赤酵母重组子总RNA提取与反转录
Trizol法[9]提取毕赤酵母重组子总RNA,以提取到的总RNA作为模板利用反转录试剂盒,合成cDNA。
1.3.7糖酶酶活力的测定
使用β-半乳糖苷酶试剂盒测定,按照说明书操作。单位的定义:每1m L发酵上清液每小时产生1 nmol对硝基苯酚定义为一个酶活力单位,U/m L。
2 结果与分析
2.1PCR扩增马乳酒样乳杆菌乳糖酶基因
在NCBI中查找马乳酒样乳杆菌ZW 3全基因组序列上乳糖酶基因LacLM,全长2 833 bp,由大小两个亚基构成,其中大亚基LacL全长1 884 bp,小亚基LacL全长960 bp,二者有重叠区域。利用BLAST软件进行蛋白相似性比对,可知与LacL蛋白相似性最高的序列为瑞士乳杆菌中的乳糖酶大亚基,相似度达到82%;与LacM蛋白相似性最高的序列为瑞士乳杆菌中的乳糖酶小亚基,相似度达到81%。因为毕赤酵母表达载体pPIC9K已经带有信号肽序列,所以不需要添加信号肽。PCR扩增结果(图1)所示,产物分别在不到1 000 bp处和接近2 000 bp处有两条单一条带,图1中显示的结果与理论大小一致。

图1 乳糖酶基因LacL、LacM PCR扩增产物电泳结果Fig.1 Electrophoretogram of PCR amp lification products of lactase gene LacL and LacM
2.2组载体的验证
提取重组子中质粒,进行SnaB I和EcoR I双酶切验证,重组载体断为两条带。结果如图2所示。
由图2可知,大于8 000 bp的条带为pPIC9K载体片段,接近2 000 bp的片段为LacL片段,接近1 000 bp的片段为LacM片段,与目标条带大小一致。重组子质粒经过通用引物5’AOX1和3’AOX1测序后,与马乳酒样乳杆菌ZW 3基因组上大、小亚基片段的核苷酸序列进行比对,结果相似性为100%,说明所得大、小亚基的核苷酸序列完全正确。
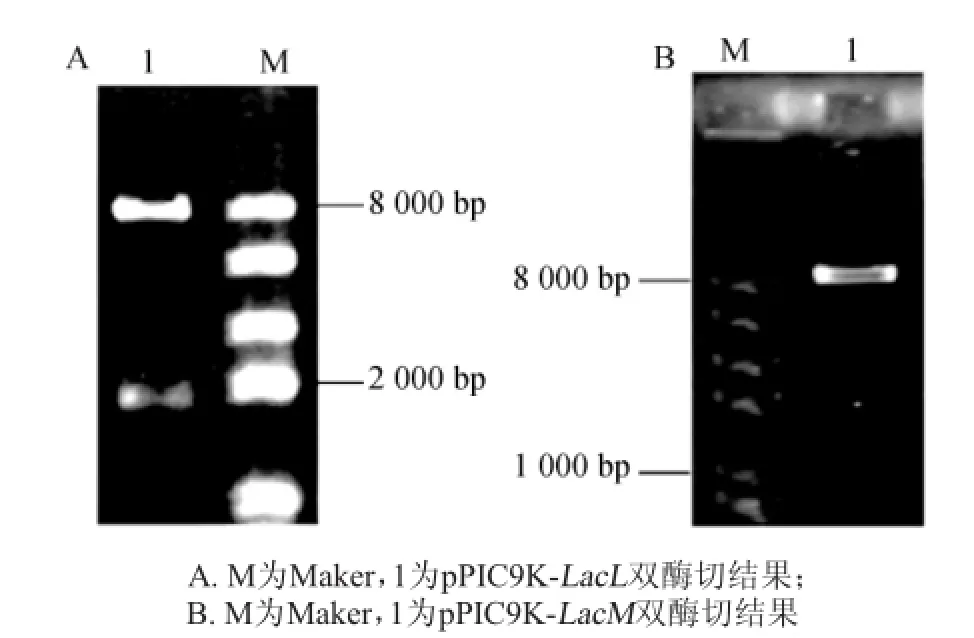
图2 重组pPIC9K-LacL质粒(A)和重组pPIC9K-LacM质粒(B)验证结果Fig.2 Verification results of recom binant p lasm id pPIC9K-LacL(A)and pPIC9K-LacM(B)
2.3组质粒pPIC9K-LacL、pPIC9K-LacM电转化Pichia pastoris GS115
重组质粒pPIC9K-LacL、pPIC9K-LacM分别电击转化感受态细胞Pichiapastoris GS115。转化子经MM/MD平板筛选后,挑选His+Mut+表型的酵母重组子,利用通用引物5’AOX1和3’AOX1进行验证。由图3(A)可知,1-7泳道均出现两条带,一条为AOX 1基因的2.2 kbp条带,另一条为目的条带大小,接近2 000 bp,与LacL片段大小一致。图3(B)中,2和3泳道只有目的基因一条带,说明AOX1基因在整合过程中被破坏,该重组子为假阳性;另外4个泳道,均出现两条带,一条为AOX1基因的2.2 kbp条带,另一条为目的条带,大小接近1 000 bp,与LacM片段大小一致。从而证明,LacL与LacM基因已分别成功整合到Pichia pastoris GS115基因组中。

图3 pPIC9K-Lac L酵母重组子(A)和pPIC9K-LacM酵母重组子(B)PCR验证结果Fig.3 PCR verification resu lts of yeast recombinant pPIC9K-LacL(A)and pPIC9K-LacM(B)
2.4拷贝重组子的筛选
pPIC9K质粒整合在酵母染色体中,能够使细胞产生G418抗性,其G418抗性水平与整合的卡那霉素抗性基因拷贝数直接相关,可进行体内多拷贝整合的筛选。分别取菌体细胞依次点接于含不同质量浓度(0.50mg/m L、1.00mg/m L、2.00mg/m L、3.00 mg/m L)G418抗性平板上。以pPIC9KLacL-GS115酵母重组子为例,30℃培养2~5 d,挑取4株在质量浓度为3.00mg/m L的G418抗性平板上生长较好的菌落,作为乳糖酶诱导表达的待选菌株,同样方法选取4株pPIC9K-LacM-GS115酵母重组子,作为待选菌株。
2.5亚基LacL与小亚基LacM分别在毕赤酵母GS115中的表达
将上述待选菌株接种于含有G418抗性的25m L BMGY培养基,30℃振荡培养至对数生长期,以转化pPIC9K空载体的毕赤酵母GS115菌株作为对照。再转接于适当体积的BMMY培养基中至OD600值为1.0~2.0,30℃振荡培养,开始诱导表达,每隔24 h补加甲醇使其最终体积分数为0.5%以维持诱导。将选取的pPIC9K-LacL-GS115重组子和pPIC9K-LacM-GS115重组子各4株,经甲醇诱导表达后,取培养72 h后的发酵液上清液进行SDS-PAGE分析。如图4所示,4株pPIC9K-LacM-GS115重组子在约40 ku左右均有1条特异蛋白条带,与预期得到带有信号肽的目标蛋白分子量相一致;在>40 ku处也出现一条特异性条带,通过NetNGlyc 1.0服务器分析,可知乳糖酶LacM氨基酸序列有一个潜在的N-糖基化位点,由此推测由于部分蛋白经过糖基化修饰,导致分子量偏大。而在图4中pPIC9K-LacL-GS115 4株重组子在80 ku处无明显可见特异性蛋白条带,这可能是由于表达量偏低,条带不易检测。

图4 重组子诱导表达蛋白电泳图Fig.4 Electrophoretogram of inducible expression protein by recombinant

图5 酵母重组子RNA提取结果Fig.5 RNA extraction resultof yeast recombinant
为了检测pPIC9K-LacL-GS115重组子中的LacL片段是否进入到转录阶段,提取重组子总RNA(如图5),通过反转录得到相应的cDNA作为模板,以LacL片段的特异引物进行PCR,以验证插入的LacL片段是否有相应的mRNA转录(如图6)。由图5可知,LacL片段在pPIC9K-LacL-GS115重组子中进行了转录过程,经过稀有密码子软件[10]分析发现编码LacL大亚基片段的基因序列在毕赤酵母中翻译时有12个氨基酸的密码子使用频率低于10%,故推测是翻译过程效率较低,导致蛋白表达量低。

图6 cDNA PCR验证结果Fig.6 cDNA PCR identification result
现有研究显示不同来源的乳糖酶基因在相似条件下经甲醇诱导在毕赤酵母中表达,重组酶酶活水平在0.37~51.2U/m L[11-12],本实验中pPIC9K-LacL-GS115重组子诱导表达72 h后的发酵液上清乳糖酶酶活达到1.17 U/m L,阴性对照组pPIC9K-GS115重组子甲醇诱导后未能检测到乳糖酶活力,而pPIC9K-LacM-GS115重组子发酵72 h后的上清液未能测出乳糖酶酶活,这可能是由于其在毕赤酵母中糖基化后改变构象造成的。另外,据文献报道[13-15],LacL和LacM二者多以异源二聚体的形式发挥较高的乳糖酶活性。
3 结论
目前工业化生产使用的乳糖酶多来源于克鲁维酵母,生产过程中必须经过破壁提取酶蛋白,造成乳糖酶收率低,影响酶活力[16]。利用毕赤酵母表达系统进行外源分泌表达,可使酶直接分泌于胞外,简化工艺步骤,减少酶活损失。本文采用毕赤酵母表达系统进行重组乳糖酶的表达,成功将马乳酒样乳杆菌ZW 3中乳糖酶大小亚基进行克隆,并分别连接到高效表达载体pPIC9K上,整合至毕赤酵母GS115中。重组菌株对G418的抗性越强表明外源基因整合的拷贝数越高[17],实验中成功筛选出高拷贝的pPIC9K-LacLGS115重组子和pPIC9K-LacM-GS115重组子。pPIC9KLacM-GS115重组子诱导表达72 h后的发酵上清液中检测到目的蛋白LacM相应条带,并且测定出pPIC9K-LacLGS115重组子诱导表达72 h后的发酵上清液中乳糖酶酶活达到1.17U/m L。本研究在毕赤酵母中成功表达了来自马乳酒样乳杆菌ZW 3中的乳糖酶大小亚基,为其应用研究奠定了基础。
[1]黄慧福.乳糖酶的性质及其应用[J].农技服务,2010,27(10):1353-1354.
[2]张群.低聚半乳糖生产技术研究[J].食品与生物技术学报,2015,34(7):784-784.
[3]闫肃,吕嘉枥,郜洪涛.乳酸菌在食品工业中应用[J].中国酿造,2010,29(12):1-3.
[4]章沙沙,张宇宏,樊晓虎,等.乳杆菌乳糖酶的基因异源表达及酶学性质分析[J].中囯农业科技导报,2011,13(3):53-59.
[5]WANG Y P,WANG JR,ZAHEER A.Complete genome sequence of Lactobacillus kefiranofaciens ZW 3[J].J Bacteriol,2011,193(16):4280-4281.
[6]顾小勇,李强.毕赤酵母基因工程菌胞内AOX酶的检测方法[J].生物工程学报,2001,17(4):474-477.
[7]王慧.应用双质粒体系提高融合蛋白GGH在毕赤酵母GS115中表达量的初步研究[D].无锡:江南大学硕士论文,2011.
[8]J.萨姆布鲁克,E.F.弗里奇,T曼尼阿蒂斯.分子克隆实验指南[M].北京:科学出版社,1992.
[9]于寒松,彭帅,谢远红,等.一种RNA提取试剂盒——TRIZOL的使用方法初探[J].食品科学,2005,26(11):39-42.
[10]FUHRMANN M,HAUSHERR A,FERBITZ L,et al.M onitoring dynamic expression ofnucleargenes in Chlamydomonasreinhardtii by using a synthetic luciferase reportergene[J].Plant M ol Biol,2004,55(6): 869-881.
[11]王霁昀.耐热β-半乳糖苷酶的克隆表达研究[D].无锡:江南大学硕士论文,2009.
[12]聂春明.乳酸杆菌β-半乳糖苷酶重叠基因的克隆表达及酶学性质分析[D].呼和浩特:内蒙古农业大学硕士论文,2012.
[13]SANTORO L,CAMMAROTA G,MANNA R,et al.M anagement and treatment of lactosemalabsorption[J].World J Gastroenterol,2006,12(2):187-191.
[14]THU-HA N,BARBARA S,STANIM IRA K,et al.Characterization and molecular cloning of a heterodimeric beta-galactosidase from the probiotic strain Lactobacillus acidophilus R22[J].FEMS M icrobiol Lett,2007,269(1):136-144.
[15]NGUYEN T H,SPLECHTNA B,YAMABHAIM,etal.Cloning and expression of theβ-galactosidase genes from Lactobacillus reuteri in Escherichia coli[J].J Biotechnol,2007,129(4):581-591.
[16]侯重文,钊倩倩,刘飞,等.米曲霉乳糖酶在毕赤酵母中的高效表达[J].药物生物技术,2014,21(1):22-25.
[17]符仙,陈丽萍,张爱联,等.用毕赤酵母的GAP启动子调控表达L-阿拉伯糖异构酶[J].工业微生物,2014,44(1):51-54.
Cloning of Lactobacillus kefiranofaciens β-galactosidase genes and expression in Pichia pastoris
XING Zhuqing,WANG Yanning,LIU Zhaoxian,WU Yanan,LIANG Li,WANG Yanping*
(College ofFood Engineeringand Biotechnology,Tianjin University ofScience&Technology,Tianjin 300457,China)
Using kum iss Lactobacillus kefiranofaciens ZW 3 genome as template,theβ-galactosidase genes(LacL and LacM)were am plified from L. kefiranofaciens by PCR,and itwas recombined into vector pPIC9K after digestion by EcoRIand SnaBI.Then two plasm ids of pPIC9K-LacL and pPIC9K-LacM were constructed through transformation into Escherichia coli DH5αand the nucleic acid sequencewasverified by sequencing results. The recombinationsof pPIC9K-LacL-GS115 and pPIC9K-LacM-GS115 were constructed by electroporating the vectors into Pichia pastoris GS115. Through screening,themulti-copy recombinations pPIC9K-LacL-GS115 and pPIC9K-LacM-GS115 were obtained resistant to 3.0 mg/m l G418. Through reverse PCR verification,LacL genes in recombination pPIC9K-LacL-GS115 were detected,in which fermented for 72 h induced by methanol.Moreover,theactivity ofβ-galactosidase from recombination pPIC9K-LacL-GS115 reached to 1.17 U/m l.A lso,the targetprotein band of recombination pPIC9K-LacM-GS115wasobserved by SDS-PAGE.
β-galactosidase;Pichia pastoris;clone;expression
Q556
0254-5071(2016)01-0010-04
10.11882/j.issn.0254-5071.2016.01.003
2015-11-16
国家自然科学基金资助项目(31171629);天津科技大学大学生实验室创新基金项目(1414A303)
邢竹青(1989-),女,博士研究生,研究方向为食品科学。
王艳萍(1962-),女,教授,博士,研究方向为食品科学。
——壳聚糖固定化乳糖酶条件的优化

