耐有机溶剂脂肪酶菌株的筛选及其耐受特性初探
张梓涵,王 晨,窦迎春,刘 娅(石河子大学食品学院,新疆 石河子 832000)
耐有机溶剂脂肪酶菌株的筛选及其耐受特性初探
张梓涵,王晨,窦迎春,刘娅*
(石河子大学食品学院,新疆 石河子 832000)
以筛选获得的新疆酿酒葡萄内生菌为出发菌株,首先采用含有橄榄油乳化剂及罗丹明B的平板初筛,再分别以体积分数1%正庚烷和1%甲苯为筛选压力进行复筛,从中得到1株耐有机溶剂脂肪酶菌株M-CY1,经形态和分子生物学技术鉴定为Penicillium asturianum。该菌遗传稳定性良好,菌种的酶活性与菌丝的生长量呈正相关,多种有机溶剂对该菌产脂肪酶活具有促进作用,其中二甲苯作用最为明显,酶活为4.99U/m L,相对酶活达143.76%。
葡萄;内生菌;耐有机溶剂脂肪酶;筛选;鉴定
非水相酶学是发展至今不足20年的一个酶催化新兴领域,这让一些传统方法难以合成的新型化合物及外消旋体拆分等得以实现,已超出了油-水界面上进行水解反应的范围,能催化各种合成反应的进行,如酯合成、手性化合物拆分、高聚物合成、肽合成、油脂改性、含油废弃物的生物修复处理等[1-4]。但选用有机溶剂作为反应介质的一个重要障碍是脂肪酶在有机相中容易发生结构重排而降解失活[1,5],因此如何使用脂肪酶在有机相中仍能较好发挥作用,便成为发展非水相酶学的重要问题。当前,寻找能够耐受有机溶剂的脂肪酶成为非水相酶学的研究热点之一。由于微生物是当前工业用脂肪酶的重要来源,而脂肪酶在微生物界分布十分广泛[6-9],迄今为止国内外已有诸多学者对耐有机溶剂脂肪酶产生菌的筛选及有机溶剂耐受性进行了研究,如Bacillus sphaericus205y[10],Pseudomonas sp.S5[11]等。植物内生菌是潜力巨大的生物催化剂宝库,植物内环境微生态的特殊性使其内生菌所产脂肪酶也有具有特殊性质的可能性,国内外已有学者从树木叶部、根、棕榈果实、橄榄树等植物中筛选获得了耐甲醇、乙醇、苯、丙酮、正己烷、二甲苯等有机溶剂的内生细菌和真菌[12-13]。目前,微生物产生的耐有机溶剂脂肪酶已用于有机相中多种化学反应的催化。但由于需要催化的化学方应类型多、产物浮躁,现有的耐有机溶剂脂肪酶源不能满足工业上的多样化需求,因此有必要寻找更多、更高效的耐有机溶剂微生物。鉴于新疆酿酒葡萄品种优良,地域特色明显,生物多样性丰富,本实验利用已有的新疆酿酒葡萄内生菌,从中进行耐有机溶剂脂肪酶菌株筛选,并对其耐有机溶剂的特性进行初步的研究,从而为耐有机溶剂脂肪酶的分离纯化及其应用奠定基础。
1 材料与方法
1.1料与试剂
1.1.1种来源
课题组实验室保藏菌种,源自新疆酿酒葡萄,共73株,包括内生细菌、霉菌、酵母菌和放线菌。
1.1.2养基
马铃薯葡萄糖琼脂培养基:用于内生真菌的活化[14]。牛肉膏蛋白胨培养基:用于内生细菌的活化[15]。高氏一号培养基:用于内生放线菌的活化[15]。
液体种子培养基:蛋白胨5 g,葡萄糖10 g,KH2PO41 g,MgSO4·7H2O 0.5 g,定容至1 L,pH值为7.0,121℃灭菌20m in[15]。
无机盐培养基:NaCl10 g,NH4Cl0.5 g,KH2PO40.5 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,CaCl20.1 g,KCl 0.1 g,FeSO4·7H2O 0.01 g,琼脂15~20 g,加蒸馏水1 L,121℃灭菌20min[15]。
初筛平板培养基:无机盐培养基高压灭菌后,静置至温度为60℃左右时每l00m L加入含0.2%罗丹明B的聚乙烯醇橄榄油乳化液12m L[15]。
液体发酵培养基:无机盐培养基高压灭菌后,静置至温度为25℃左右时每100m L加入1m L过滤灭菌的甲苯或正庚烷[15]。
1.1.3学试剂
对硝基棕榈酸苯酯(p-nitrophenylpalmitate,p-NPP):美国Sigma公司;橄榄油:上海嘉里食品工业有限公司;罗丹明B(Rhodamine B,Rh B):生工生物工程(上海)有限公司;聚乙烯醇(polyvinylalcohol,PVA):上海国药集团;乙腈、二氯甲烷、异丙醇:天津市福晨化学试剂厂;甲醇:天津市光复精细化工研究所;液体石蜡:天津市富宇精细化工有限公司;所有化学试剂均为国产分析纯。
1.2器与设备
LXJ-IIB低速大容量多管离心机:上海安亭科学仪器厂;722可见分光光度计:上海精密科学仪器有限公司;SW-CJ-JCV超净台:苏州安泰空气技术有限公司;ZXSD-1160生化培养箱、ZHWY-111B恒温培养振荡器:上海智城分析仪器制造有限公司;MOTIC B SERIES生物显微镜:麦克奥迪集团公司;FA1004电子天平:上海精科天平仪器厂;HHS-216恒温水浴槽:常州国华电器有限公司。
1.3法
1.3.1有机溶剂脂肪酶产生菌的筛选
将活化后的菌株分别接种到含有橄榄油乳化液及罗丹明B的初筛平板培养基上培养。产脂肪酶的菌株周围在紫外灯照射下会有红色的荧光圈。以菌落直径与荧光圈直径之比为筛选依据[16],选择比值大,即脂肪酶高产菌株作为复筛菌株,将其转接至斜面培养基上备用。对于紫外灯下有红色荧光圈的菌落,再分别以1%的正庚烷和1%的甲苯为筛选压力,添加于液体发酵培养基中进行复筛,摇床转速150 r/min,细菌培养24 h、霉菌培养72 h,发酵结束后,将发酵液5 000 r/min离心10min,取上清液测酶活力。
1.3.2肪酶活力检测
酸碱滴定法[17]。在实验温度和pH条件下,每分钟催化产生1μmol脂肪酸的脂肪酶的量定义为1个活力单位,以U表示。本实验将1%正庚烷加入到无机盐培养基中发酵培养后测得的脂肪酶活力为参照,以1%其他不同有机溶剂发酵培养后测得的酶活力为相对酶活。
取100m L锥形瓶向其中加入4m L 0.05mol/L的pH值为7.5的磷酸缓冲液和5m L橄榄油乳化液,置于45℃水浴中保温5m in,然后加lm L粗酶液,在45℃水浴中振荡10m in,取出立即加入15m L的无水乙醇,加入3滴酚酞指示剂,用0.05mol/L NaOH滴定溶液至呈粉红色。空白对照是加入1m L灭活过的酶液(灭活方法为100℃水浴15min),其余操作都相同,测得菌株酶活力。每次测定重复3次,得平均值。酶活力计算公式如下:
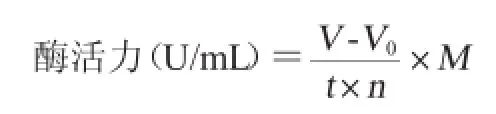
式中:V为滴定样液消耗的NaOH体积,mL;V0为滴定空白样消耗的NaOH体积,m L;t为反应时间,m in;n:酶液体积,m L;M为滴定用的NaOH溶液的浓度,mol/m L。
1.3.3标菌株的鉴定
采用载玻片培养法观察菌株显微形态,通过菌落形态和显微特性的观察初步鉴定耐有机脂肪酶菌株,再通过26SrDNA ITS区序列分析进行分子生物学鉴定,在GenBank中进行局部序列排比检索基本工具(Basic Local Alignment Search Tool,BLAST)比较搜索,同时下载同源性序列,目标菌株序列提交GenBank,提取同源性高的序列并使用Phylip(Version3.68)软件包构建系统发育树,确定待测菌株与库中已有记录间的亲缘关系。
1.3.4效菌株遗传稳定性实验
在PDA培养基中连续传代培养5次,30℃培养72 h,检测其产脂肪酶的遗传稳定性。
1.3.5效菌株生长量、酶活与时间的关系
高效菌株在含有1%的正庚烷无机盐培养基中,每隔12 h测其酶活和OD405nm值,分析菌体生长与产酶的关系。
1.3.6标菌株对有机溶剂的耐受规律研究
分别将正庚烷、乙腈、正丁醇、甲醇、乙醇、二氯甲烷、异丁醇、丙酮、石油醚、二甲苯、苯、正己烷、液体石蜡、异丙醇等14种有机溶剂以1%比例加入无机盐培养基中,进行目标菌株的发酵培养,测其产脂肪酶活力及相对酶活,考察目标菌株对有机溶剂的耐受规律。
将目标菌株在含有不同浓度的二甲苯无机盐培养基中发酵培养72 h,测定脂肪酶活,考察不同浓度的二甲苯对菌种脂肪酶活的影响规律。将目标菌株接在含有1%的正庚烷无机盐培养基中,每隔12 h测其酶活和OD405nm值,分析菌体生长与产酶的关系。
2 结果与分析
2.1生菌耐受有机溶剂脂肪酶产生菌的筛选
以73株葡萄内生菌为出发菌株,接种到以橄榄油乳化液为唯一碳源、罗丹明B为显色剂的培养基上进行菌株产脂肪酶能力的初筛,紫外光观察发现GUO-4、M-CY1、C1Y1、XP201、Q-G-3-2、J-CY1、Q-G-2-1这7株菌呈现橙红色荧光圈。
测量这7株菌的荧光圈直径和菌落直径,并计算荧光圈直径与菌落直径比值,结果见表1。由表1可知,M-CY1的直径比值最大,说明其产脂肪酶的能力较强。
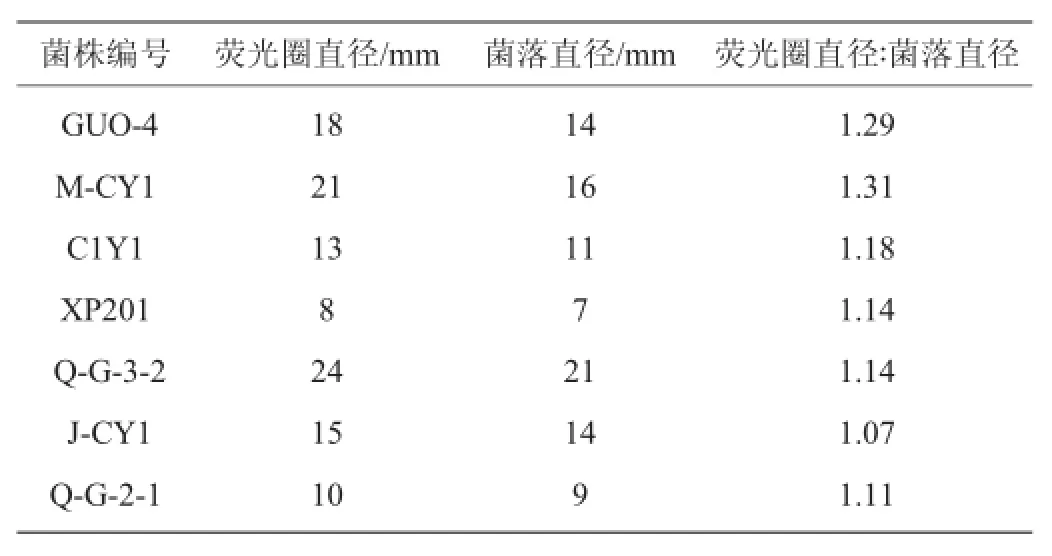
表1 荧光圈直径与菌落直径比Table 1 Ratio of fluorescent ring diameter and colony diameter
对初筛得到的7株菌分别以1%甲苯和1%正庚烷为筛选压力在28℃、150 r/min条件下进行液体发酵培养,脂肪酶活检测和OD405nm值,结果如图1所示。
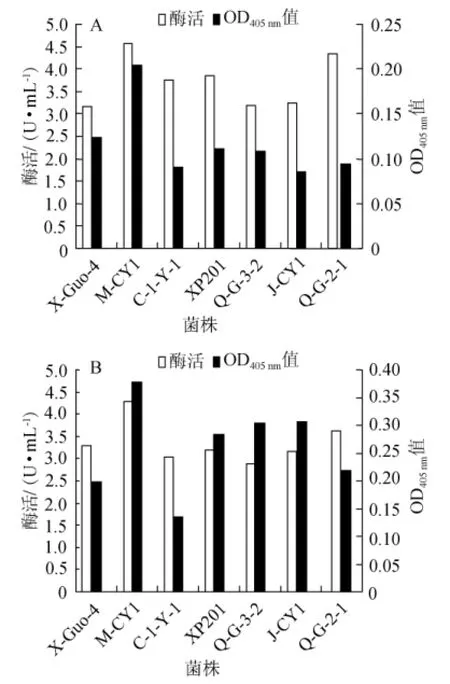
图1 不同菌株在含有甲苯(A)及正庚烷(B)的培养基中的生长量及脂肪酶活状况Fig.1 Grow th and lipase activity o f differentstrains inm edium w ith methylbenzene(A)and n-heptane(B)
由图1可知,菌株M-CY 1在甲苯和正庚烷中都具有较高的酶活性,因此选择M-CY1为耐有机溶剂脂肪酶产生菌目标菌株。
2.2标菌株的鉴定
对菌株M-CY1在PDA培养基上的菌落形态进行观察,结果见图2。由图2可知,发现菌落呈近圆形,直径约30mm,平坦分布,呈绒状质地,中间青灰色周围白色,背面橙红色,周围泛黄。显微形态观察发现其为无色的无隔菌丝,孢囊梗直立,没有假根,多次分枝,具体菌落及显微形态见图2。
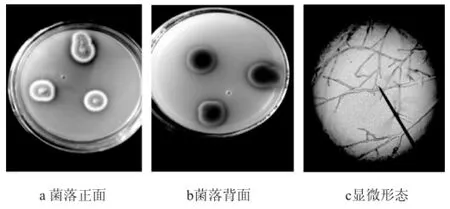
图2 菌株M-CY1的菌落形态和显微形态Fig.2 Colonialand microscopicmorphology of strain M-CY1
为进一步确定耐有机溶剂脂肪酶产生菌M-CY1的分类学地位,对其进行了DNA测序,结果见图3。由图3可知,在750~500 bp之间出现明显的亮带,说明PCR扩增成功,满足DNA序列测定要求。得其26S rDNA ITS区的基因全长为564 bp。对其基因序列进行分析后构建系统发育树如图4所示。
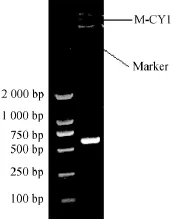
图3菌株M-CY1的PCR产物电泳图谱Fig.3 Electrophoretogram of PCR products of strain M-CY1
由图4可知,与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)上已有的序列进行BlAST同源性检索,发现其26SrDNA ITS和Penicillium的多株菌同源性达99%,而与Penicillium asturianum最接近,即确定菌株M-CY 1为Penicillium asturianum。
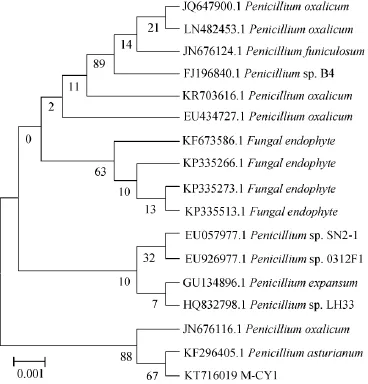
图4 菌株M-CY1的系统发育树Fig.4 Phylogenetic tree of strain M-CY1
2.3落产脂肪酶的遗传稳定性
将菌株M-CY1进行连续传代培养,测定其在甲苯和正庚烷中的脂肪酶活力,结果见表2。
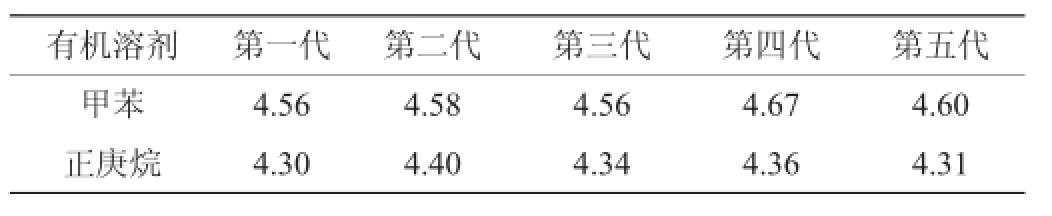
表2 菌株M-CY1产耐有机溶剂脂肪酶遗传稳定性试验结果Table 2 Results of the genetic stability testof strain M-CY1 w ith organic solvents-tolerant lipases production U/m L
由表2可知,菌株M-CY1产脂肪酶活性经5代连续培养,酶活变化不明显,说明菌株M-CY 1产生的脂肪酶具有良好的遗传稳定性。
2.4效菌株M-CY1产脂肪酶活力与菌株生物量
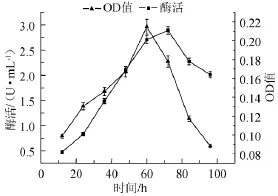
图5 菌体生物量和脂肪酶活的相关性Fig.5 Correlation of biomass and lipase activity
为了解菌株M-CY1生长和产酶的关系,从而在适宜时间得到脂肪酶活力较高的发酵液,对高效菌株M-CY1每隔12 h测量一次酶活力和OD405nm值,结果如图5所示。
由图5可知,随着培养时间的增加菌株M-CY1的产脂肪酶活力逐渐升高,72 h酶活力达到最高。当超过72 h后,内生菌产脂肪酶活力呈下降趋势。OD405nm值即菌株生物量在一定的时间范围内呈正态,60 h之前和时间呈正比,60 h之后呈反比状态。综上可得,菌株的生物量与菌种的酶活性大致呈正相关。
2.5标菌株对有机溶剂的耐受规律
2.5.1效菌株对多种有机溶剂的耐受性检测
选取了14种不同种类的有机溶剂,包括烷烃、环烷烃、醇类、酮类等,以1%的比例添加于无机盐培养基中,由于重点研究正庚烷对目标菌株M-CY1的影响,因此以1%正庚烷中的脂肪酶活为对照,观察目标菌株M-CY1的菌体生长情况,测定脂肪酶活力,结果见表3。
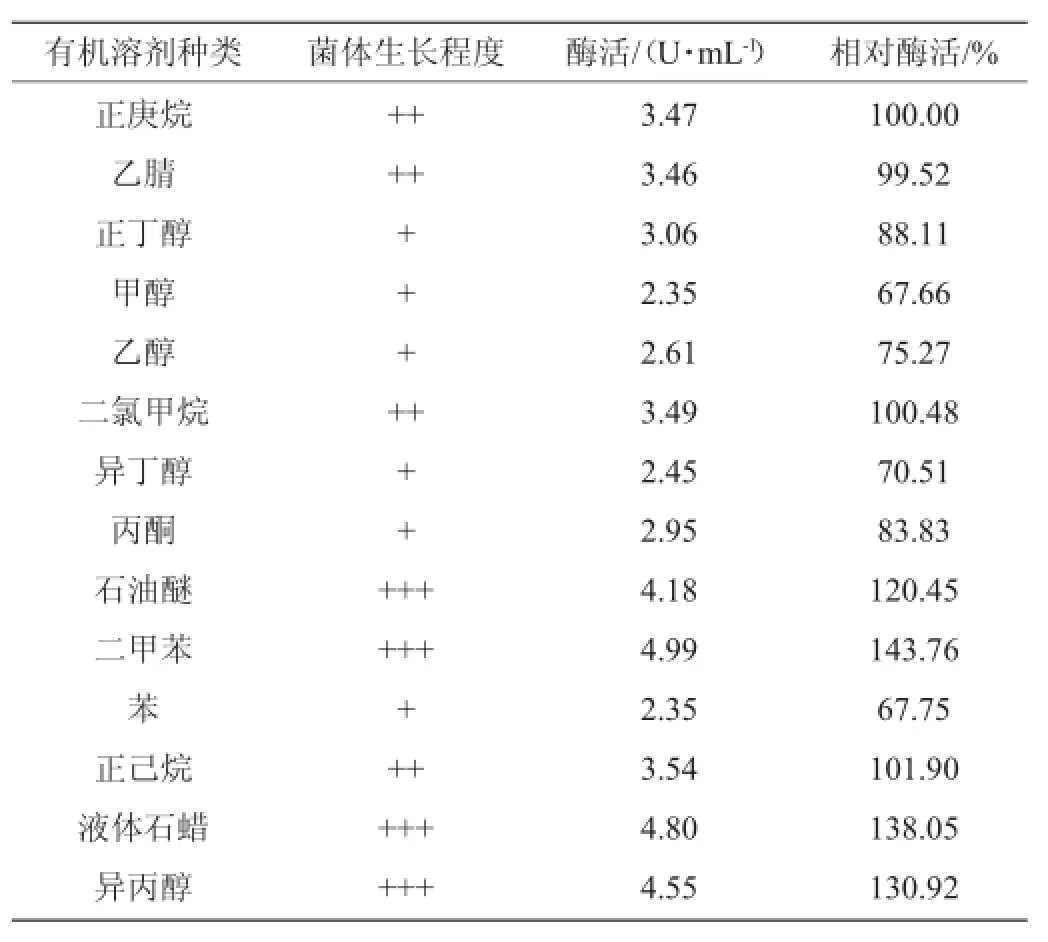
表3 菌株M-CY1在有机溶剂中的生长量和脂肪酶活Table 3 Grow th and lipase activity o fstrain M-CY1 in organic solvent
由表3可知,菌株在M-CY1所给的有机溶剂中都能生长,但生长程度和酶活有所不同,苯和甲醇对该菌所产脂肪酶有一定抑制作用,而石油醚、二甲苯、液体石蜡和异丙醇能促进菌体产脂肪酶。其中二甲苯中菌株M-CY1的脂肪酶最高,为4.99U/m L,相对酶活为143.76%。
2.5.2甲苯对高效菌株M-CY1产脂肪酶活力的影响
为了解二甲苯浓度对菌株产脂肪酶活力的影响,在液体发酵培养基中添加不同含量的二甲苯,测定其脂肪酶活,结果见表4。

表4 不同浓度二甲苯对脂肪酶活的影响Table 4 Effect of differen t xylene concentration on lipase ac tivity
由表4可知,随着二甲苯含量的升高,脂肪酶活逐渐下降。这可能是由于有机溶剂直接与酶作用,破坏维持酶蛋白活性构型的氢键和疏水相互作用,抑制了酶的活性。但在含量高达50%的二甲苯中,菌体仍然能够生长,且保持一定脂肪酶活力,说明菌株对二甲苯具有较高耐受特性。
3 结论
本实验利用橄榄油乳化剂为唯一碳源的罗丹明B平板法初筛从73株葡萄内生菌中获得了7株能够产脂肪酶的菌株,并以1%的甲苯和正庚烷为筛选压力复筛得到1株耐有机溶剂脂肪酶高效目标菌——M-CY1。形态和分子学研究表明,M-CY 1为Penicillium asturianum,其产脂肪酶的遗传性状稳定,且能够耐受多种有机溶剂,在二甲苯中生长和产酶情况最好,酶活达4.99U/m L,且该菌所产脂肪酶能耐受浓度高达50%的二甲苯溶液,体现了较强的有机溶剂耐受特性。该菌所产脂肪酶对有机溶剂的广谱耐受性,既为此脂肪酶在非水相介质的靶向应用奠定基础,也为生物降解由这些有机溶剂导致的环境污染提供了参考。
[1]GUPTA A,KHARESK.Enzymes from solvent-tolerantmicrobes:useful biocatalysts for non-aqueous enzymology[J].Crit Rev Biotechnol,2009,29(1):44-54.
[2]PATIL K J,CHOPDA M Z,MAHAJAN R T.Lipase biodiversity[J].Indian JSci Tec hn,2011,4(8):971-982.
[3]袁静.耐有机溶剂脂肪酶产生菌筛选及粗酶性质研究[D].南京:南京工业大学硕士论文,2008.
[4]GLOGAUER A,MARTINIV P,FAORO H,et al.Identification and characterization of a new true lipase isolated throughmetagenomic approach[J].M icrob Cell Fact,2011(10):54-68.
[5]DOUKYU N,OGINO H.Organic solvent-tolerantenzymes[J].Biochem Eng J,2010,48(3):270-282.
[6]KUMAR S S,GUPTA R.An extracellular lipase from Trichosporon asahii MSR 54:Medium optim ization and enantioselective deaectylation ofphenylethylacetate[J].Process Biochem,2008,43(10):1054-1060.
[7]CIAFARDINIG,ZULLOB,IRIDEA.Lipase production by yeasts from extra virgin olive oil[J]. Food M icrobiol,2006,23(1):60-67.
[8]ANNIBALE A D,SERMANNIG G,FEDERICI F,et al.Olive-m ill wastewaters:a promising substrate formicrobial lipase production[J]. Bioresource Technol,2006,97(15):1828-1833.
[9]HE Y,TAN T.Use of response surfacemethodology to optim ize culture medium for production of lipasew ith Candida sp.99-125[J].J M olecul Catal B:Enzym,2006,43(1-4):9-14.
[10]HUN C J,RAHMAN R N Z A,SALLEH A B,etal.A new ly isolated organic solvent-tolerant Bacillus sphaericus 205y producing organic solvent-stable lipase[J].Biochem Eng J,2003,15(2):147-151.
[11]BAHARUM SN,SALLEH A B,RAZAK C N A,et al.Organic solvent-tolerant lipase by Pseudomonas sp.strain S5:stability of enzyme in organic solventand physical factors affecting its production[J]. Ann M icrobiol,2003(53):75-83.
[12]叶涛.橄榄树内生菌分离及其耐有机溶剂脂肪酶的研究[D].福州:福建师范大学硕士论文,2011.
[13]胡朝阳,韦晗宁,李春苑.产脂肪酶菌株的筛选及酶学特性研究[J].广西农业生物科学,2006,25(3):261-268.
[14]刘慧,张红星.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006.
[15]何茹.葡萄内生菌中耐有机溶剂脂肪酶菌株的筛选及酶学特性研究[D].石河子:石河子大学硕士论文,2014.
[16]李俊峰,李红芳,段效辉,等.耐有机溶剂脂肪酶产生菌的筛选及其粗酶酶学性质[J].食品科学,2012,33(3):116-120.
[17]江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
Screening of organic solvent tolerance lipase-producing strains and tolerance property of the lipase
ZHANG Zihan,WANG Chen,DOU Yingchun,LIU Ya*
(College ofFood Science,ShiheziUniversity,Shihezi832000,China)
Using the endophyte in Xinjiangw inegrapeasoriginalstrain,the strainswere screened preliminarily by oliveoilemulsifier and rhodamine B plate,and screened secondarily by selection pressure of 1%n-heptane and 1%methylbenzene.The lipase production of strain M-CY 1 w ith organic solvent tolerancewasobtained and identified as Penicillium asturianum by themorphology andmolecular biology techniques.The strain had good genetic stability.Theenzymatic activity of the strainwaspositively relatedw ith grow th ofmycelia.A variety of organic solvents for the activity of lipaseproduced from strainshad apromoting effect,and the promoting effectof xylenewas themostobvious.Theenzymeactivitywas4.99U/m l,and the relative enzyme activity reached to 143.76%.
grape;endophyte;organic solvent tolerance lipases;screen;identification
Q93
0254-5071(2016)01-0019-05
10.11882/j.issn.0254-5071.2016.01.005
2015-11-08
国家自然科学基金(31460031);兵团博士资金(2014BB006)
张梓涵(1990-),女,硕士研究生,研究方向为食品加工与安全。
刘娅(1974-),女,副教授,博士,研究方向为食品生物技术。

