淡紫灰链霉菌H2产α-葡萄糖苷酶抑制剂发酵条件优化
朱钦豪,边亚西,吴 昊,梁智群,陈桂光,曾 伟*(1.广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;2.广西大学 微生物及植物遗传工程教育部重点实验室,广西 南宁 530004;3.广西大学 生命科学与技术学院,广西 南宁 530004)
淡紫灰链霉菌H2产α-葡萄糖苷酶抑制剂发酵条件优化
朱钦豪1,2,3,边亚西1,2,3,吴昊1,2,3,梁智群1,2,3,陈桂光1,2,3,曾伟1,2,3*
(1.广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;2.广西大学 微生物及植物遗传工程教育部重点实验室,广西 南宁 530004;3.广西大学 生命科学与技术学院,广西 南宁 530004)
采用响应面的方法对淡紫灰链霉菌(Streptomyces lavendulae)H2产α-葡萄糖苷酶抑制剂的发酵条件进行优化,经过单因素试验和Plackett-Burman试验设计筛选出对产α-葡萄糖苷酶抑制剂影响较为显著的3个因素:初始pH、接种量、发酵时间,利用最陡爬坡试验确定Box-Behnken中心组合试验设计的中心点,然后进行中心组合试验对发酵条件进行优化,得出最佳发酵条件为初始pH值为6.5、发酵时间4 d、接种量9%,经过3次试验验证,该发酵液抑制率稳定在68.79%,与预测值相接近。
α-葡萄糖苷酶抑制剂;淡紫灰链霉菌;响应面法;降血糖作用
糖尿病是一种由于缺乏胰岛素或者胰岛素活性丧失而导致的一种慢性代谢性疾病[1],可分为Ⅰ型糖尿病和Ⅱ型糖尿病,糖尿病患者数量已相当惊人,并有每年递增的趋势[2-4],其中Ⅱ型糖尿病占大多数。有研究表明,通过控制小肠中的α-葡萄糖苷酶活性可以有效的改善糖尿病人的血糖情况[5,6]。
α-葡萄糖苷酶抑制剂目前是临床上治疗Ⅱ型糖尿病的一线口服降糖药物,它通过可逆性的抑制肠道内的α-淀粉酶和α-葡萄糖苷酶(如α-蔗糖酶等),能分别延缓淀粉和多糖的分解,从而降低血糖[5-6]。目前临床上用的α-葡萄糖苷酶抑制剂主要有阿卡波糖[7]、米格列醇[8]以及一些中药[9]等。桑叶在古代即被中医用于治病,在现代研究中发现桑叶中含有α-葡萄糖苷酶抑制剂黄酮类[10]等物质,在降血糖以及治疗肥胖方面均有应用[11-12];据报道,植物来源的活性物质对α-葡萄糖苷酶有一定的抑制作用[6,13];但植物中α-葡萄糖苷酶抑制剂的含量比较少,且受时间和地域的影响较大,而微生物来源的α-葡萄糖苷酶抑制剂不存在这样的局限性,微生物源的α-葡萄糖苷酶抑制剂主要来源于植物乳杆菌(Lactobacillus plantarum)[14]、淡紫灰链霉菌(Streptomyces lavendulae)[15]和枯草芽孢杆菌(Bacillus subtilis)[16]。本实验室从海洋中筛选得到一株产α-葡萄糖苷酶抑制剂的淡紫灰链霉菌(Streptomyces lavendulae)菌株,但α-葡萄糖苷酶抑制剂产量较低仍需进一步提高。
响应面法优化是微生物发酵培养过程中常用的一种常用的优化方法,陈艳娟等[17]在α-葡萄糖苷酶发酵培养条件优化中利用响应面的方法使发酵液中α-葡萄糖苷酶的酶活提高了35%左右;齐西珍等[18]在α-葡萄糖苷酶抑制剂发酵培养基条件优化过程中,利用响应面优化的方式使发酵液中α-葡萄糖苷酶抑制剂含量较优化前提高了668倍,响应面法在桑叶中α-葡萄糖苷酶抑制剂提取应用中使其产量也有所提高[19-20]。本研究拟采用响应面的方式对淡紫灰链霉菌H2进行培养条件优化,以提高发酵液中α-葡萄糖苷酶抑制剂的含量,为发酵罐培养菌株产α-葡萄糖苷酶抑制剂提供一定的技术支持,以便于大规模量产α-葡萄糖苷酶抑制剂。
1 材料与方法
1.1材料与试剂
1.1.1试验材料
淡紫灰链霉菌(Streptomyces lavendulae)菌株H2由作者实验室保藏,菌株H2来自于广西北海。
1.1.2试剂
4-硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,PNPG):美国Aladdin公司;α-葡萄糖苷酶(15 000 U):美国Sigma公司;其他试剂均为国产分析纯。
1.1.3培养基
斜面培养基:可溶性淀粉2%,KNO30.1%,NaCl 0.05%,K2HPO40.05%,MgSO40.05%,琼脂2%,pH 7.2~7.4,121℃灭菌20 min。
原始发酵培养基:玉米粉4%,黄豆粕粉2%,(NH4)2CO30.06%,NaCl 0.05%,K2HPO40.05%,MgSO40.05%,pH 7.0,121℃灭菌20 min。
优化后发酵培养基:糊精4%,玉米浆干粉1.5%,NaCl 0.05%,K2HPO40.05%,MgSO40.05%,pH 6.5,121℃灭菌20 min。
1.2仪器与设备
YP1200型电子天平:上海精密科学仪器有限公司;HH-4数显恒温水浴锅:常州国华电器有限公司;J2-21高速冷冻离心机:美国Beckman公司;UVmini-1240紫外分光光度计:日本岛津公司;DSW-CJ-1F超净工作台:苏州泰安科技有限公司。
1.3方法
1.3.1α-葡萄糖苷酶抑制活性测定方法[21]
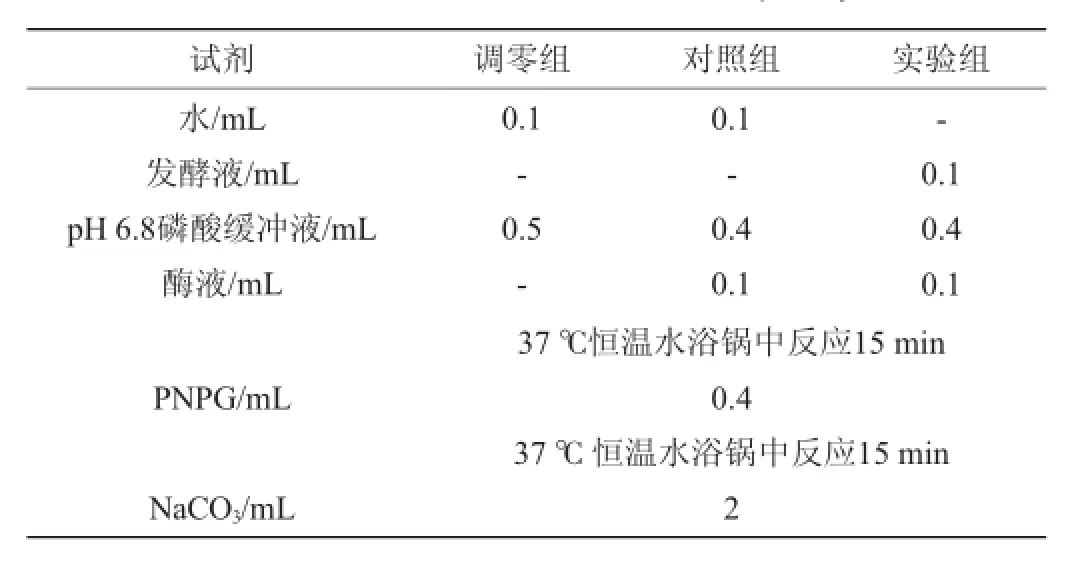
表1 PNPG法测定发酵液抑制率Table 1 The inhibition rate of fermentation liquid by PNPG
α-葡萄糖苷酶抑制活性测定采用PNPG法。发酵结束后,提取一定量的发酵培养基,于4℃、10 000 r/min离心1 min,吸取上清稀释50倍,在波长405 nm条件下测定吸光度值,测定方法见表1。计算出发酵液对α-葡萄糖苷酶的抑制率。

1.3.2单因素试验
以α-葡萄糖苷酶抑制率为考察指标,分别对碳源、氮源、温度、摇床转速、初始pH、接种量、种龄、发酵时间等因素进行单因素试验,确定最佳单因素试验条件。
1.3.3响应面试验
(1)Plackett-Burman(PB)试验设计
选择N=12的PB试验设计,考察糊精(A)、玉米浆干粉(B)、初始pH(D)、装液量(F)、接种量(H)、发酵时间(K)、种龄(L)7个因素对液体发酵产抑制剂的影响的大小,每个因素取两个水平,即低水平和高水平,以抑制率(Y)作为响应值,采用Design-Expert 8.0.6进行试验分析,通过对比各因素显著性,筛选出对抑制剂产率较大的因素。
(2)最陡爬坡试验设计
根据PB试验分析得到3个显著性因素进行试验设计,最陡爬坡方向以PB试验值正负效应为爬坡方向,以PB试验中的步长为来确定最陡爬坡的步长,其余不显著因素取最佳水平,从而确定最佳的产酶抑制率区域。
(3)中心组合(BB)试验
根据PB试验结果和最陡爬坡试验结果确定3因素3水平的中心组合试验,通过Design-Expert8.0.6进行Box-Behnken试验方案设计,设计共有17组试验,最后根据软件分析得出最优的试验结果,进行验证,每组试验重复3次。
2 结果与分析
2.1单因素试验
2.1.1不同碳源和最适碳源浓度对菌株H2产α-葡萄糖苷酶抑制剂的影响
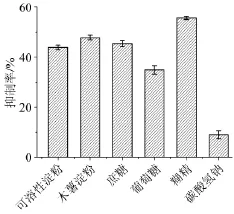
图1 不同碳源对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.1 Effect of different carbon sources on α-glucosidase inhibitor production withS.lavendulaeH2
在原始发酵培养基的基础上,添加40 g/L的不同碳源,由图1可知,以糊精为碳源时,对α-葡萄糖苷酶的抑制率最高,因此选用糊精为最佳碳源;由图2可知,糊精质量浓度为40 g/L时,发酵液抑制率达到最大值。因此,选择质量浓度40 g/L糊精为最适碳源。

图2 糊精质量浓度对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.2 Effect of different dextrin concentration on α-glucosidase inhibitor production withS.lavendulae H2
2.1.2不同氮源及最适氮源浓度对菌株H2产α-葡萄糖苷酶抑制剂的影响

图3 不同氮源对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.3 Effect of different nitrogen sources on α-glucosidase inhibitor production withS.lavendulae H2

图4 玉米浆干粉质量浓度对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.4 Effect of different corn steep dry powder concentration on α-glucosidase inhibitor production withS.lavendulae H2
由图3可知,当硝酸铵作为氮源时,抑制率不足15%;在添加量均为20 g/L时,玉米浆干粉和蛋白胨抑制率相当,但考虑到经济成本,本研究拟选用玉米浆干粉作为最适氮源。由图4可知,在玉米浆干粉添加量为20 g/L时发酵液的抑制率达到最大值,故选择质量浓度玉米浆干粉20 g/L为最佳氮源质量浓度。
2.1.3装液量和摇床转速对菌株H2产α-葡萄糖苷酶抑制剂的影响
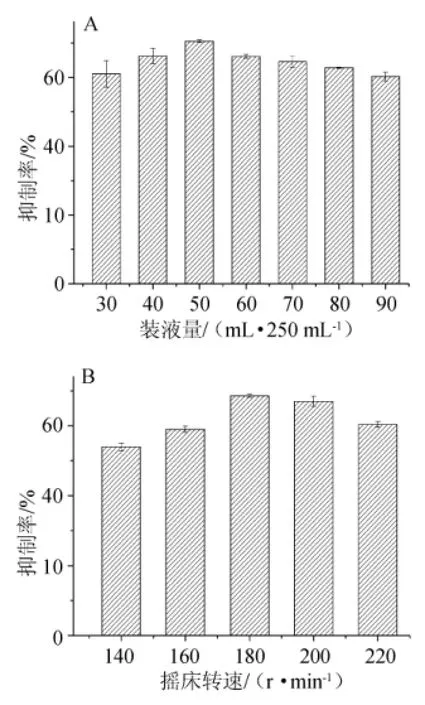
图5 不同装液量(A)和摇床转速(B)对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.5 Effect of different liquid volume(A)and rotate speed(B)on α-glucosidase inhibitor production with S.lavendulae H2
由图5A可知,随着装液量的增加,发酵液对α-葡萄糖苷酶的抑制能力逐渐增加,在装液量为50 mL/250 mL时达到最大值,因此50 mL/250 mL为最佳装液量。由图5B可知,摇床转速在180 r/min和200 r/min时发酵液抑制能力相当,在其他摇床转速条件下发酵液抑制率均有所下降,考虑到设备能源消耗,本研究拟采用较低转速作为最佳转速,即选择180 r/min为后续发酵摇床转速。
2.1.4温度和初始pH对菌株H2产α-葡萄糖苷酶抑制剂的影响
由图6A可知,发酵液的抑制率随着温度的升高先升高后降低,在28℃达到最大值,因此选择28℃为最适培养温度。由图6B可知,初始pH值为10.0时,发酵液抑制率为0,在发酵液初始pH为7.0时,对α-葡萄糖苷酶抑制活力达到最大,选择最适初始pH值为7.0。
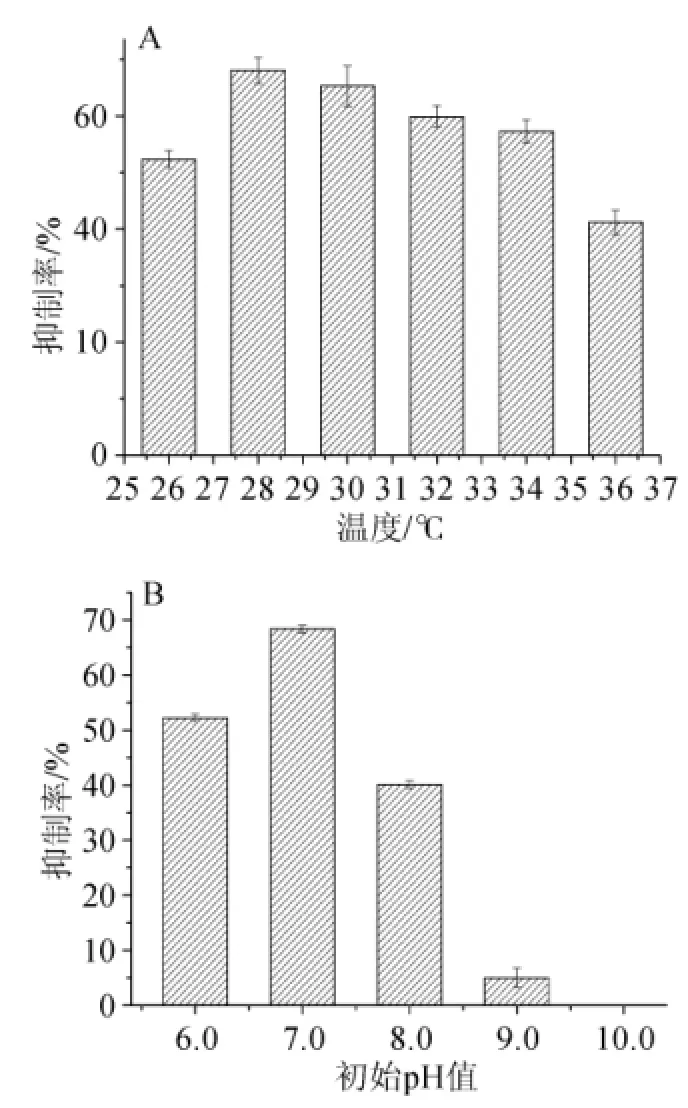
图6 不同温度(A)和初始pH(B)对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.6 Effect of different temperature(A)and initial pH(B)on α-glucosidase inhibitor production withS.lavendulae H2
2.1.5接种量、种龄对菌株H2产α-葡萄糖苷酶抑制剂的影响
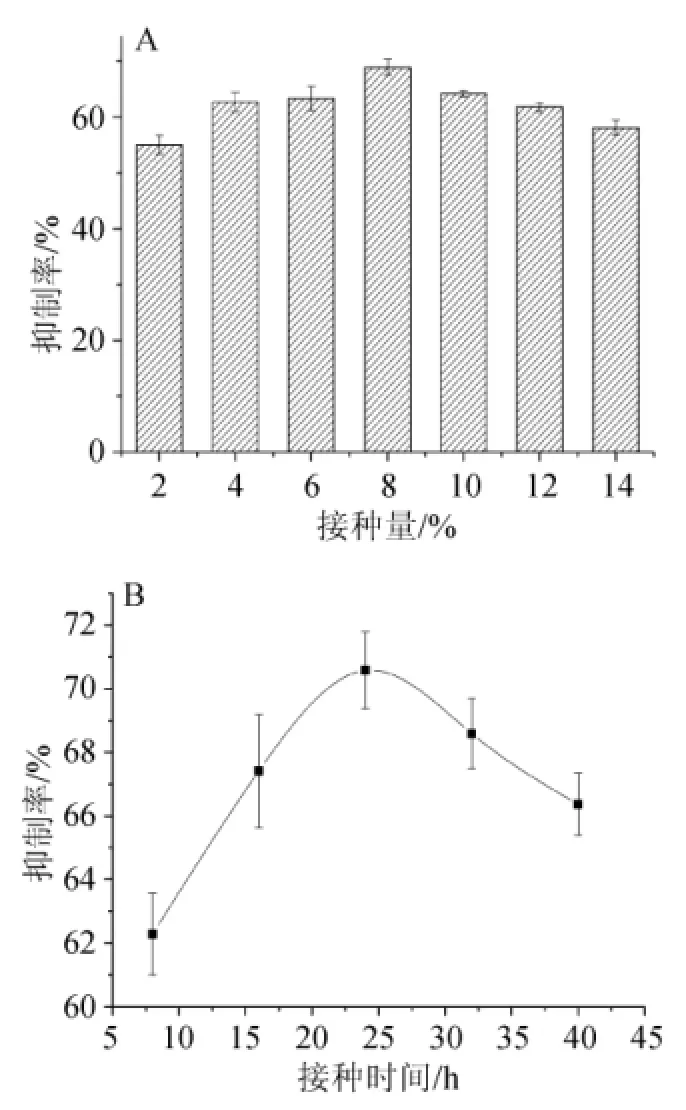
图7 不同接种量(A)和种龄(B)对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.7 Effect of different inoculum(A)and seed age(B)on α-glucosidase inhibitor production withS.lavendulae H2
由图7A可知,接种量在8%时抑制率达到最大值;由图7B可知,在种龄较小时接种,菌体量较少,接种后会有较长的停滞期,在种龄较大时,由于菌体即将进入稳定期也不利于发酵液营养物质的应用,种龄在24 h时(此时菌株处于对数生长期)抑制率达到最大。选用接种量为8%,种龄为24 h最佳。
2.1.6发酵时间对菌株H2产α-葡萄糖苷酶抑制剂的影响

图8 不同发酵时间对菌株H2产α-葡萄糖苷酶抑制剂的影响Fig.8 Effect of different fermentation time on α-glucosidase inhibitor production withS.lavendulae H2
由图8可知,在接种后2 d发酵液的抑制率即达到45%左右,随着发酵时间的增加,发酵液的抑制率不断增加,在第4天到最大值,其后随着时间的增加,还有减小的趋势,由于菌株培养3 d和培养4 d发酵液抑制率差别不大,为提高设备利用效率,采用培养时间3 d为最佳。
2.2 Plackett-Burman(PB)试验
根据单因素试验结果,得到各因素的最佳试验值,根据此结果设计PB试验,试验设计与结果见表2,方差分析见表3。
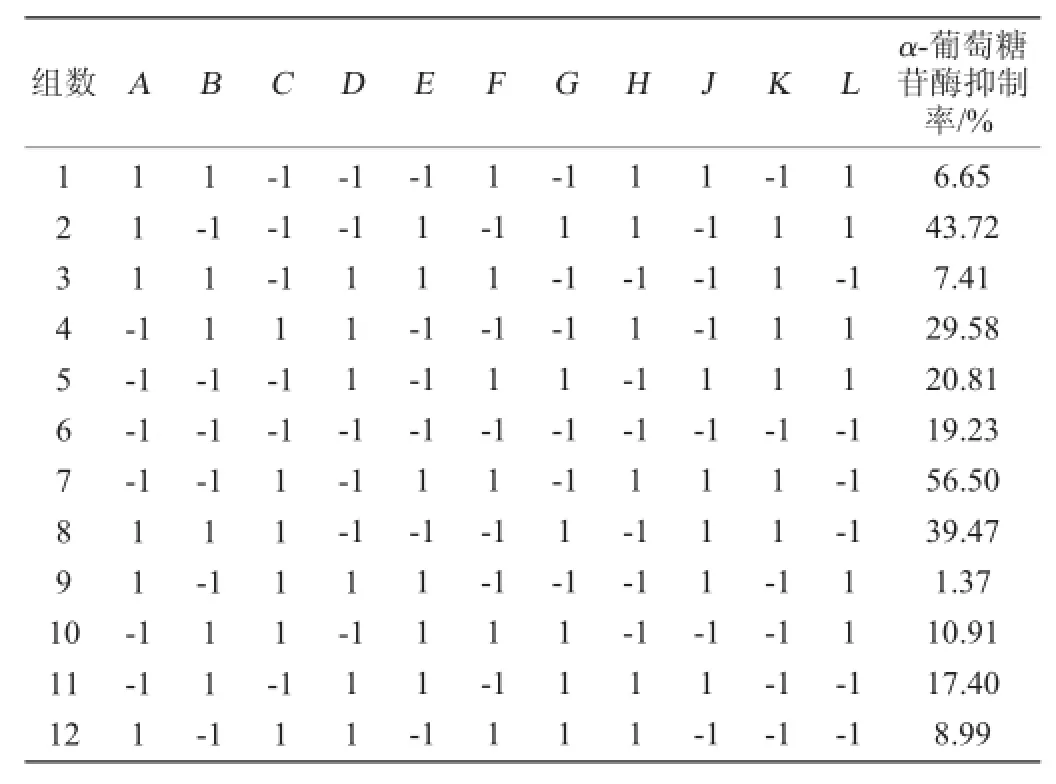
表2 Plackett-Burman试验设计及结果Table 2 Design and results of Plackett-Burman experiments
由表3可知,其中模型的P值为0.020 8<0.05,表明该模型显著,影响菌株H2产α-葡萄糖苷酶抑制剂显著性因素的排序为发酵时间>初始pH>接种量,其中发酵时间和接种量对结果有正效应影响,初始pH值为负效应影响,按Plackett-Burman试验结果的正负效应进行最陡爬坡试验设计。

表3 Plackett-Burman试验结果方差分析Table 3 Variance analysis of Plackett-Burman experiments results
2.3最陡爬坡试验
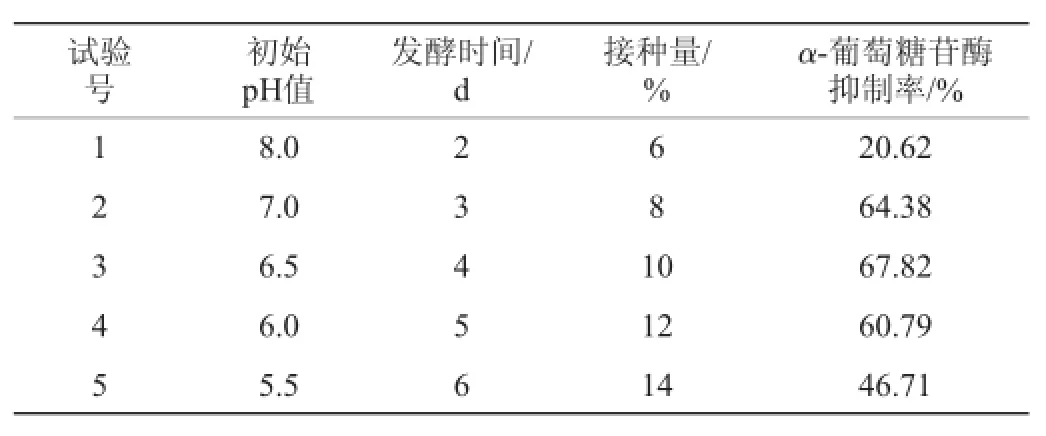
表4 最陡爬坡试验结果Table 4 Results of the steepest ascent experiments
由Plackett-Burman试验结果设计出最陡爬坡试验方案,按照一定的步长确定试验设计,其设计和结果见表4。由表4可知,其中第3组试验具有最高的α-葡萄糖苷酶抑制率,即初始pH值为6.5,发酵时间为4 d,接种量为10%,在之后的BB试验设计中以此条件作为中心点,其他试验条件不变。
2.4响应面试验设计
2.4.1响应面试验设计与结果分析
根据响应面最佳中心点设计BB中心组合试验,试验设计及结果见表5,BB试验方差分析见表6。
由Box-Behnken试验方差分析结果可知,模型的P值<0.000 1,模型高度显著。该模型的拟合方程为Y=70.05-2.38A-1.09B+1.13C+0.75AB+0.58AC+2.12BC-6.62A2-4.67B2-8.22C2,回归方程的决定系数R2为0.980 8,修正系数RAdj2为0.956 0,变异系数为2.31%,信噪比为17.516,失拟项P值为0.1608>0.05,表明失拟项不显著;说明该拟合方程可以用于H2菌株产抑制剂的分析和预测。
利用Design-Expert软件对BB试验组进行响应面分析,得到响应面立体分析结果见图9。由图9可知,初始pH和发酵时间响应面曲线较为陡峭,说明初始pH和发酵时间对抑制剂产量的影响较为明显,在发酵时间不变的情况下,随着初始pH增加,发酵液的α-葡萄糖苷酶抑制率先增加后减少;在初始pH不变的情况下,随着发酵时间的增加发酵液的α-葡萄糖苷酶抑制率先升后降。
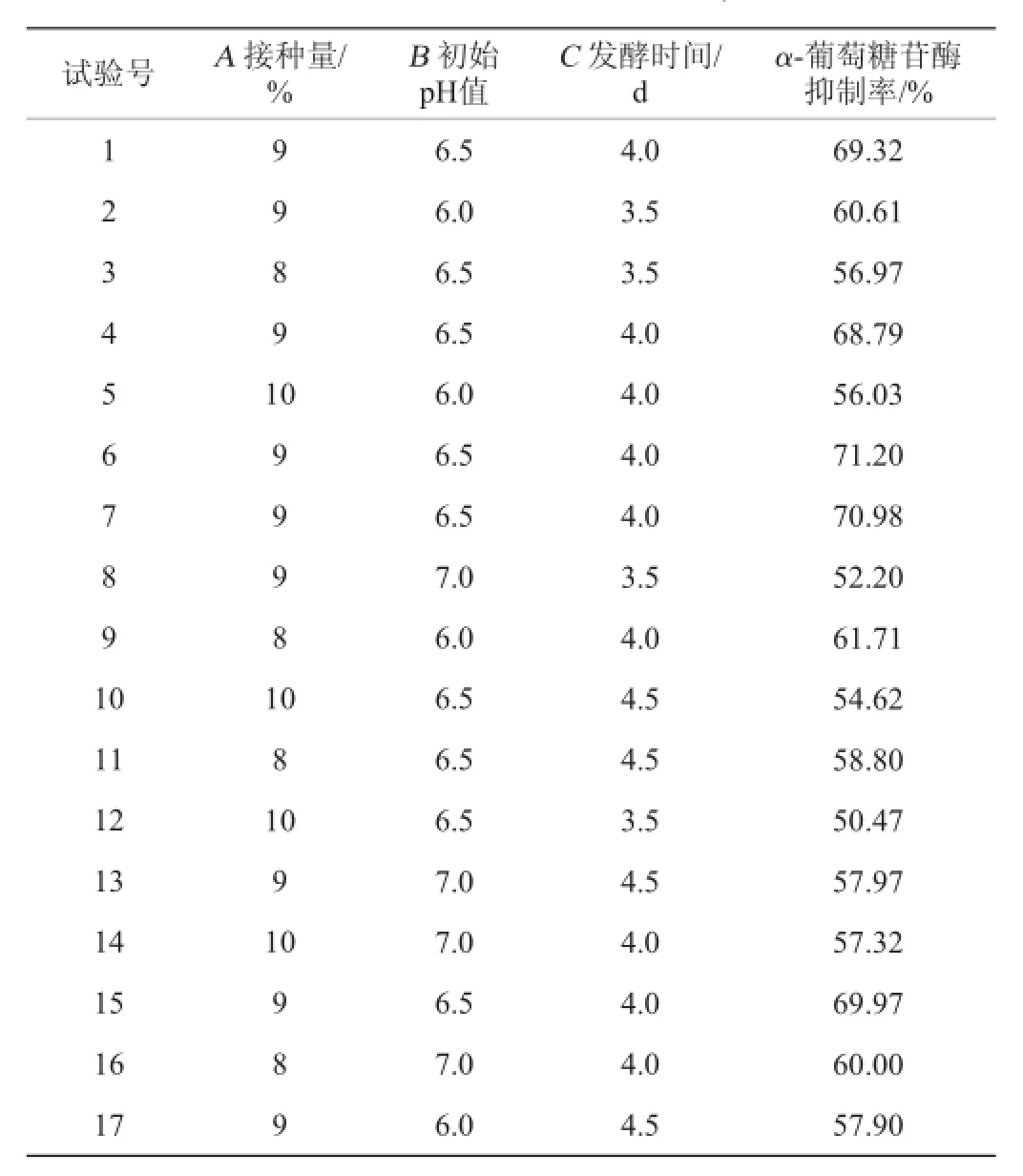
表5 Box-Behnken试验结果Table 5 Results of the Box-Behnken experiments

表6 Box-Behnken试验结果方差分析Table 6 Variance analysis of Box-Behnken experiments results
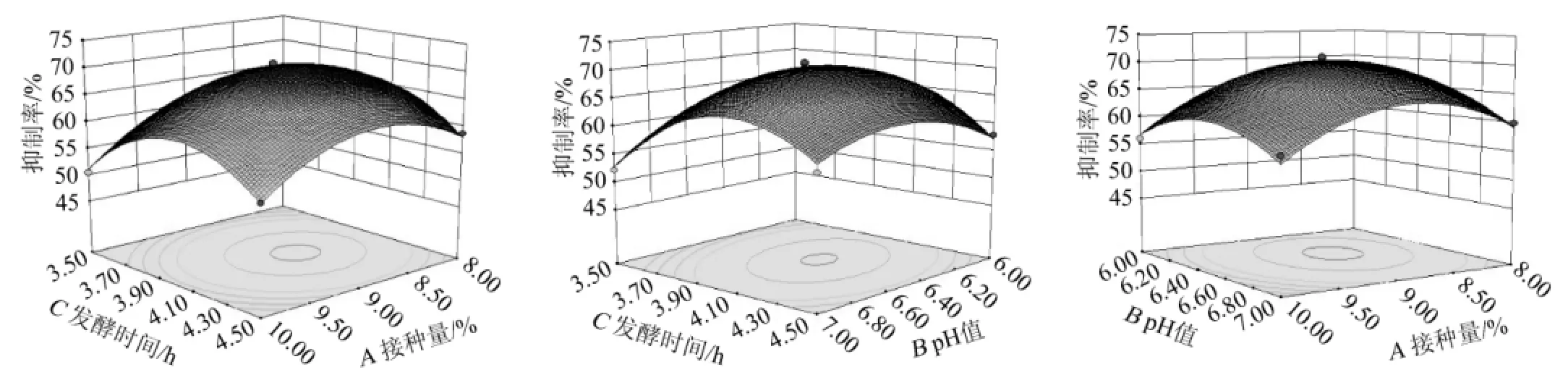
图9 初始pH、接种量和发酵时间交互作用对抑制率影响的响应面和等高线Fig.9 Response surface plots and contour line of effects of interaction between initial pH,inoculum and fermentation time on inhibition rate
2.4.2响应面试验结果预测与验证
通过对响应面试验结果分析,该模型对这三个因素的预测值分别为初始pH值6.44,接种量8.82%,发酵时间4.02 d,响应值达到最大,即抑制率为70.32%,基于实际操作的可行性,将预测值做以下调整:初始pH值为6.5,接种量为9%,发酵时间为4 d。在此条件下对结果进行3次平行验证,最终测得的抑制率为68.79%,与理论值相对误差为2.17%,该结果表明回归方程能较好的预测实验值,即该响应面对菌株H2的发酵条件的优化准确可行。
3 结论
通过单因素试验和Plackett-Burman(PB)试验,筛选出对海洋源淡紫灰链霉菌H2液体发酵产α-葡萄糖苷酶抑制剂的3个主要因素,并经过最陡爬坡试验逼近抑制剂产量最大区域的3个水平,再利用Design-Expert8.0.6软件对其进行中心组合试验设计得出菌株H2的最佳发酵条件组合为:初始pH值6.5、发酵时间4 d、接种量9%,经过3次试验验证,发酵液的抑制率达到68.79%,与预测值(发酵液抑制率70.32%)比较接近,表明该优化结果可靠;在此条件下α-葡萄糖苷酶抑制率比在初始培养条件下提高了14.46%。
[1]NIMAL C I V,PRAVEEN K P,SUNIL C,et al.In vitrostudies on alpha-glucosidase inhibition,antioxidant and free radical scavenging activities ofHedyotis bifloraL.[J].Food Chem,2013,138(2-3)∶1689-1695.
[2]GUARIGUATA L,WHITING D R,HAMBLETON I,et al.Global estimates of diabetes prevalence for 2013 and projections for 2035[J].Diabetes Res Clin Pr,2014,103(2)∶137-149.
[3]SHAW J E,SICREE R A,ZIMMET P Z.Global estimates of the prevalence of diabetes for 2010 and 2030[J].Diabetes Res Clin Pr,2010,87(1)∶4-14.
[4]WHITING D R,GUARIGUATA L,WEIL C,et al.IDF diabetes atlas∶global estimates of the prevalence of diabetes for 2011 and 2030[J].Diabetes Res Clin Pr,2011,94(3)∶311-321.
[5]OBOH G,ADEMILUYI A O,AKINYEMI A J,et al.Inhibitory effect of polyphenol-rich extracts of jute leaf(Corchorus olitorius)on key enzyme linked to type 2 diabetes(α-amylase and α-glucosidase)and hypertension(angiotensin I converting)in vitro[J].J Funct Food,2012,4(2)∶450-458.
[6]BHANDARI M R,JONG A N,HONG G,et al.α-Glucosidase and α-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed(Bergenia ciliata,Haw.)[J].Food Chem,2008,106(1)∶247-252.
[7]FUJISAWA T,IKEGAMI H,INOUE K,et al.Effect of two alpha-glucosidase inhibitors,voglibose and acarbose,on postprandial hyperglycemia correlates with subjective abdominal symptoms[J].Met Clin Exp,2005,54(3)∶387-390.
[8]TATSUMI F,HASHIRAMOTO M,HIRUKAWA H,et al.Concomitant use of miglitol and mitiglinide as initial combination therapy in type 2 diabetes mellitus[J].Diabetes Res Clin Pract,2013,101(1)∶35-44.
[9]田丽梅,王旻.单味中药枸杞降血糖作用及对胰腺组织形态学影响的研究[J].中医药通报,2005,4(1):48-51.
[10]THABTI I,ELFALLEH W,HANNACHI H,et al.Identification and quantification of phenolic acids and flavonol glycosides in Tunisian Morusspecies byHPLC-DAD and HPLC-MS[J].J Funct Foods,2012,4(1)∶367-374.
[11]JESZKA-SKOWRON M,FLACZYK E,JESZKA J,et al.Mulberry leaf extract intake reduces hyperglycaemia in streptozotocin(STZ)-induced diabetic rats fed high-fat diet[J].J Funct Food,2014,8(1)∶9-17.
[12]TSUDUKI T,KIKUCHI I,KIMURA T,et al.Intake of mulberry 1-deoxynojirimycin prevents diet-induced obesity through increases in adiponectin in mice[J].Food Chem,2013,139(1-4)∶16-23.
[13]肖小华,王丽华,徐丽瑛,等.栀子抑制α-葡萄糖苷酶活性成分研究[J].中国实验方剂学杂志,2013,19(8):210-212.
[14]张欢欢,韩瑨,游春苹,等.植物乳杆菌来源的α-葡萄糖苷酶抑制剂的分离纯化[J].应用化工,2015,44(8):1417-1420.
[15]EZURE Y,MARUO S,MIYAZAKI K,et al.Moranoline(1-deoxynojirimycin)fermentation and its improvement[J].Agr Biol Chem,1985,49(4)∶1119-1125.
[16]ONOSE S,IKEDA R,NAKAGAWA K,et al.Production of the alpha-glycosidase inhibitor 1-deoxynojirimycin fromBacillusspecies[J]. Food Chem,2013,138(1)∶516-523.
[17]陈艳娟,杨雪霞,高红亮,等.响应面法优化α-葡萄糖苷酶发酵条件研究[J].食品工业科技,2012,33(4):243-247.
[18]齐西珍,王利强,孟鹏,等.利用响应面法优化α-糖苷酶抑制剂发酵培养基[J].微生物学通报,2012,39(2):203-210.
[19]李娟,刘兰,于配配,等.产α-葡萄糖苷酶抑制剂菌株的筛选及发酵条件优化[J].食品科学,2012,33(23):249-253.
Optimization of fermentation conditions for α-glucosidase inhibitor production by Streptomyces lavendulae H2
ZHU Qinhao1,2,3,BIAN Yaxi1,2,3,WU Hao1,2,3,LIANG Zhiqun1,2,3,CHEN Guiguang1,2,3,ZENG Wei1,2,3*
(1.State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Guangxi University,Nanning 530004,China;2.Key Laboratory of Ministry of Education for Microbial and Plant Genetic Engineering,Guangxi University,Nanning 530004,China;3.College of Life Science and Technology,Guangxi University,Nanning 530004,China)
The fermentation conditions of α-glucosidase inhibitor production withStreptomyces lavendulaeH2 were optimized by response surface methodology.Three factors which had significant effect on α-glucosidase inhibitor production were determined as initial pH,inoculum and fermentation time by single factor experiment and Plackett-Burman design.The central point of Box-Behnken central composite design was determined by the steepest ascent experiments,and then the fermentation conditions were optimized.The optimum fermentation conditions were as follows∶initial pH 6.5,fermentation time 4 d and inoculum 9%.Through three validation tests,the inhibition rate of fermented liquid was in steady at 68.79%,which was approached with predicted value.
α-glucosidase inhibitor;Streptomyces lavendulae;response surface methodology;hypoglycemic activity
Q815
0254-5071(2016)02-0018-06
10.11882/j.issn.0254-5071.2016.02.005
2015-12-13
国家自然科学基金资助项目(31560448,21506039);广西省自然科学基金资助项目(2015GXNSFBA139052)
朱钦豪(1990-),男,硕士研究生,研究方向为食品发酵工程。
曾伟(1987-),男,助理研究员,博士,研究方向为工业微生物的发酵工艺,代谢调控及生物制品开发应用。

