小球藻Chlorellasp.的小分子有机酸/醇培养研究
黄达明,孔 苗,霍书豪*,钱静亚,徐 玲,杜卓蓉,周卫征,崔凤杰,邹 彬(.江苏大学 食品与生物工程学院,江苏 镇江 03;.中国科学院可再生能源重点实验室,中国科学院广州能源研究所,广东 广州 50640)
小球藻Chlorellasp.的小分子有机酸/醇培养研究
黄达明1,孔苗1,霍书豪1*,钱静亚1,徐玲1,杜卓蓉1,周卫征2,崔凤杰1,邹彬1
(1.江苏大学 食品与生物工程学院,江苏 镇江 212013;2.中国科学院可再生能源重点实验室,中国科学院广州能源研究所,广东 广州 510640)
该研究选择一株对水解酸化液耐受性强、高产油脂的优良藻株Chlorellasp.作为出发藻株,向BG11培养基中分别添加不同质量浓度小分子有机酸/醇(乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和乙醇)进行小球藻纯培养试验。在单因素试验的基础上,混合乙酸、丙酸、丁酸和乙醇4种小分子有机物质进行响应面的试验,考察混合小分子有机酸对小球藻Chlorellasp.生长影响,研究表明,当乙酸、丙酸、丁酸和乙醇的质量浓度分别为1.02 g/L、0.42 g/L、0.40 g/L和0.18 g/L时,小球藻的单位体积细胞数含量最高,生长状态最好,能获得较高的生物量(1.18×108CFU/mL)。
小分子有机酸/醇;小球藻;生物量
小球藻因为其极高的营养价值通常被作为一种优质的绿色营养食品。其主要营养成分甚至优于部分日常主要食品,具有高蛋白、低脂肪、低糖、矿物质元素含量丰富的优点,并且具有某些特殊医疗保健功能[1]。但目前来看,小球藻的培养成本很高。
某些较高悬浮固体的有机废水(如酿造废水),通过水解酸化处理,废水生物降解性能可以得到改善,悬浮物得到有效去除后,可以用作一些小球藻的培养基质[2-5]。李硼飞等[6]通过分析测试得知,小球藻很容易利用小分子有机酸,包括乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸。LIU C H等[7]利用与水解酸化液成分相近的丁酸梭菌发酵上清液培养普通小球藻Chlorella vulgarisESP6,发现该小球藻可以在4倍稀释的发酵上清液中生长,其中,乙酸可以被小球藻高效利用。WEN Q等[8]利用剩余污泥厌氧水解酸化液流出物进行蛋白核小球藻Chlorella protothecoides培养,证实小球藻可以利用乙酸,丁酸和少量的丙酸作为碳源生长。
本试验选择一株对水解酸化液耐受性强、高产油脂的优良藻株Chlorellasp.作为出发藻株,首先向小球藻培养基BG11中分别添加不同浓度小分子有机酸(如乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和乙醇)进行小球藻纯培养[4-5]。然后在单因素试验的基础上混合乙酸、丙酸、丁酸和乙醇4种物质进行响应面的设计,考察混合小分子有机酸/醇对小球藻生长影响。本研究的目的是提高小球藻生物量,为获得较高浓度的微藻生物质提供科学参考。
1 材料与方法
1.1材料与试剂
小球藻Chlorellasp.:江苏大学食品与生物工程学院实验室保藏;乙酸、丙酸、丁酸、戊酸、乙醇、异戊酸、异丁酸等(均为分析纯):国药集团化学试剂有限公司。
BG11培养基:NaNO31.5g/L,K2HPO40.4g/L,MgSO4·7H2O 0.75g/L,CaCl2·7H2O0.36g/L,Na2CO30.2g/L,柠檬酸0.06 g/L,柠檬酸铁0.06g/L,Na2EDTA·H2O0.01g/L,蒸馏水1000mL,微量元素溶液A5 1 mL/L。
微量元素溶液A5:H3BO42.86g/L,MnCl2·4H2O1.86 g/L,ZnSO4·7H2O0.22g/L,Na2MoO4·2H2O0.021g/L,CuSO4·5H2O 0.08 g/L,Co(NO3)2·6H2O 0.05 g/L。
1.2仪器与设备
XB-K-25血球计数板:上海求精生化仪器有限公司;PH-3C型便携式PH计:上海三信仪表厂;H-1850R台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;ZC-2102GZ光照恒温摇床:常州中诚仪器制造有限公司。
1.3试验方法
1.3.1小球藻Chlorellasp.的培养
小球藻Chlorellasp.采用BG11培养基在光照摇床内进行无菌培养。培养温度(25±1)℃,转速150 r/min,光照强度为(50±10)μmol/(m2·s)。选取对数期的藻种接种,接种量10%。在BG11培养基中分别添加一定浓度梯度的乙醇、乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸,并调节最终pH值为7.0[9]。考察向BG11培养基中添加不同剂量的小分子有机酸对小球藻Chlorellasp.生物量的影响。
1.3.2藻细胞计数[10-11]
藻细胞计数利用血球计数板进行计数。
1.3.3小分子有机酸/醇小球藻纯培养单因素试验
配制新鲜的BG11培养基,并按照酿醋废水水解酸化液的特点向其中分别加入一定量的乙酸、乙醇、丙酸、丁酸、戊酸、异丁酸和异戊酸,使乙酸的质量浓度梯度为0、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.2 g/L;使丙酸的质量浓度梯度为0、0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L;使丁酸的质量浓度梯度为0、0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L;使异丁酸的质量浓度梯度为0、0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L;使戊酸的质量浓度梯度为0、0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L、0.30 g/L;使异戊酸的质量浓度梯度为0、0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L、0.3 g/L;使乙醇的质量浓度梯度为0、0.05g/L、0.10g/L、0.15g/L、0.20g/L、0.25 g/L,将pH调节为7.0,经121℃高压蒸汽灭菌20 min后,冷却置于超净台内,将处于对数期的藻液转接至摇瓶内,接种量为10%,充分摇匀后置于恒温光照摇床内进行无菌培养,转速150 r/min,温度25℃,光照强度为(50±10)μmol/(m2·s)。
1.3.4响应面试验优化小球藻纯培养条件[12]
在单因素试验基础上,以乙酸(A)、丙酸(B)、丁酸(C)和乙醇(D)为影响因素,小球藻的细胞数(Y)为响应值,利用Design-Expert 7.0软件设计试验方案,各因素与水平的设计如表1所示[8-9]。

表1 Box-Behnken试验设计的因素与水平Table 1 Factors and levels for Box-Behnken experiments design g/L
2 结果与分析
2.1不同乙酸含量条件下小球藻Chlorellasp.的生长情况
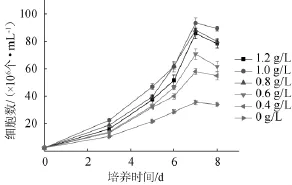
图1 乙酸含量对小球藻Chlorellasp.生物量的影响Fig.1 Effect of acetic acid concentration onChlorellasp.biomass
由图1可知,添加不同量的乙酸对小球藻Chlorellasp.生长均有促进作用,当乙酸质量浓度为1.0 g/L时,小球藻培养至第7天时的生物量为最大,能达到9.4×107CFU/mL。乙酸是小球藻生长中的碳源,小球藻可以利用乙酸进行混养生长。研究表明,产酸废水提供的碳源主要是厌氧产酸反应器产生的乙酸以及其他小分子有机酸,小球藻在生长过程中能很好的利用水解液中的小分子有机酸[13-14]。结果表明,培养基中乙酸含量为0.8~1.2 g/L为宜。
2.2不同丙酸含量条件下小球藻Chlorellasp.的生长情况

图2 丙酸含量对小球藻Chlorella sp.生物量的影响Fig.2 Effect of propionic acid concentration onChlorella sp.biomass
由图2可知,丙酸可以作为小球藻生长的碳源,添加丙酸有利于小球藻的生长。当丙酸质量浓度为0.4 g/L时,小球藻培养至第7天时的细胞数为最大,能达到7.5×107CFU/mL。研究表明,产酸废水提供的碳源主要是厌氧产酸反应器产生的丙酸等其他小分子的有机酸和乙醇,小球藻在生长过程中能很好的利用水解液中的小分子有机酸[13-14]。结果表明,培养基中丙酸含量为0.3~0.5 g/L为宜。
2.3不同丁酸含量条件下小球藻Chlorellasp.的生长情况
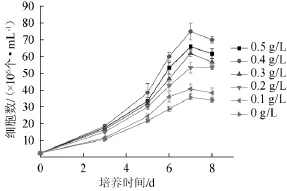
图3 丁酸含量对小球藻Chlorellasp.生物量的影响Fig.3 Effect of butyric acid concentration onChlorella sp.biomass
由图3可知,丁酸可以作为小球藻生长的碳源,添加丁酸有利于小球藻的生长。当丁酸质量浓度为0.4g/L时,小球藻培养至第7天时的细胞数为最大,能达到7.5×107CFU/mL。研究表明,产酸废水提供的碳源主要是厌氧产酸反应器产生的丁酸等其他小分子的有机酸和乙醇,球藻在生长过程中能很好的利用水解液中的丁酸[13-14]。结果表明,培养基中丁酸含量为0.3~0.5 g/L为宜。
2.4不同戊酸含量条件下小球藻Chlorellasp.的生长情况
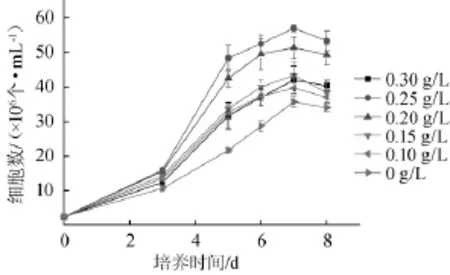
图4 戊酸含量对小球藻Chlorellasp.生物量的影响Fig.4 Effect of valeric acid concentration onChlorellasp.biomass
由图4可知,戊酸也可以作为小球藻生长的碳源,添加戊酸有利于小球藻的生长。当戊酸质量浓度为0.25 g/L时,小球藻培养至第7天时的细胞数为最大,能达到5.7× 107CFU/mL。研究表明,产酸废水提供的碳源主要是厌氧产酸反应器产生的戊酸等其他小分子的有机酸和乙醇,小球藻在生长过程中能利用水解液中的戊酸[13-14]。结果表明,培养基中戊酸含量为0.15~0.25 g/L为宜。
2.5不同乙醇含量条件下小球藻Chlorellasp.的生长情况

图5 乙醇含量对小球藻Chlorellasp.生物量的影响Fig.5 Effect of ethanol concentration onChlorellasp.biomass
由图5可知,乙醇可以作为小球藻生长的碳源,添加适量的乙醇有利于小球藻的生长。当乙醇质量浓度为0.15 g/L时,小球藻培养至第7天时的细胞数为最大,能达到6.3× 107CFU/mL。研究表明,产酸废水提供的碳源主要是厌氧产酸反应器产生的乙醇和小分子的有机酸,小球藻在生长过程中能很好的利用水解液中的乙醇[13-14]。结果表明,培养基中乙醇含量为0.10~0.20 g/L为宜。
2.6不同异丁酸含量条件下小球藻Chlorellasp.的生长情况
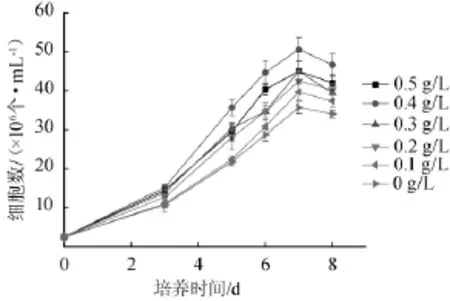
图6 异丁酸含量对小球藻Chlorellasp.生物量的影响Fig.6 Effect of isobutyric acid concentration onChlorellasp.biomass
由图6可知,异丁酸也可以作为小球藻生长的碳源,添加适量的异丁酸也有利于小球藻的生长。当异丁酸的质量浓度为0.15g/L时,小球藻培养至第7天时的细胞数为最大,能达到5.1×107个/mL。研究表明产酸废水提供的碳源主要是厌氧产酸反应器产生的异丁酸和其他小分子有机酸和乙醇,小球藻在生长过程中能很好的利用水解液中的异丁酸[13-14]。结果表明,培养基中异丁酸含量为0.3~0.5 g/L为宜。
2.7不同异戊酸含量条件下小球藻Chlorellasp.的生长情况
由图7可以看出,异戊酸可以作为小球藻生长的碳源,添加适量的异戊酸有利于小球藻的生长。当异戊酸的浓度为0.2 g/L时,小球藻培养至第7天时的细胞数为最大,能达到4.6×107个/mL。研究表明,产酸废水提供的碳源主要是厌氧产酸反应器产生的异戊酸和其他小分子有机酸和乙醇,小球藻在生长过程中能利用水解液中的异戊酸[13-14]。结果表明,培养基中异戊酸含量为0.15~0.25 g/L为宜。
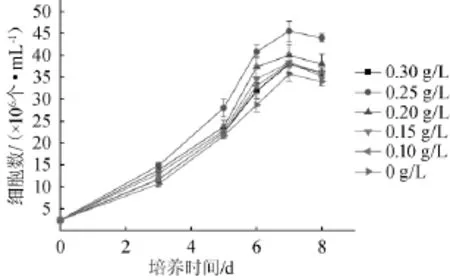
图7 异戊酸含量对小球藻Chlorellasp.生物量的影响Fig.7 Effect of isovaleric acid concentration onChlorellasp.biomass
2.8混合酸小球藻Chlorellasp.的生长优化

表2 响应面试验的设计及其结果Table 2 Design and results of response surface experiments
由单因素试验结果可以看出,小球藻Chlorellasp.在添加乙酸、丙酸、丁酸和乙醇的培养基中,生物量较高,对小球藻的生长起到明显的促进作用,藻体的长势比较好,在单因素试验的基础上,以乙酸(A)、丙酸(B)、丁酸(C)和乙醇(D)质量浓度为自变量,小球藻的生物量(Y)为响应值,对其进行响应面优化设计,确定适合小球藻生长的最佳有机酸组合[15]。响应面试验设计及结果见表2。
使用Design-Expert 7.0软件数据进行分析得到了各因素与小球藻细胞数的回归方程:
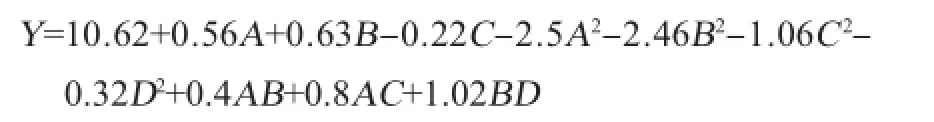
使用Design-Expert 7.0软件对表2中29组试验进行分析回归拟合后得到拟合全变量二次回归方程的方差分析及显著性检验结果见表3。

表3 二次回归模型的方差分析结果Table 3 variance analysis of response surface quadratic model
由表3可知,回归模型极显著(P<0.01),回归模型的决定系数R2=0.990 5,说明此模型与数据的拟合度较高。从回归模型的显著性可以看出,一次项中A、B、C对结果影响极显著(P<0.01),二次项中A2、B2、C2、D2对结果影响极显著(P<0.01),交互项中AB、AC、BD对结果影响极显著(P<0.01)。失拟项P=0.090 6>0.05,说明模型拟合度很好,能够用回归方程模拟小分子有机酸对小球藻生物量的影响。
2.9确定最佳有机酸浓度组合
根据Design-Expert 7.0软件,绘制出小球藻生物量随自变量变化的响应面和等高线,结果见图8。

图8 丁酸、丙酸、乙酸和乙醇交互作用对小球藻生物量影响的响应面及等高线Fig.8 Response surfaces plots and contour line of effect of interaction between butyric acid,propionic acid,acetic acid and ethanol onChlorellasp.biomass
由图8可知,乙酸、丙酸、丁酸和乙醇两因素之间的交互作用较强,对藻的生长能起到明显的促进作用。根据等高线图和响应面立体分析图可以得到最佳优化条件:乙酸1.02 g/L、丙酸0.42 g/L、丁酸0.4 g/L、乙醇0.18 g/L,预测响应值为10.8×107CFU/mL。在此最优条件下进行验证试验,实际测得小球藻生物量为为11.8×107个/mL,与预测值基本一致。
3 结论
以小球藻细胞数为评价指标做单因素试验,可以得出乙酸、丙酸、丁酸和乙醇对小球藻生长的促进作用较为明显,在适宜的有机酸/醇浓度下,小球藻的单位体积细胞数在培养至7 d时分别能达到9.4×107个/mL、7.5×107个/mL、7.5×107个/mL、6.3×107个/mL。为进一步提高小球藻的生物量,以乙酸、丙酸、丁酸和乙醇四个关键因素为自变量,以小球藻的细胞数为响应值进行藻体培养条件的优化,得到了小球藻的Chlorellasp.最优发酵条件:乙酸1.02 g/L、丙酸0.42 g/L、丁酸0.4 g/L、乙醇0.18 g/L,预测响应值为10.8×107CFU/mL。按照此最优培养条件进行优化,测得小球藻的Chlorellasp.的细胞数11.8×107CFU/mL,较优化前的细胞数明显提高,为获得较高浓度的微藻生物质提供科学参考。
[1]齐沛沛.微藻油脂制备生物柴油的研究[D].南京:南京林业大学硕士论文,2008.
[2]王琴,符笳茵,应月,等.废水养殖高油微藻的研究进展[J].现代食品科技,2013,29(6):1442-1446.
[3]任南琪,丁杰,陈兆波.高浓度有机工业废水处理技术[D].北京:化学工业出版社,2012.
[4]殷国梁.普通小球藻对味精废水的净化及其资源化研究[D].天津:天津大学硕士论文,2007.
[5]刘茜.利用啤酒工业废水养殖小球藻的研究[D].南昌:南昌大学硕士论文,2012.
[6]李硼飞.利用废弃碳源异养培养小球藻制备生物柴油的研究[D].哈尔滨:哈尔滨工业大学硕士论文,2012.
[7]LIU C H,CHANG C Y,LIAO Q,et al.Photoheterotrophic growth of Chlorella vulgarisESP6 on organic acids from dark hydrogen fermentation effluents[J].Bioresource Technol,2013,145(10)∶331-336.
[8]WEN Q,CHEN Z,LI P,et al.Lipid production for biofuels from effluent-based culture by heterotrophicChlorella protothecoides[J].Bioenerg Res,2013(6)∶877-882.
[9]LIN L,WAN C,LIU X,et al.Effect of initial pH on mesophilic hydrolysis and acidi cation of swine manure[J].Bioresource Technol,2013,136(5)∶302-308.
[10]黄伟.氮胁迫下Chlorella zofingiensis碳水化合物与脂肪酸合成规律研究[D].广州:中国科学院广州能源所硕士论文,2013.
[11]舒庆.奶牛场废水培养产油微藻研究[D].广州:中国科学院广州能源所硕士论文,2014.
[12]霍书豪,樊迪,徐玲,等.酿醋废水水解酸化流出物培养小球藻实验研究[J].农业机械学报,2015,46(9):198-205.
[13]CHO D H,RAMANAN R,HEO J N,et al.Enhancing microalgal biomass productivity by engineering a microalgal-bacterial community[J].Bioresource Technol,2015(175)∶578-585.
[14]HUO S H,WANG Z G,ZHU S N,et al.Cultivation of Chlorella zofingiensis in bench-scale outdoor ponds by regulation of pH using dairy wastewater in winter,South China[J].Bioresource Technol,2012(121)∶76-82.
[15]齐宁波.温莪术内生真菌诱变株M7226的发酵及其代谢产物的分离纯化[D].南京:南京理工大学硕士论文,2014.
Study on the cultivation of Chlorella sp. using small molecular organic acid/alcohol
HUANG Daming1,KONG Miao1,HUO Shuhao1*,QIAN Jingya1,XU Ling1,DU Zhuorong1,ZHOU Weizheng2,CUI Fengjie1,ZOU Bin1
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;2.Guangzhou Institute of Energy Conversion,Key Laboratory of Renewable Energy,Chinese Academy of Sciences,Guangzhou 510640,China)
Chlorellasp.pure culture experiments was carried out by using the strain with tolerance properties on hydrolysis-acidification liquid and high lipid yield and adding different concentration of small molecule organic acid/alcohol(acetic acid,propionic acid,butyric acid,isobutyric acid,valeric acid,isovaleric acid and ethanol)into BG11 medium.On the basis of single factor experiments,the effect of mixed small molecule organic acids/alcohol(acetic acid,propionic acid,butyric acid and ethanol)on growth ofChlorellasp.was investigated by response surface experiments.The research indicated that when the concentration of acetic acid,propionic acid,butyric acid and ethanol were 1.02 g/L,0.42 g/L,0.40 g/L and 0.18 g/L,respectively,Chlorellasp.had a highest cell number,optimum growth situation and higher biomass(1.18×108CFU/ml).
small molecular organic acid/alcohol;Chlorellasp.;biomass
S968,Q949.2
0254-5071(2016)02-0029-05
10.11882/j.issn.0254-5071.2016.02.007
2015-11-18
国家自然科学基金项目(21506084);江苏省自然科学基金项目(BK20140540);中国博士后科学基金(2014M551519;2015T80502);中国科学院可再生能源重点实验室开放基金(y507k11001)
黄达明(1962-),教授,博士,主要从事农产品生物转化与综合利用研究工作。
霍书豪(1983-),讲师,博士,主要从事废弃物生物转化与生物加工技术研究工作。

